壳聚糖-透明质酸钠-益生菌水凝胶的制备、表征及胃肠道缓释作用
2024-05-20厉佳怡王红磊李娅婕郭婷婷倪乙丹周泉城盛桂华
厉佳怡,王红磊,李娅婕,郭婷婷,倪乙丹,周泉城,盛桂华
(山东理工大学农业工程与食品科学学院,山东 淄博 255200)
水凝胶是一种具有三维网络结构的亲水性物质,其在吸收大量的水后依然不溶,且能够保持交联网络、链的缠结或结晶区域的稳定性[1]。由于具有较好的生物相容性、生物降解性和结构可调性,水凝胶被广泛应用于输送活性物质、组织工程、生物医学工程等领域[2-4]。根据交联类型,水凝胶可以分为化学交联和物理交联。其中化学交联水凝胶虽具有较好的质构特性和稳定性,但是由于存在对生物活性有害的反应,限制了其在生物医药等领域的应用和发展[5-6]。相较之下,物理交联水凝胶通过离子相互作用、蛋白质相互作用、氢键等形成,在制备过程中不需要交联剂,安全性高[7],且其交联网络具有可逆性[8]。多糖是物理交联水凝胶常见的基质成分之一,其能提供物理屏障,保护携带的物质免受胃酸和胆汁的影响[9]。目前,常见荷载益生菌的方法有微胶囊包埋法,但在实际应用中,常常需要多层的包埋才能避免益生菌受损[10]。物理交联水凝胶制备工艺简单,其特有的三维网状结构及溶胀特性有助于益生菌与外界营养物质的交换,便于在加工贮藏过程中维持益生菌的存活及繁殖[11]。因此,采用物理交联水凝胶特有的三维网状结构作为载体,有望成为荷载益生菌的新方法以及新的研究方向。
壳聚糖(chitosan,CS)是目前自然界中唯一的天然阳离子多糖,含有游离的氨基,来源广泛,具有优异的生物相容性、生物降解性、抗菌性、成膜性等特点[12]。透明质酸钠(sodium hyaluronate,SH)是一种天然的高分子聚合物,有较好的生物相容性,且具有抗衰老、抗炎症、保湿润滑等作用[13]。由于SH分子链的一侧暴露着大量羟基,使SH具有很强的亲水性[14],可以与质子化CS链上的氨基结合,通过静电相互作用形成物理交联水凝胶。Sheila等[15]以CS和SH为原料,制备了具有自愈性能和药物缓释特性、可3D打印的聚电解质水凝胶,其具有优异的生物相容性以及抗机械损伤的耐久性。益生菌是指能够定植于人体肠道和生殖系统内对宿主有正面效益的活性微生物,具有抑制肠道炎症、促进营养物质吸收、维持肠道微环境稳态等作用[16]。然而,益生菌在食品加工、后期贮存以及食用的过程中易受到各种外界环境因素的影响,导致其活性降低甚至丧失,从而无法发挥应有的功能特性。因此,如何保证定植在人体肠道内益生菌的活性及数量一直是研究的重点[17],也是本研究的主要内容。
基于上述情况,本实验选择鼠李糖乳杆菌(Lactobacillusrhamnosus)以及乳酸片球菌(Pediococcus acidilactici)为荷载对象,以CS、SH作为主要材料,通过SH羧酸基(—COO-)和CS质子化氨基(—NH3+)之间的静电相互作用形成物理交联水凝胶,对水凝胶质构特性、微观结构、孔隙率及溶胀动力学曲线进行分析,并研究其功能特性;同时以水凝胶为载体荷载益生菌,研究益生菌及培养基对水凝胶质构特性及微观结构的影响,分析水凝胶的载菌性能,探究其胃肠消化特性,研究其在模拟胃肠液中的释放动力学,探寻益生菌水凝胶的释放机制及作用机理,以期为CS-SH物理交联水凝胶的制备及其载菌性能提供一定的材料依据和理论基础。
1 材料与方法
1.1 材料与试剂
SH(分子质量97 kDa)华熙生物科技股份有限公司;CS(脱乙酰度85%,分子质量100 kDa)上海爱纯生物科技有限公司;L.rhamnosus、P.acidilactici菌粉西安荣甄生物科技有限公司;MRS肉汤培养基、MRS琼脂培养基 青岛海博生物技术有限公司;乙酸、氯化钠等其他常用分析纯试剂 国药集团(上海)化学试剂有限公司。
1.2 仪器与设备
立式压力蒸汽灭菌器 上海博迅医疗生物仪器股份有限公司;全温立式振荡培养箱 上海一恒科学仪器有限公司;FD-1A-50型冷冻干燥机 博医康(北京)仪器有限公司;物性测试仪 北京微讯超技仪器技术有限公司;D8-02型X射线衍射(X-ray diffraction,XRD)仪 德国Bruker公司;Nicolet 5700型傅里叶变换红外光谱(Fourier transform-infrared spectroscopy,FT-IR)美国Thermo Nicolet公司;Quanta 250型场发射环境扫描电子显微镜 美国FEI公司。
1.3 方法
1.3.1 CS-SH水凝胶的制备
参考Sheila等[15]的方法。为使CS-SH水凝胶具有较好载菌性能,需要其在实现高溶胀度的同时具有足够的机械强度[18],前期研究了多个因素对水凝胶硬度和溶胀度的影响,通过响应面法确定最佳条件:采用体积分数为0.75%的醋酸溶液溶解CS,配制成1.60 g/100 mL的CS溶液,SH质量浓度为1.60 g/100 mL,将两种溶液按体积比1∶1混合,反应60 min,2 000 r/min离心15 min,弃上清液,即得CS-SH水凝胶。在此条件下制备的水凝胶具有优良的性能和适合的溶胀度,适合作为载菌体系的基础材料。将新鲜制备水凝胶冷冻干燥备用。
1.3.2 益生菌水凝胶的制备
称取一定量的益生菌冻干粉,加入无菌的MRS肉汤培养基(简称MRS)中,配制成质量浓度为1g/L的菌悬液,37 ℃培养14 h。称取0.20 g干燥水凝胶于上述溶液中,在37 ℃继续培养10 h至其溶胀平衡,取出后用滤纸吸干表面菌液,即得荷载益生菌L.rhamnosus、P.acidilactici水凝胶(分别记为CS-SH-LR、CS-SH-PA)。
1.3.3 水凝胶的质构特性
参考冯传兴等[19]的方法,将制备好的湿凝胶表面处理平滑,用TPA模式测定凝胶的硬度、弹性、内聚性、胶黏性以及回弹性5 个指标。TPA测试条件:P/75探头,测试速率及测后速率为1 mm/s,压缩程度为5 mm,停留时间为5 s。
1.3.4 水凝胶微观结构表征
1.3.4.1 扫描电子显微镜(scanningelectron microscope,SEM)分析
用液氮脆断冻干的样品,利用SEM观察复合材料纵截面的形貌,加速电压5 kV。
1.3.4.2 FT-IR分析
将样品与溴化钾粉末以质量比1∶100充分混合,用球形研磨机研磨均匀,抽空下压成透明薄片,装入压片夹,以溴化钾空白压片作对照,在4 000~400 cm-1范围内扫描。
1.3.4.3 XRD测试
将样品置于15 mm×20 mm×1.5 mm的铝片孔中,随后压紧进行测定。XRD的测试条件:扫描范围20°~80°,扫描速率为5°/min,测角精度2θ≤±0.01°,角分辨率≤±0.1,角度重现性为±0.000 1°。
1.3.5 水凝胶的孔隙率
参考朱孟臻[20]的方法,采用溶剂置换法测定CS-SH凝胶的孔隙率,以无水乙醇为介质,水凝胶经冷冻干燥后,称其干质量m1(g);测量干燥凝胶颗粒的高度和直径,计算体积V(cm3);样品经无水乙醇溶胀平衡后,用滤纸吸取水凝胶表面的液体,测质量m2(g);无水乙醇密度为ρ(g/cm3),按式(1)计算多孔水凝胶的孔隙率:
1.3.6 水凝胶的溶胀度
参考行云逸等[21]的方法并稍作修改。将新鲜制备的CS-SH水凝胶放入-20 ℃冷冻24 h后取出,冻干48 h。将冻干后的水凝胶置于37 ℃蒸馏水中12 h以上直至质量恒定,用滤纸吸干水分后称质量,按式(2)计算水凝胶的溶胀度:
式中:m3为冻干后水凝胶质量/g;m4为溶胀平衡时水凝胶的质量/g。
1.3.7 益生菌的荷载量及荷载率
参考Cristina等[22]的方法并稍作修改。将冻干的水凝胶放入对数生长期的L.rhamnosus、P.acidilactici菌液中,并以同生长时期等体积的菌液作为空白对照,振荡培养12 h后,用平板涂布法测定菌液中的菌落总数,荷载后的菌液菌落总数记为X1(CFU),空白单因素优化组的菌液菌落总数记为X2(CFU),荷载量及荷载率分别按式(3)、(4)计算:
1.3.8 游离益生菌的模拟胃肠液耐受性分析
参考Xiao Yao等[14]的方法并稍作修改。人工模拟胃液(simulated gastric fluid,SGF):取16.4 mL浓盐酸与10 g胃蛋白酶混合均匀后定容至1 000 mL,pH 2;人工模拟肠液(simulated intestinal fluid,SIF):称取6.8 g KH2PO4、10 g胰蛋白酶,另加3号胆盐10 g综合模拟肠道的腐蚀性环境,加水稀释至900 mL,并用质量分数为0.4%的氢氧化钠溶液调节pH值至6.8后,定容至1 L。
收集对数期生长的游离L.rhamnosus、P.acidilactici(分别记为LR组、PA组)并在8 000 r/min条件下离心,用生理盐水洗涤3 次,调节终浓度约为108CFU/mL。将9 mL预热好的SGF和SIF分别加到1 mL菌悬液中,以生理盐水组作为对照。由于成人的胃肠道消化时间一般不超过4 h,因此各组样品在37 ℃恒温培养箱中静置培养4 h。孵育结束后,用MTT法测试LR与PA组的细胞存活率,用酶标仪在492 nm波长处测其吸光度。
1.3.9 体外胃肠消化模拟
在模拟消化环境条件下研究水凝胶中L.rhamnosus与P.acidilactici的存活和释放特性。取新鲜制得的益生菌水凝胶置于10 mL SGF中37 ℃消化2 h,并在0、20、40、60、80、100、120 min时取样,取样后立即稀释涂布。以菌悬液作为空白对照,操作步骤相同。SGF消化结束后将剩余水凝胶取出转移至37 ℃的10 mL SIF中,充分混合,在37 ℃恒温振荡培养箱中消化4 h,并在0、40、80、120、160、200、240 min时取样,取样后立即稀释涂布。空白对照组经过SGF消化后,离心取沉淀物,将其投入10 mL SIF中,充分混合,进行肠道消化模拟。测定各组的细胞活性和菌落数。
1.4 数据处理
2 结果与分析
2.1 水凝胶的质构特性
荷载益生菌时,为了提高益生菌的存活率及活性,将冻干后的水凝胶放入含MRS肉汤培养基的菌液中浸泡(记为CS-SH-MRS组),所以额外探究MRS对水凝胶结构及理化特性的影响。内聚性是指介质的内部结合强度[23],由表1可知,各组之间内聚性没有显著差异,说明益生菌及MRS对凝胶内部结构影响较小。各组水凝胶之间的硬度、弹性、胶黏性、回弹性均存在差异,其中CS-SH-MRS组的硬度、弹性、胶黏性与CS-SH组相比均显著降低,这可能是由于MRS对水凝胶组分之间的键造成影响。与CS-SH组相比,CS-SH-LR组的硬度、弹性、胶黏性、回弹性均显著降低,CS-SH-PA组的弹性、胶黏性、回弹性也均显著降低。然而,CS-SH-LR组和CS-SHPA组的硬度、弹性、胶黏性均高于CS-SH-MRS组,这说明MRS对水凝胶质构特性有显著降低的作用,而荷载益生菌能降低MRS对水凝胶质构特性的影响,这一结果与Beckwith等[24]的研究结果相似。

表1 水凝胶及益生菌水凝胶的质构特性Table 1 Texture properties of free and probiotic-loaded hydrogels
2.2 水凝胶的微观结构分析
如图1A、B所示,CS-SH水凝胶的三维网状结构较均匀,孔洞较大,孔洞壁较薄,结构较脆,这可能与其高溶胀度、低硬度的特性有关。图1C、E为荷载L.rhamnosus的CS-SH水凝胶的微观结构,由图1E可以明显看出水凝胶壁上附有很多杆状益生菌,这与L.rhamnosus的形态相符合;图1D、F为荷载P.acidilactici的CS-SH水凝胶的微观结构,P.acidilactici呈球状,附着在CS-SH壁表面,P.acidilactici的荷载密度较L.rhamnosus更高,紧密附着在水凝胶壁上。由图1E、F可以看出,益生菌附着在水凝胶壁上,表明CS-SH水凝胶成功荷载益生菌,且该荷载方式并未明显改变益生菌的表面形态,CS-SH水凝胶可以为L.rhamnosus及P.acidilactici提供一个生物相容性较好的环境。
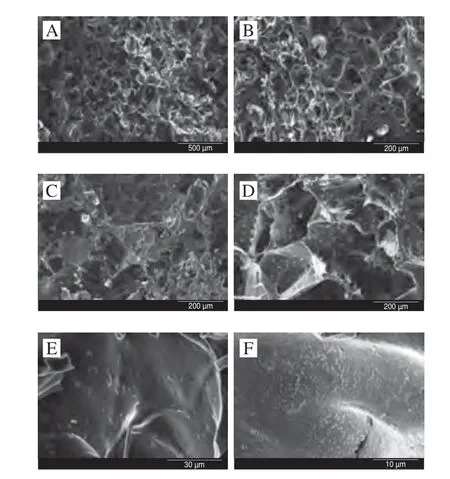
图1 CS-SH水凝胶及CS-SH载菌水凝胶的微观结构Fig.1 Microstructure of free and bacteria-loaded CS-SH hydrogels
2.3 水凝胶的FT-IR分析
由图2可知,各组在3 000~3 750 cm-1处存在强且宽的吸收峰,该区域一般对应O—H、N—H的伸缩振动,与CS和SH组相比,CS-SH组吸收峰红移,为静电相互作用导致的伸缩振动,这表明CS聚阳离子和SH聚阴离子之间形成离子键;与CS-SH组相比,CS-SH-MRS组吸收峰蓝移,透光率降低,说明MRS会影响水凝胶的交联程度,这与质构特性分析结果一致;CS-SH-LR组、CS-SHPA组蓝移距离较少,说明益生菌有助于缓解MRS对水凝胶结构的影响。2 700~3 000 cm-1处的吸收峰为醛基C—H的伸缩振动,荷载益生菌的CS-SH水凝胶,吸收峰减弱消失,这说明益生菌的包埋会影响水凝胶的静电相互作用。1 500~1 680 cm-1以及1 380~1 500 cm-1处为双键C=O(酰胺I带)的对称伸缩振动和羧基的特征峰,均是SH的特征峰[25],交联后所有组别透光率均升高,其中1 500~1 680 cm-1处,与CS组相比,其余组(除SH组外)的吸收峰均红移,可能是由于交联后两种材料之间的静电相互作用导致;1 000~1 200 cm-1是C—O—C伸缩振动峰,为CS的特征峰[26],各组均有此峰,与CS组相比,其余组(除SH组外)吸收峰略红移,这可能是由于分子内电子的跃迁。综上所述,CS和SH通过静电相互作用形成水凝胶,这与Sheila等[15]的研究结果一致,而MRS会降低CS、SH之间的静电相互作用,荷载益生菌可以有效缓解该影响。
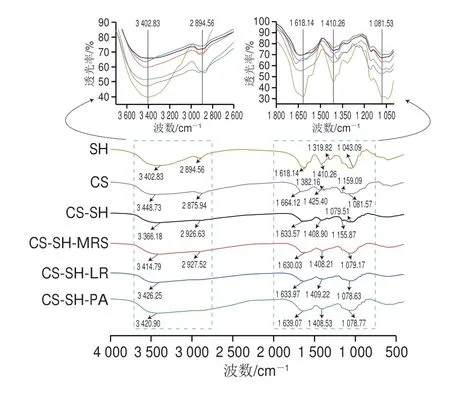
图2 CS-SH水凝胶及CS-SH载菌水凝胶的FT-IRFig.2 FT-IR spectra of free and bacteria-loaded CS-SH hydrogels
2.4 水凝胶的XRD分析
从图3可以看出,CS和SH在10.71°和19.94°处有较强的特征衍射峰,其中CS在19.94°处的强度较高,这可能是CS的特征衍射峰,说明CS有明显的晶体结构。CS和SH交联后,两处特征峰强度均降低,特别是CS-SH-MRS组和CS-SH-PA组在10.71°处的衍射峰强度较低,峰宽减小,说明这两组水凝胶的结构更松散;其余各组在两峰处的强度与SH相似,说明CS和SH之间具有较强的相互作用,从而使得各物质的特征衍射峰降低或者消失,同时也说明水凝胶结晶度低,为非结晶态,证明CS-SH物理交联水凝胶具有良好的相容性[27]。
2.5 水凝胶的溶胀性能
CS-SH水凝胶的溶胀度为(743.48±24.60)%,孔隙率为(59.01±3.84)%。图4为37 ℃ CS-SH水凝胶在蒸馏水、SGF、SIF中的溶胀动力学曲线。在溶胀初期,水凝胶迅速吸水膨胀,溶胀度增长速度较快,大约在20 min左右,水凝胶在蒸馏水和SGF中的溶胀速率逐渐减缓,并趋于平衡,最终溶胀度分别稳定在735.28%和744.55%,即吸水能力分别为7.353 g/g和7.446 g/g。30 min后,水凝胶在SGF中溶胀度降低,这可能是因为CS在酸性条件下容易形成带正电的阳离子,破坏了CS与SH之间的静电相互作用,导致外围不稳定的结构被破坏。在30~150 min之间,CS-SH水凝胶在SIF中的溶胀度均高于在SGF中的溶胀度。在180 min后,水凝胶的溶胀度增长速率减缓,逐渐达到平衡,这可能是由于外界的H+与CS交互达到平衡。SIF中的水凝胶溶胀度在60 min左右最高,约1 202.27%,即吸水能力为12.02 g/g。随后,溶胀度逐渐降低并达到平衡,约为552.27%,即吸水能力为5.52 g/g。这是因为SH成功接枝到水凝胶中,赋予了CS大量的—COOH官能团,在中性或碱性条件下—COOH会电离成—COO-,可能会导致水凝胶的吸水性能短暂升高,这一特性有助于载菌CS-SH水凝胶在肠液中的释放;但在酸性条件下,—COOH基团不易解离,而是趋向与SH链上的羟基形成离子键,从而阻止水分子进入凝胶网络,使得水凝胶的平衡溶胀度大大下降,这一特性与行云逸等[21]的研究结果相似。
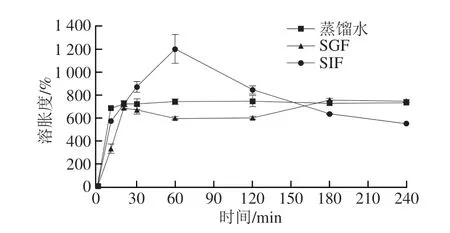
图4 CS-SH水凝胶的溶胀动力学曲线Fig.4 Swelling porosity of CS-SH hydrogel
2.6 水凝胶的荷载量及荷载率
水凝胶的三维网状结构有利于与外界进行物质交换,是一种较好的荷载益生菌的材料[28]。如图5所示,0.2 g干燥水凝胶的L.rhamnosus、P.acidilactici荷载量分别为1.15×109CFU和1.25×109CFU,荷载率分别为93.36%和88.04%,两组之间的荷载量无显著差异,这说明CS-SH水凝胶具有较好的生物相容性;但CS-SH-LR组的荷载率显著高于CS-SH-PA组(P<0.05),这可能是由于L.rhamnosus菌粉的浓度较低,导致相同时间培养条件下原菌液浓度较低,从而使其荷载率较高。综上,CS-SH水凝胶具有良好的载菌性能和高生物相容性。
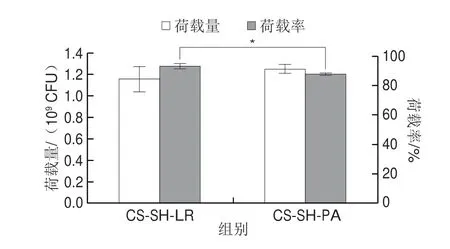
图5 CS-SH载菌水凝胶的荷载量及荷载率Fig.5 Loading amounts and loading rates of probiotics into CS-SH hydrogel
2.7 模拟胃肠液耐受性分析
一般认为,益生菌必须以足量活性状态转移到肠道中才能发挥其理想的益生作用,而大多数乳酸菌对胃肠道强酸性和高浓度胆盐环境的耐受力普遍较弱,很难在这种恶劣环境下生存。本实验选用L.rhamnosus、P.acidilactici测定其经模拟胃肠液孵育后的存活率。如图6所示,在SGF中孵育4 h后,L.rhamnosus与P.acidilactici全部丧失活性。此外,这些乳酸菌对肠道消化液也很敏感,孵育后存活的细胞分别减少94.18%和87.58%。这与大量研究结果[14,29]一致,绝大多数益生菌在通过人体胃肠道时会显著丧失生存能力。
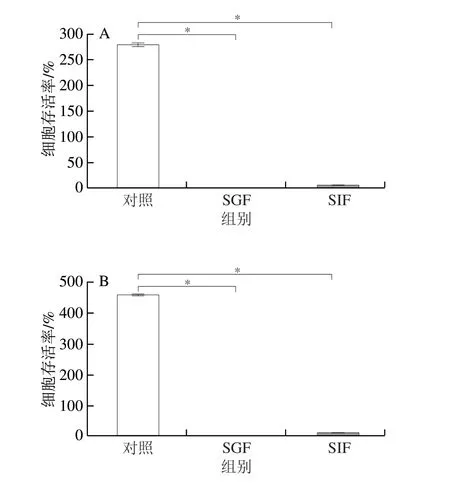
图6 游离L.rhamnosus(A)和P.acidilactici(B)在模拟胃肠道中的活性Fig.6 Survival rates of free L.rhamnosus (A) and P.acidilactici (B) in simulated gastrointestinal conditions
2.8 胃肠消化模拟动力学曲线
如图7A所示,在经历模拟胃肠液孵育后,LR及PA组的活菌数量均急速降低,约40 min时细胞存活率分别为3.80%以及4.23%,说明这两种益生菌对SGF的耐受力较弱。除此之外,包封在水凝胶中的L.rhamnosus、P.acidilactici的释放量较少,约120 min时分别为18.72%和13.16%,这意味着水凝胶可以提高益生菌在SGF中的存活率。从图7B可以看出,游离益生菌的活性整体呈降低趋势,在消化4 h后,细胞活性约为0.59%,而L.rhamnosus在120 min时,活性消失,说明这两种益生菌对SIF的耐受性较差,相比之下L.rhamnosus的耐受性更差。包封后的L.rhamnosus、P.acidilactici在SIF中的活性明显增强,其中CS-SH-LR组在SIF中持续释放,细胞活性维持在20%左右,在120 min后逐渐降低,在240 min时细胞活性约为3.96%;相比之下CS-SH-PA组的细胞活性更强,在40 min时细胞活性达到最大值,约为46.51%,随后细胞活性逐渐降低。
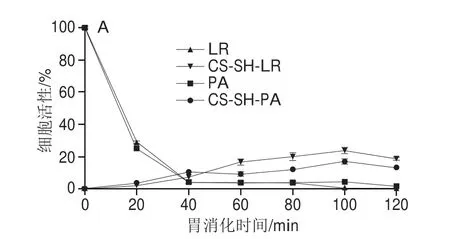
图7 游离益生菌及CS-SH载菌水凝胶在模拟胃肠液中的动力学曲线Fig.7 Kinetic curves of free probiotics and bacteria-loaded CS-SH hydrogel in simulated gastroenteric fluid
游离益生菌及益生菌水凝胶在模拟胃肠液中连续消化的涂布结果如图7C、D所示。与细胞活性结果不同的是,游离益生菌在SGF中消化60 min后已全部失活,这可能是由于胃液消化导致细胞损伤,使其无法在平板上生长形成菌落;益生菌水凝胶在120 min内均未在平板上形成菌落(图7C),这可能是由于水凝胶外围不稳定的结构在消化过程中逐渐掉落,但荷载的益生菌仍黏附在水凝胶壁上,这些益生菌仍具有一定的活性,从而导致MTT法测定结果具有一定的细胞活性。游离益生菌在模拟肠消化过程中全部失活,而益生菌水凝胶进入SIF时立即溶胀,释放益生菌,在模拟肠消化初期,益生菌数量逐渐减少,这可能是由于肠液中胆盐的作用;CS-SH-LR组以及CS-SH-PA组益生菌数量分别在80 min及120 min时逐渐增加,分别在200 min及160 min时达到最大值,菌落数分别为6.30(lg(CFU/mL))和6.12(lg(CFU/mL))(图7D),这是由于水凝胶中益生菌在SIF中释放繁殖,随后活菌数便逐渐下降。
与游离益生菌相比,益生菌水凝胶在经过模拟胃肠液连续孵育后仍能保持肠道中的细胞活力在20%以上,SIF中的菌落数均能维持在5(lg(CFU/mL))左右,有利于益生菌在人体肠道中定植。相比之下,游离的益生菌对这种连续性损伤高度敏感,几乎没有活菌残留。这些结果证实了水凝胶封装技术在L.rhamnosus、P.acidilactici应对胃肠道挑战时所提供的巨大生存优势。
2.9 动力学模型
益生菌水凝胶的体外释放机制可分为3 种,分别是扩散控制、降解溶蚀控制以及溶胀控制[30]。利用Origin软件对CS-SH-LR组及CS-SH-PA组的肠消化涂布结果进行拟合,建立其在SIF中释放动力学方程。如表2所示,益生菌水凝胶的体外释放Weibull分布方程模型拟合效果最好,CS-SH-LR和CS-SH-PA的决定系数R2分别为0.868 1以及0.907 0,释放机制主要为表面侵蚀释放作用[30]。
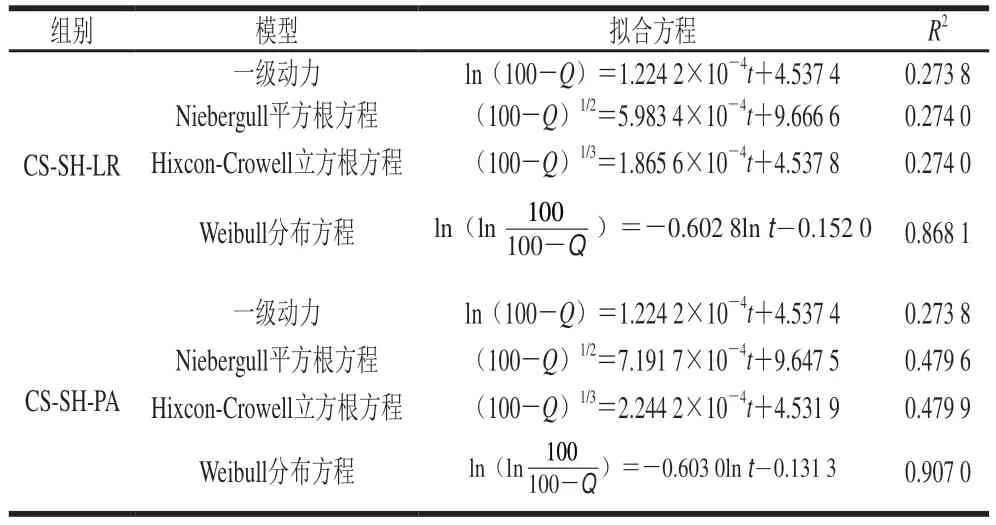
表2 CS-SH载菌水凝胶在肠液中的释放动力学模型拟合Table 2 Kinetic models for the release of bacteria-loaded CS-SH hydrogel in simulated intestinal fluid
3 结论
本研究采用物理交联方法制备了CS-SH水凝胶。该水凝胶设计依据是在酸性环境下CS分子链上的氨基易电离,带有大量正电荷,而SH的表面带有羧基,可以与电离的CS通过静电相互作用结合,形成物理交联水凝胶。将水凝胶浸没在对数生长期的L.rhamnosus、P.acidilactici菌液中,共同培养12 h,即得荷载益生菌的CS-SH水凝胶。在1 500~1 680 cm-1处,与CS组相比,CS-SH水凝胶吸收峰红移,与SH组相比,其吸收峰蓝移,说明CS、SH成功通过静电相互作用交联。载菌性能结果表明MRS对水凝胶质构特性影响最大,但不影响水凝胶的内部结构,且荷载益生菌可以缓解该影响;水凝胶结晶度低、非结晶态,载菌后水凝胶结构更松散,各物质之间具有良好的相容性;CS-SH水凝胶三维网状结构较均匀,孔洞较大,孔洞壁较薄,结构较脆,益生菌附着在水凝胶壁上,形态良好。在30~150 min之间,CS-SH水凝胶在SIF中的溶胀度均高于在SGF中的溶胀度,有助于益生菌的控释。CS-SH水凝胶对L.rhamnosus和P.acidilactici的荷载量分别为1.15×109CFU和1.25×109CFU,荷载率分别为93.36%和88.04%,两组之间的荷载量无显著差异,这说明CS-SH水凝胶具有较好的生物相容性,是一种较好的荷载益生菌材料;模拟胃肠消化结果显示,CS-SH水凝胶对益生菌具有保护作用,具有较好的肠道缓释特性,其释放机制为表面侵蚀释放作用。物理交联水凝胶荷载益生菌在实际应用中有重要意义,天然生物成分通过物理交联合成水凝胶,并对荷载益生菌进行靶向运输,这可能成为益生菌递送体系研究的突破点。
