猕猴桃果实后熟软化过程中己糖激酶基因的表达分析
2024-05-20董文娟向妙莲陈金印曾教科
董文娟,陈 明,向妙莲,陈金印,曾教科
(江西农业大学农学院,江西省果蔬保鲜与无损检测重点实验室,江西 南昌 330045)
猕猴桃(ActinidiachinensisPlanch.)原产自中国,其在中国种植面积和产量均稳居世界第一位,素有“VC之王”之称[1-3]。猕猴桃属于呼吸跃变型果实,采后生理代谢旺盛,伴随果实快速软化,商品性丧失。应用保鲜技术可延缓猕猴桃后熟软化,但消费者购买后往往无法即食,果实硬度较高、口感酸涩,放至完全软化则易腐烂,这已成为猕猴桃产业采后贮运最为突出的问题[4]。因此,加深猕猴桃果实后熟软化生理机制的研究,对促进猕猴桃绿色保鲜技术的开发利用和减少采后品质劣变具有重要的科学意义和经济意义。
对猕猴桃果实后熟软化属性的研究主要集中在乙烯合成及信号转导、细胞壁结构及组分的变化、淀粉含量、淀粉降解酶活性及相关基因表达等方面[5-6]。其中,淀粉快速水解是猕猴桃贮藏前期软化的主要原因[7-8]。淀粉水解成己糖后,经过己糖激酶(hexokinase,HXK)(EC 2.7.1.1)的磷酸化作用才能参与下游的糖酵解和呼吸代谢[9-10]。因此,HXK在糖代谢和植物生命活动中发挥着重要作用[11]。目前,HXK基因已在多种植物中被分离和鉴定。番茄中至少有4 个HXK基因[12],拟南芥中有6 个HXK基因[13],梨中有10 个HXK基因[14],苹果中有9 个HXK基因[15],桃中有5 个HXK基因[16]。Nardozza等[17]从猕猴桃EST数据库中鉴定出3 个HXK基因,其中HK3与己糖磷酸化有关,并参与猕猴桃果实早期发育。然而,猕猴桃基因组发表后,关于猕猴桃HXK基因家族成员的研究和报道却相对较少。
HXK是一种双功能酶,可磷酸化己糖或作为葡萄糖信号感应器,在糖酵解、淀粉降解、细胞壁合成途径和戊糖磷酸途径等代谢途径中发挥作用[18-20]。HXK可调控植物生长发育以及各种生物和非生物胁迫过程,如环境和营养胁迫[21-22]、植株生长[23-24]、种子发育[25]和果实病害防御[16,26]等。HXK也被报道能够影响果实生理代谢和后熟软化过程[27]。Hu Dagang等[28]研究发现,外源葡萄糖激活MdHXK1的表达,使下游转录因子MdbHLH3磷酸化,进而上调MdMYB1和ANS等基因表达,促进苹果花青苷合成。在碳源缺乏的情况下,花青苷合成抑制子MYB27被显著激活,果肉花青苷积累受抑制[29]。李成梁等[30]研究发现,香蕉后熟过程中甘露糖上调HXK活性和HXK基因的表达,而N-乙酰-D-葡萄糖胺(N-acetyl-D-glucosamine,NAG)(HXK抑制剂)则抑制HXK活性的升高和内源乙烯的合成,说明HXK在果实后熟软化中发挥重要作用。然而,目前有关HXK参与猕猴桃后熟软化的报道较少。
本实验以‘红阳’猕猴桃为试材,研究10 mmol/L NAG处理对猕猴桃果实常温贮藏期间软化特性、品质、呼吸速率和乙烯释放量、HXK活性以及AcHXKs基因表达的影响,进一步阐释猕猴桃后熟软化调节机制,以期为猕猴桃果实采后贮藏保鲜技术的研发提供理论依据。
1 材料与方法
1.1 材料与试剂
‘红阳’猕猴桃采自江西宜春奉新县猕猴桃果园,果实采摘时为八成熟(平均单果质量62.81 g,硬度73.64 N,总可溶性固形物(total soluble solid,TSS)质量分数8.29%),当天运回江西省果蔬保鲜与无损检测重点实验室,挑选无病虫害、无机械损伤、大小均匀的猕猴桃果实作为实验材料。
NAG 上海源叶生物科技有限公司;HXK活性检测试剂盒 北京索莱宝科技有限公司;植物淀粉含量测试盒 南京建成生物工程研究所;猕猴桃总RNA提取试剂盒 天根生化科技(北京)有限公司;反转录试剂盒和实时聚合酶链式反应(polymerase chain reaction,PCR)预混液 翌圣生物科技(上海)股份有限公司。其他生化试剂均为国产分析纯。
1.2 仪器与设备
TMS-Touch 质构仪 美国F TC公司;糖度计日本ATAGO公司;SpectraMax190酶标仪 美谷分子仪器(上海)有限公司;Check point便携式O2/CO2测定仪丹麦PBI Dansensor公司;GC-2014气相色谱仪 日本岛津公司;BioDrop超微量核酸蛋白分析仪 英国柏点公司;CFX96TMPCR仪 美国Bio-Rad公司。
1.3 方法
1.3.1 果实处理
将猕猴桃果实随机分成两组,即处理组(NAG组,10 mmol/L NAG浸泡10 min)和对照组(CK组,清水浸泡10 min),每组210 个果实。果实室温晾干后分装入低密度聚乙烯袋(39 cm×30 cm,厚度0.03 mm)中,置于(20±1)℃、相对湿度85%的环境下贮藏12 d,每2 d取样测定果实硬度、呼吸速率、乙烯释放量和TSS含量。同时取果肉组织(去除果皮、中柱和带籽部分)放于液氮中速冻,在-80 ℃条件下贮藏,用于后续测定可滴定酸(titritable acidity,TA)、VC、淀粉、果胶、还原糖含量、HXK活性和提取总RNA。10 个果实为1 个重复,共3 个生物学重复。
1.3.2 硬度测定
每组随机抽取30 个果实,使用质构仪测定硬度(质构剖面分析模式)。单个猕猴桃果实在赤道面去皮后,测定赤道面180°两个点的果肉硬度。质构仪参数设置为探头直径2 mm、穿刺距离8 mm、测试速率100 mm/min、起始力0.5 N。以每次测定的最大力值为硬度,取平均值,单位为N。
1.3.3 呼吸速率和乙烯释放量测定
每组随机选取15 个果实,分3 次放入1 L的容器中,密封2 h后在容器顶部抽取气体测定呼吸速率和乙烯释放量,测定重复3 次,取平均值。使用Check point便携式O2/CO2测定仪测定CO2体积分数,以CO2释放速率表示呼吸速率,单位为mL/(kg·h)。抽取密封容器顶部1 mL气体,使用气相色谱仪测定乙烯释放量,单位为nL/(kg·h)。
1.3.4 TSS、TA和VC含量测定
将测硬度的30 个果实随机分成3 组,即3 个生物学重复。每组取位于果实赤道部的外果肉混合榨汁,采用手持数字糖度计测定TSS含量。
TA含量测定参照曹建康等[31]的方法。将2.0 g果肉于液氮中研磨成粉末,后加入25 mL蒸馏水,静置30 min后吸取上清液10 mL于三角瓶中,加入2~3 滴质量分数1%酚酞溶液,用已标定的NaOH溶液滴定至溶液变粉红色且30 s内不褪色。
VC含量测定参照曹建康等[31]的方法。将2.0 g果肉于液氮中研磨成粉末,后加入25 mL 20 g/L的草酸溶液混合,过滤后吸取10 mL滤液于三角瓶,用已标定的2,6-二氯靛酚溶液滴定至微红色且15 s内不褪色,记录滴定液体积,VC含量单位为mg/100 g。
1.3.5 淀粉、果胶和还原糖含量测定
淀粉含量采用植物淀粉含量测试盒进行测定。利用酸水解法将淀粉分解成葡萄糖,再使用蒽酮比色法进行定量,测定620 nm波长处的吸光度,从而计算淀粉的含量,结果表示为淀粉质量分数。
果胶含量的测定用咔唑比色法,还原糖含量测定采用3,5-二硝基水杨酸法,具体步骤参照曹建康等[31]的方法。
1.3.6 HXK活性测定
HXK活性使用HXK活性检测试剂盒测定,以每克果肉每分钟生成1 nmol的烟酰胺腺嘌呤二核苷酸磷酸定义为1 个酶活力单位。HXK活性单位为U/g。
1.3.7HXKs基因筛选与序列分析
利用Kiwifruit Genome Database(https://kiwifruitgenome.org/organism/5)从红阳猕猴桃基因组中筛选获得14 个HXKs基因。通过猕猴桃基因组序列比对,查找到这14 个HXKs的氨基酸序列,利用邻接法联配后通过Clustal X(v1.81)软件进行比对,再导入到FigTree(v1.3.1)软件构建系统进化树。
1.3.8HXKs基因表达分析
猕猴桃果肉RNA提取按照RNAprep Pure Plant Plus Kit(Polysaccharides &Polyphenolics-rich)RNA提取试剂盒说明书操作。通过琼脂糖凝胶电泳检测总RNA的完整性,利用BioDrop超微量核酸蛋白分析仪检测总RNA纯度和浓度后,用反转录试剂盒Hifair®III 1st Strand cDNA Synthesis SuperMix for qPCR(gDNA digester plus)反转录成cDNA。
基因表达研究采用实时聚合酶链式反应(real-time polymerase chain reaction,real-time PCR)方法。利用Primer 3在线软件设计引物,详见表1,根据溶解曲线验证引物的特异性。逆转录real-time PCR应用CFX96TMPCR仪,反应体系(10 μL)和反应程序参照试剂盒(HieffR qPCR SYBR Green Master Mix (NO ROX))说明书进行。基因表达以猕猴桃AcActin为内参,采用2-ΔΔCt法计算相对表达量,将0 d设为1。基因表达设置3 个生物学重复。

表1 real-time PCR引物序列Table 1 Primer sequences used for real-time PCR
1.4 数据统计与分析
2 结果与分析
2.1 NAG处理对猕猴桃呼吸速率和乙烯释放量的影响
呼吸和乙烯释放是猕猴桃后熟软化过程中主要的生理特性。如图1A所示,对照与处理组的呼吸速率变化趋势基本一致。贮藏前2 d呼吸速率呈下降趋势,推测是因为果实较高的田间热引起采收时的高呼吸作用。两组果实呼吸速率均在贮藏第6天达到峰值,NAG处理可显著降低呼吸峰前后的呼吸速率,但呼吸峰值无显著差异。如图1B所示,乙烯释放量主要在贮藏后期呈上升趋势,贮藏第8天开始,CK组与NAG组乙烯释放量出现显著差异,NAG处理显著延缓了乙烯的释放。由此可知,NAG处理可有效降低果实呼吸速率和乙烯释放量。

图1 NAG处理对猕猴桃果实呼吸速率(A)和乙烯释放量(B)的影响Fig.1 Effect of NAG treatment on the respiration rate (A) and ethylene production (B) of kiwifruit
2.2 NAG处理对红阳猕猴桃果实品质的影响
硬度作为果实后熟软化的重要指标,是评价猕猴桃果实品质和可食性的关键因子之一。如图2A所示,猕猴桃果实硬度随着贮藏时间延长呈下降趋势,与CK组相比,NAG处理可显著延缓贮藏4~10 d硬度的下降。TSS主要由可溶性糖构成,TA则由果酸和酸式盐组成,它们是评价果实风味品质的重要指标。如图2B、C所示,与CK组相比,NAG组在贮藏2~12 d显著抑制了果实TSS含量的上升,并显著维持TA含量在较高水平,说明NAG处理有利于延缓猕猴桃果实糖酸转变和维持品质。VC是猕猴桃果实重要的营养品质之一。如图2D所示,NAG组和CK组VC含量随着贮藏时间延长呈下降趋势,处理间无显著差异。


图2 NAG处理对猕猴桃果实硬度(A)、TSS(B)、TA(C)和VC含量(D)的影响Fig.2 Effect of NAG treatment on the firmness (A),TSS (B),TA (C) and VC content (D) of kiwifruit
2.3 NAG处理对猕猴桃多糖含量的影响
猕猴桃果实后熟软化伴随着淀粉水解和细胞壁多糖的降解。从图3可知,淀粉和原果胶质量分数随着贮藏时间延长总体呈下降趋势,与CK组相比,NAG处理可显著延缓贮藏4~12 d猕猴桃果肉淀粉和原果胶的下降。两组果肉中还原糖和可溶性果胶质量分数总体呈上升趋势,且在贮藏过程中、后期NAG组的还原糖和可溶性果胶质量分数均显著低于CK组。以上结果表明,猕猴桃在常温贮藏过程中NAG处理能显著抑制淀粉和果胶的水解,延缓果实的后熟软化过程。

图3 NAG处理对猕猴桃果实多糖含量的影响Fig.3 Effect of NAG treatment on the polysaccharide contents of kiwifruit
2.4 NAG处理对猕猴桃HXK活性的影响
HXK是己糖磷酸化的关键酶,葡萄糖和果糖经过HXK磷酸化,进一步参与下游糖酵解和呼吸代谢过程[9]。如图4所示,CK组HXK活性随贮藏时间延长呈先上升后下降趋势,而NAG处理后的猕猴桃HXK活性始终低于CK组,并在贮藏2 d后出现显著差异。结果表明,NAG处理可以显著抑制HXK活性,进而延缓淀粉水解和糖酵解过程。

图4 NAG处理对猕猴桃果实HXK活性的影响Fig.4 Effect of NAG treatment on the HXK activity of kiwifruit
2.5 猕猴桃HXK基因序列分析
从猕猴桃基因组中筛选获得14 个AcHXKs基因,分别命名为AcHXK1~AcHXK14。将猕猴桃HXK与拟南芥、番茄的HXK基因进行聚类分析,如图5所示,14 个AcHXKs基因分成2大类型。其中,A-型包括10 个AcHXK,分别与拟南芥的AtHXK3、AtHKL1、AtHKL2、AtHKL3和番茄SlHXK4同源;B-型包括4 个AcHXK,分别与拟南芥AtHXK1、AtHXK2和番茄SlHXK1、SlHXK2、SlHXK3同源。推测AcHXKs可能具有与其同源基因类似的功能。

图5 猕猴桃与拟南芥、番茄的HXKs聚类分析Fig.5 Phylogenetic analysis of kiwifruit arabidopsis and tomato HXKs
2.6 NAG处理对猕猴桃AcHXKs基因表达的影响
由图6可知,随着贮藏时间的延长,AcHXKs呈现不同的表达趋势。其中AcHXK1~AcHXK3相对表达量随贮藏时间延长整体呈上升趋势,与CK组相比,NAG处理可显著抑制贮藏中、后期AcHXK1~AcHXK3的表达,说明AcHXK1~AcHXK3可能通过糖代谢介导猕猴桃后熟软化。CK组果实AcHXK4~AcHXK6相对表达量在贮藏0~6 d逐渐上升,随后开始下降,且NAG处理总体显著降低了贮藏4~12 d果实AcHXK4~AcHXK6的相对表达量。CK组和NAG处理果实AcHXK7~AcHXK12相对表达量在贮藏0~10 d逐渐下降,NAG处理显著上调了AcHXK7~AcHXK9基因的相对表达量,说明AcHXK7~AcHXK9可能作为糖信号分子参与猕猴桃后熟软化。AcHXK13、AcHXK14基因表达量无规律性波动。


图6 NAG处理对猕猴桃果实AcHXK基因表达活性的影响Fig.6 Effect of NAG treatment on the expression of AcHXK genes in kiwifruit
2.7 相关性分析
NAG处理后,猕猴桃果实后熟软化特性、HXK活性和AcHXKs基因表达的相关性分析结果如图7所示。果肉硬度与淀粉、AcHXK4、AcHXK7~AcHXK12基因表达显著正相关(P<0.05,P<0.01),与可溶性果胶含量、乙烯释放量以及AcHXK3表达水平显著负相关(P<0.05,P<0.01)。乙烯释放量与可溶性果胶含量、AcHXK3表达水平显著正相关(P<0.05,P<0.01),与AcHXK10显著负相关(P<0.05)。淀粉含量与还原糖、TSS含量和AcHXK2、AcHXK3表达水平显著负相关(P<0.0 5,P<0.0 1),与AcHXK4、AcHXK7~AcHXK10表达水平显著正相关(P<0.05,P<0.001)。原果胶含量与AcHXK7、AcHXK8、AcHXK11、AcHXK12表达水平显著正相关(P<0.05)。由此说明,猕猴桃果实软化与淀粉、果胶水解以及AcHXKs基因表达水平的变化密切相关。
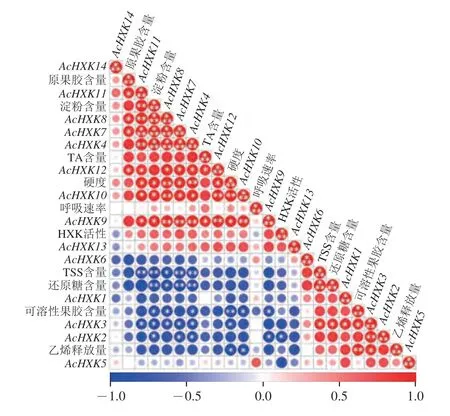
图7 猕猴桃后熟软化特性与AcHXKs基因表达量的相关性分析Fig.7 Correlation analysis between postharvest softening properties and AcHXKs gene expression
3 讨论
猕猴桃后熟软化是一个复杂的生理代谢过程,呼吸速率和乙烯释放是衡量其生理代谢强弱的重要指标[5-6]。相关研究表明,猕猴桃果实达到可食成熟度(常温贮藏8~12 d)时,呼吸速率和乙烯释放量迅速增加,耐贮性下降[6,8]。HXK是糖酵解途径的第一个限速酶,兼具催化和调节双重功能,在呼吸代谢和乙烯信号中发挥重要的作用[33]。本实验中,NAG处理显著降低呼吸速率和贮藏后期内源乙烯的释放,且乙烯与硬度显著负相关(P<0.05)。说明HXK正向作用于内源乙烯的生物合成,并参与猕猴桃后熟软化过程,这与对香蕉的研究结果[30]一致。李成梁等[30]研究发现,NAG推迟内源乙烯生物合成,且在香蕉后熟过程中乙烯和HXK之间存在相互作用。在拟南芥中也报道了HXK参与调控乙烯合成和信号反应[33]。
猕猴桃是典型的淀粉积累型水果,后熟软化主要由淀粉水解和细胞壁降解所导致。其中,淀粉水解主要在贮藏前、中期影响果实软化,而果胶水解则在贮藏中、后期果实软化中发挥重要作用[8]。HXK是糖酵解途径的关键酶,负责将淀粉水解后的己糖磷酸化成己糖-6-磷酸,为呼吸代谢和生命活动提供能量和中间代谢物[9]。本研究发现,NAG可抑制HXK活性,显著延缓猕猴桃贮藏中期淀粉向还原糖的转变,以及贮藏中后期原果胶向可溶性果胶的转变(图3、4)。这与Han Peipei等[26]的研究报道一致,NAG处理显著抑制HXK活性,延缓己糖含量的上升。此外,NAG处理可显著延缓TSS含量的上升,并维持TA含量在较高水平,且TSS含量与淀粉含量极显著负相关(P<0.01)。说明NAG处理可延缓可溶性糖的积累,进而延缓后熟进程,该结果与NAG处理香蕉果实后熟延缓的结果相似[24]。说明HXK可正向调控猕猴桃淀粉、果胶的水解,促进后熟软化过程。
HXK不仅调控多糖代谢,也直接参与糖信号感应和转导[18-19]。植物根据亚细胞定位有4 种类型的HXK,其中A-型HXK定位于叶绿体,主要在高淀粉植物中积累,也是葡萄糖传感器;B-型HXK定位于线粒体和细胞核,具有催化和调节活性的双重功能。HXK不同类型对其活性和传感器功能至关重要[34-35]。本研究发现,AcHXK7~AcHXK9为A-型HXK,受NAG处理其表达上调,且表达量与硬度显著正相关(P<0.05)。聚类分析表明AcHXK7~AcHXK9与拟南芥AtHKL1等同源,而AtHKL1可能作为糖信号分子,通过抑制ACO基因的表达参与调控乙烯合成途径[33]。AcHXK3为B-型HXK,与SlHXK1、SlHXK2、AtHXK1、AtHXK2等同源;并且受NAG处理其表达下调,且表达量与硬度、淀粉含量显著负相关,与还原糖、可溶性果胶含量显著正相关(P<0.05)。有研究发现HXK1显著诱导番茄和拟南芥中β-淀粉酶和细胞壁松弛相关基因XTH等的表达下调,这表明HXK正向调控园艺植物成熟衰老的过程[21,32]。Kim等[35]也发现B-型NtHXK1对维持烟草呼吸代谢过程中的糖酵解至关重要,同时也调节淀粉的降解过程。说明AcHXK3具有类似的功能,可能通过调控淀粉和细胞壁代谢,参与猕猴桃后熟软化。以上结果表明,AcHXK3、AcHXK7~AcHXK9可能是参与调控猕猴桃后熟软化的关键基因。而这4 个基因是如何参与猕猴桃后熟软化,还需要进一步的实验证明。
4 结论
综上,与对照相比,NAG处理可延缓猕猴桃硬度下降、淀粉和原果胶的水解,降低呼吸速率和乙烯释放量,延缓TSS含量的上升,并维持较高的TA含量。说明NAG处理可延缓猕猴桃后熟软化进程。一方面,NAG处理可能通过抑制AcHXK3的表达水平和HXK活性,延缓猕猴桃呼吸代谢和后熟进程;另一方面,NAG维持AcHXK7~AcHXK9相对较高的表达水平,而AcHXK7~AcHXK9可能作为糖信号分子,进而抑制乙烯的合成,或参与细胞壁和淀粉的降解,从而调节猕猴桃后熟软化。因此,AcHXK3、AcHXK7~AcHXK9可能通过不同的代谢途径参与调控猕猴桃后熟软化过程。本研究结果有助于加深对猕猴桃后熟软化机理的理解,同时为研发猕猴桃后熟软化调控技术提供理论依据。
