PI3K/AKT信号通路对冷却滩羊肉贮藏期间细胞凋亡的影响
2024-05-20罗瑞明陈雪妍王金霞胡丽筠
张 倩,罗瑞明,陈雪妍,李 荣,王金霞,胡丽筠
(宁夏大学食品与葡萄酒学院,宁夏 银川 750021)
磷脂酰肌醇3激酶(phosphoinositide 3-kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)信号通路是一条重要的信号途径,参与调控多种生物学过程,包括细胞增殖、存活和凋亡等。该通路的异常活化与多种疾病的发生密切相关[1],如癌症、糖尿病、神经退行性疾病等。AKT是PI3K信号通路最重要的下游效应器之一,是参与调控细胞增殖、存活、凋亡的重要蛋白。AKT的激活可以抑制凋亡,促进细胞生长和增殖。而另一方面,PI3K/AKT信号通路的异常活化则会抑制凋亡信号的传递,从而抑制细胞凋亡,造成肿瘤的发生和发展[2]。PI3K/AKT信号转导在细胞的凋亡、存活、增殖以及细胞骨架的改变等活动中,其调节细胞凋亡的机理主要有3 个:1)AKT对重组人β-防御素-2类的促凋亡蛋白进行直接抑制,或者对某些转录因子发出的促凋亡信息进行一系列调控,此外,AKT处于激活的情况下,还可以对与凋亡有关的因子,例如半胱天冬蛋白酶的S196位点磷酸化,进而使之失去活性,从而对凋亡起到抑制作用[3];2)对其他与Forkhead有关的转录因子,如Forkhead等转录因子被磷酸化后,可对凋亡相关因子配体等促凋亡基因的转录功能起到抑制作用,降低促凋亡的信号,从而增强细胞生存能力;3)AKT的上游哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)靶基因mTOR可激活AKT,并通过调控特定mRNA翻译和蛋白合成,在细胞增殖过程中发挥关键作用。
因此,PI3K/AKT调节细胞凋亡的机制十分复杂,在细胞程序性死亡过程中至关重要。对PI3K/AKT在细胞代谢中作用的研究发现,PI3K/AKT还可以通过代谢途径调节细胞的凋亡[4]。周永君等[5]研究表明肉豆蔻木脂素在50、100 μmol/L和200 μmol/L条件下以剂量依赖关系抑制胃癌细胞增殖,诱导胃癌细胞凋亡,下调PI3K和AKT蛋白表达水平,上调B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)-关联X蛋白(Bcl-2-associated X,BAX)、胱天蛋白酶(cysteine aspastic acid-specific protease,Caspase)-3和Caspase-9表达水平(P<0.05)。Chen Cheng等[6]发现活性氧(reactive oxygen species,ROS)通过激活PI1K/AKT信号通路驱动缺氧诱导因子-3α积累,从而加速死后牛肌肉的糖酵解。Wang Tongting等[7]探讨槲皮素对鸡胸肌嫩度的影响及相关机制,发现槲皮素可促进LC3I向LC3II转化,上调ATG7、Beclin-1等蛋白,且PI3K/AKT/mTOR通路介导了该过程。PI3K抑制剂(LY294002)是一种PI3K信号途径的非特异性小分子化合物,可以抑制PI3Kα/δ/β。2017年,徐余超等[8]采用实时聚合酶链式反应、蛋白质免疫印迹(Western blot,WB)等方法研究LY294002对MGC-803细胞增殖、周期及凋亡的作用,发现LY294002对人乳腺癌细胞系MGC-803的PI3K/AKT/mTOR信号通路中的多个重要分子均有不同程度的抑制,并伴随PI3K、AKT、4EBP、P70S6K等mRNA及磷酸化蛋白的表达量显著降低,且LY294002可抑制人乳腺癌细胞的生长,改变细胞周期,促进细胞凋亡。
PI3K/AKT信号通路与细胞凋亡密切相关,目前已有多项研究揭示了该通路在各种癌症中的作用,如肺癌、乳腺癌、结肠癌等,其研究重点主要集中在信号通路的调控、靶向治疗的开发及临床应用等方面。虽然大量文献报道指出PI3K/AKT信号通路在细胞凋亡途径中具有重要的调控作用,但目前仍不明确PI3K/AKT信号途径如何调控冷却滩羊肉贮藏期间肌细胞凋亡途径,及其对凋亡级联反应产生何种作用。因此,本研究以4 ℃条件下不同贮藏期滩羊后腿肉为研究对象,采用10 μmol/L PI3K抑制剂LY294002溶液对滩羊肉进行注射处理,分别贮藏0、2、4、6、8 d,通过WB分析PI3K、AKT蛋白的表达情况,以此验证PI3K/AKT信号通路抑制的有效性,同时测定滩羊肉贮藏期间能量因子、氧化应激水平、线粒体损伤程度以及Caspase-3活性的变化,以探索PI3K/AKT信号通路对冷却滩羊肉贮藏期间细胞凋亡途径的影响。
1 材料与方法
1.1 材料与试剂
滩羊右后腿肉由宁夏盐池县大夏牧场食品有限公司提供。选择9 只6 个月龄去势的公滩羊,在宰杀前进行集中饲养。按照GB 12694—2016《畜禽屠宰加工卫生规范》的要求进行宰杀后,在-20 ℃的冰箱中进行1 h冷冻,将肉块的中心温度降低到0 ℃,然后用密封袋进行包装,转入0~4 ℃冰箱中保存。
PI3K抗体、AKT抗体、过氧化物酶标记的羊抗兔二抗、NaOH、K2HPO4、KH2PO4、KCl、NaCl、蒽酮试剂美国Sigma公司;HY-10108 LY294002、Tris-HCl缓冲液、乙二胺四乙酸二钠(ethylenediaminetetraacetic acid disodium,EDTA-2Na)、二氯二氢荧光素二乙酸酯(2’,7’-dichlorodihydrofluorescein diacetate,DCFH-DA)、甘露醇 美国MedChemExpress公司;聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜美国Bio-Rad公司;蛋白预染Marker 杭州弗德生物科技有限公司;线粒体提取试剂盒、ATP含量检测试剂盒、糖原含量检测试剂盒、2,2-联喹啉-4,4-二甲酸二钠(bicinchoninic acid,BCA)蛋白质测定试剂盒北京索莱宝科技有限公司;琥珀酸脱氢酶(succinate dehydrogenase,SDH)、酶联免疫吸附测定(enzymelinked immunosorbent assay,ELISA)检测试剂盒、柠檬酸合酶(citrate synthase,CS)南京建城生物工程研究所;线粒体膜通透性转换孔(mitochondrial permeability transition pore,MPTP)检测试剂盒、线粒体膜电位检测试剂盒、Caspase-3活性检测试剂盒 上海一研生物科技有限公司;液氮 宁夏宁钢盈德气体有限公司;蔗糖、硫酸、H2O2、甘油 国药集团化学试剂有限公司。
1.2 仪器与设备
JY-SPGT垂直电泳仪 耶拿分析仪器(上海)有限公司;GPC 1000凝胶图像分析仪 北京莱伯泰科仪器股份有限公司;UV-3600i Plus紫外-可见分光光度计上海美谱达仪器有限公司;BCD-536WKN食品专用冰箱合肥美的电冰箱有限公司;F-4700荧光分光光度计上海元析仪器有限公司;Spectramax M2酶标仪 美国Thermo Fisher Scientific公司;ST16 ST16R冷冻高速离心机 上海土森视觉科技有限公司;HWS恒温水浴锅杭州瑞诚仪器有限公司。
1.3 方法
1.3.1 样品采集
选用宁夏盐池县大夏牧区的滩羊作为实验材料,采集在0~4 ℃条件下贮藏的冷却滩羊后腿肉(从腰椎与荐椎连接处斩下的后腿部位肌肉),剔除可见的脂肪及结缔组织,快速采集约150 g肉样,作为0 d样品。其余样品切割成约150 g大小一致的块状,并将其随机分成两组,一组为对照组,另一组为LY294002组,每组各15 个样本。对照组不做任何处理,LY294002组以料液比10∶1(g/mL)注射10 μmol/L LY294002溶液。置于0~4 ℃、相对湿度85%条件下成熟,分别采集贮藏0、2、4、6、8 d后样品测定相应指标。对于不便立即测定的指标,在采样点取样品后,立即放入液氮中冷藏,并转入-80 ℃冷藏待用。每组样本分别进行至少3 个以上生物学重复。
1.3.2 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)及WB
SDS-PAGE(10%分离凝胶和5%浓缩凝胶)分离蛋白质后,将目标蛋白质(50 μg)转移到PVDF薄膜上;在TBST溶液(20.0%吐温-1、20 mmol/L NaCl、150 mmol/L Tris、10 mmol/L KCl,pH 5.7)中用4%无脂牛奶封闭PVDF薄膜,之后在4 ℃条件下使用各种不同的一抗(PI3K抗体(1∶500)、AKT抗体(1∶500))孵育过夜。在用TBST溶液清洗3 次(每次10 min)后,使用抗兔辣根过氧化物酶偶联的二抗(1∶4 000)在室温条件下反应1.5 h。经TBST洗涤缓冲液漂洗3 次后二氨基联苯胺显色,蛋白质的表达水平通过Quantity-One 4.6.2程序进行定量。以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内标。
1.3.3 线粒体提取
参照Chen Jiao等[9]的方法。取2 g肉样剪碎,置于20 mL线粒体分离液(0.2 mol/L甘露醇;0.075 mol/L蔗糖;2.0 mmol/L Tris-HCl,pH 7.4;0.2 mmol/L EDTA),转移到均质机中以8 000×g研磨4 min,随后,将匀浆液在4 ℃、9 000×g条件下离心15 min,所得沉淀物即为线粒体,其蛋白质浓度用BCA法测定。
1.3.4 ATP含量测定
取待测肉样0.1 g,实验操作按照ATP含量检测试剂盒的要求,使用紫外分光光度计于340 nm波长处进行测定。
1.3.5 糖原含量测定
利用蒽酮法并略加改进,绘制标准曲线[10]。将0.1 g肉样与1.5 mL 2 mol/L NaOH溶液混合,保持沸腾20 min。随后,将冷却的混合物与8 mL超纯水混合,并以5 000×g离心10 min。按照糖原含量检测试剂盒的要求进行后续操作,使用酶标仪于620 nm波长处测定吸光度。
1.3.6 线粒体标志酶活性测定
用于检测SDH、CS活性的提取物使用Wang Yingying等[11]提出的方法制备。将1 g冷冻样品加入9 mL 10 mmol/L冷均质溶液(80 mmol/L K2HPO4、15 mmol/L KH2PO4、25 mmol/L KCl、1.2 mol/L NaCl,pH 7.4),然后在冰浴中以12 000 r/min匀浆30 s。随后,4 ℃、13 000×g离心15 min。之后,收集上层细胞使用ELISA试剂盒检测SDH和CS的活性。
1.3.7 线粒体ROS水平测定
参照Yans等[12]的方法并稍作修改,使用荧光测定法分析ROS含量。将3 g冷冻样品加入到15 mL 50 mmol/L预冷磷酸钾缓冲溶液(pH 7.4)中,12 000×g匀浆,间隔20 s,并在4 ℃、5 000×g条件下离心20 min。随后,将上清液与等体积缓冲溶液(10 μmol/L DCFHDA、10 mmol/L Tris-HCl、15 mmol/L蔗糖、0.15 mmol/L EDTA-2Na、0.9 g/100 mL NaCl,pH 7.4)混合,并于37 ℃培养20 min。使用荧光分光光度计在450 nm波长处测量孵育前后的荧光强度。
1.3.8 MPTP开放程度测定
取待测样品0.1 g,实验操作按照MPTP检测试剂盒的要求进行,使用紫外分光光度计于540 nm波长处测定。
1.3.9 线粒体膜电位测定
按照线粒体膜电位检测试剂盒(JC-1法)说明书操作。使用荧光分光光度计于540 nm波长处测定。
1.3.10 Caspase-3活性测定
取0.1 g组织肉样,按照Caspase-3活性检测试剂盒说明书操作,使用酶标仪在405 nm波长处测定吸光度。
1.4 数据处理与分析
2 结果与分析
2.1 冷却滩羊肉贮藏期间PI3K和AKT蛋白的表达量变化
PI3K蛋白家族参与细胞存活、生长、代谢和血糖稳态等多种细胞功能的调控,PI3K和AKT蛋白的降解程度可以反映出PI3K/AKT通路受到抑制的程度[13]。WB结果显示,对照组和LY294002组PI3K蛋白在贮藏过程中逐渐降解,8 d时几乎完全降解(图1A);同时发现对照组的条带始终深于LY294002组,表明LY294002促进了PI3K蛋白的降解,验证了PI3K/AKT通路受到抑制的有效性。

图1 PI3K抑制剂对冷却滩羊肉贮藏期间PI3K(A)和AKT(B)蛋白表达情况的影响Fig.1 Effect of PI3K inhibitor on the protein expression of PI3K (A) and AKT (B) in chilled Tan sheep meat during storage
LY294002可通过抑制PI3K活性抑制PI3K/AKT通路下游的AKT表达及活化,从而阻止所有由AKT调控的下游信号传导途径[14]。WB结果显示,对照组和LY294002组AKT蛋白的表达随贮藏时间的延长逐渐减弱,而内参蛋白GAPDH并未变化(图1B);同时发现对照组的条带始终深于LY294002组,表明LY294002抑制了AKT蛋白的表达,再次验证了PI3K/AKT信号通路受到阻碍。如图2所示,滩羊对照组和LY294002组PI3K和AKT蛋白表达量随贮藏时间的延长逐渐减少,且LY294002组蛋白相对表达量整体低于对照组,表明LY2940002抑制剂促进了PI3K和AKT蛋白在贮藏期间的分解,有效验证了PI3K/AKT信号通路被LY294002抑制。

图2 PI3K抑制剂对冷却滩羊肉贮藏期间PI3K和AKT蛋白相对表达量的影响Fig.2 Effect of PI3K inhibitor on the relative protein expression of PI3K and AKT in chilled Tan sheep meat during storage
2.2 PI3K/AKT信号通路对冷却滩羊肉贮藏期间能量因子的影响
ATP的生成在骨骼肌收缩、内环境稳态以及维持细胞正常功能等生命活动中都发挥着非常关键的作用,将ATP保持在一定的水平对细胞而言非常重要[15]。由图3可知,贮藏0~2 d时,LY294002组的ATP含量以更快的速率下降,随后缓慢下降,但ATP仍会被消耗;8 d时滩羊肉对照组和LY294002处理组ATP含量分别降至140.15、110.26 μmol/mg,是由于ATP合成减少和ATP消耗增加所致。结果表明,LY294002可有效促进ATP的降低,其作用于PI3K/AKT信号通路后,加速ATP的减少而影响细胞凋亡,主要是由于ATP与细胞膜上的ATP受体相结合,抑制PI3K,进而抑制AKT,促进BAX的表达和Bcl-2基因相关启动子磷酸化,从而加速凋亡信号的传递,抑制细胞生长和增殖,揭示了PI3K/AKT信号途径可通过促进ATP的减少而影响细胞凋亡。

图3 冷却滩羊肉贮藏期间ATP含量变化Fig.3 Changes of ATP content in chilled Tan sheep meat during storage
冷却滩羊肉贮藏期间,LY294002处理组和对照组糖原含量变化如图4所示。对照组和LY294002处理组糖原含量随贮藏时间的延长整体呈下降趋势。贮藏初期2 d时,对照组糖原含量显著高于LY294002处理组(P<0.05),表明注射抑制剂LY294002后加速了糖原分解,由于抑制PI3K/AKT信号途径可以降低细胞内的葡萄糖利用率,从而降低糖原合成的速率,因此导致糖原含量的下降。研究表明,抑制PI3K/AKT信号途径后降低糖原含量有助于促进细胞凋亡。具体而言,降低糖原含量可以增加细胞内单磷酸腺苷(adenosine 5’-monophosphate,AMP)∶ATP比值,进而激活下游的AMP依赖的蛋白激酶(AMP-activated protein kinase,AMPK)信号途径,抑制mTOR信号途径,提高细胞凋亡的水平。

图4 冷却滩羊肉贮藏期间糖原含量变化Fig.4 Changes of glycogen content in chilled Tan sheep meat during storage
2.3 PI3K/AKT信号通路对冷却滩羊肉贮藏期间线粒体标志酶活性的影响
SDH是衡量线粒体功能的标志酶。如图5所示,贮藏初始状态下(0 d)滩羊肉线粒体中SDH活力为140.27 U/L,且LY294002组在贮藏过程中(4~8 d)显著低于对照组(P<0.05)。SDH活性随着贮藏时间的延长呈逐渐降低的趋势。贮藏6 d时对照组和LY294002组线粒体SDH的活性分别为96.21 U/L和81.03 U/L,相比于初始状态分别降低了31.41%和42.23%(P<0.05),SDH活力的下降说明随着贮藏时间的延长,线粒体的生理功能逐渐下降[16]。主要是因为抑制PI3K/AKT信号途径会降低细胞内的氧化磷酸化过程,从而影响线粒体内的SDH活性,导致LY294002处理组SDH活性低于对照组,同时会使细胞代谢受到影响,进而促进细胞凋亡。CS是三羧酸循环中一个重要的调节酶[17]。由图6可知,对照组和LY294002组的CS活性在贮藏0~2、4~8 d均显著下降,2~4 d显著上升(P<0.05),其原因是在贮藏过程中,可能发生基因的表达,导致CS活性上升。贮藏0~4 d,对照组CS活性显著高于LY294002组(P<0.05),表明PI3K/AKT通路被阻断后会降低细胞内的氧化磷酸化过程,并降低CS活性,进而影响线粒体细胞凋亡。
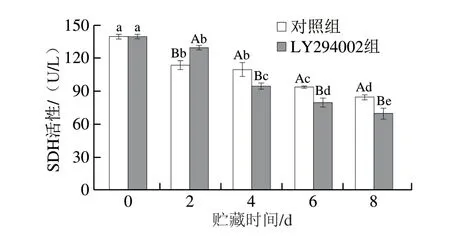
图5 冷却滩羊肉贮藏期间SDH活性的变化Fig.5 Changes of SDH activity in chilled Tan sheep meat during storage

图6 冷却滩羊肉贮藏期间CS活性的变化Fig.6 Changes of CS activity in chilled Tan sheep meat during storage
2.4 PI3K/AKT信号通路对冷却滩羊肉贮藏期间线粒体氧化应激水平的影响
如图7所示,贮藏期间,LY294002组线粒体ROS水平整体呈上升趋势,贮藏6 d时,LY294002组ROS水平明显高于对照组(P<0.05),主要因为PI3K/AKT信号途径参与线粒体逆转运输,防止线粒体内过多的ROS产生,但是当该信号途径受到抑制时,线粒体功能可能会受到破坏,导致ROS的升高。研究表明,PI3K/AKT信号通路的抑制会加重线粒体的氧化损伤,从而导致细胞凋亡。
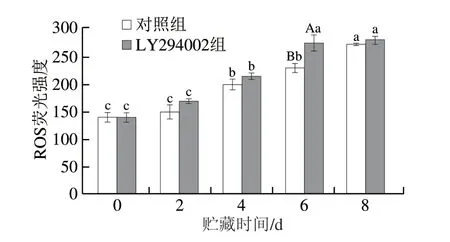
图7 冷却滩羊肉贮藏期间ROS水平的变化Fig.7 Changes of ROS levels in chilled Tan sheep meat during storage
2.5 PI3K/AKT信号通路对冷却滩羊肉贮藏期间线粒体损伤程度的影响
由图8 可知,冷却贮藏0~8 d 期间,对照组和LY294002组光密度值均呈降低趋势,而光密度值与MPTP开放程度成反比,说明MPTP开放程度显著增大(P<0.05),原因可能是抑制PI3K/AKT信号途径会引发线粒体内外膜电位的破坏、ROS的产生和细胞凋亡等一系列反应,多种因素诱导MPTP呈不可逆的开放状态,进而导致线粒体内氧化磷酸化和ATP的产生下降,从而产生ROS、Ca2+等物质,导致线粒体外膜通透性改变,并释放一系列细胞凋亡相关蛋白,例如细胞色素c等,最终引发细胞凋亡。整个贮藏过程中,与对照组相比,LY294002组MPTP开放程度变化显著(P<0.05),表明PI3K/AKT通路抑制后可能直接作用于构成MPTP的分子蛋白,使丝/苏氨酸残基发生磷酸化,影响MPTP的结构和功能,促进其开放。
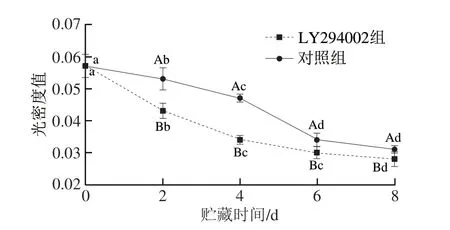
图8 冷却滩羊肉贮藏期间MPTP开放程度变化Fig.8 Changes of MPTP opening degree in chilled Tan sheep meat during storage
线粒体膜电位的降低是由MPTP精细调控引起[18]。由图9可知,对照组和LY294002组线粒体膜电位随贮藏时间的延长均呈下降趋势,LY294002组0~2 d和4~6 d线粒体膜电位下降率分别为29.17%和69.23%,对照组0~2 d和6~8 d呈显著下降趋势(P<0.05);贮藏期间,对照组线粒体膜电位整体高于LY294002组。以上结果表明,抑制PI3K/AKT信号途径后对线粒体膜电位的稳定性产生一定的影响,使线粒体膜电位下降,进而导致Ca2+的过多积累,激活凋亡途径中的酶、蛋白酶等,损伤线粒体膜以及DNA等重要细胞器件,从而引起细胞凋亡。此外,线粒体膜电位下降也会导致细胞色素c等细胞中与凋亡相关蛋白的释放,进而启动凋亡途径。

图9 冷却滩羊肉贮藏期间线粒体膜电位的变化Fig.9 Changes of mitochondrial membrane potential in chilled Tan sheep meat during storage
2.6 PI3K/AKT信号通路对冷却滩羊肉贮藏期间Caspase-3活性的影响
由图10所示,对照组和LY294002组Caspase-3活性均在贮藏2 d时达到峰值,之后呈明显降低的趋势;与对照组相比,LY294002组贮藏0~6 d时的Caspase-3活力较高,主要由于PI3K/AKT信号途径可以调节Caspase-3的表达和活性,Caspase-3能够靶向并降解多种细胞蛋白质,引发细胞形态学和功能性变化,以及间接激活其他的Caspase,进而引发细胞凋亡。说明LY294002抑制PI3K/AKT信号途径后会导致Caspase-3活性增加,促进细胞凋亡。

图10 冷却滩羊肉贮藏期间Caspase-3活性的变化Fig.10 Changes of caspase-3 activity in chilled Tan sheep meat during storage
3 讨论
氧化应激和能量代谢均可导致细胞凋亡。已有研究表明,氧化应激可通过调控肾小球内皮细胞凋亡相关基因的表达,导致肾小球细胞损伤[19]。张志梅[20]研究发现,降糖药二甲双胍可显著抑制人红系白血病K562细胞的糖酵解,并可通过PI3K/AKT/mTOR信号途径诱导细胞凋亡。氧化应激导致诸如活性羰基化合物等能量物质代谢紊乱,从而导致细胞的破坏和死亡[21]。本研究中得到的结果与上述研究一致,LY294002组线粒体ROS的总体水平与对照组相比有较大差异(P<0.05),这表明PI3K/AKT途径可能通过加重线粒体的氧化损伤,并与ROS交互,从而导致细胞凋亡。肝脏是生物体最重要的物质及能量代谢中心,线粒体是细胞“能量供给源”,可通过多种途径调控各种重要的生命活动,其中PI3K/AKT途径就是其中之一。Wang Qifei等[22]研究表明,PI3K/AKT信号通路在缺氧条件下可通过参与缺氧诱导因子-1α的合成和糖酵解发挥关键作用。有研究显示,AKT能够刺激葡萄糖转运载体1,进而提高葡萄糖代谢效率[23]。本实验中,PI3K/AKT信号通路通过加速ATP和糖原含量的下降,对细胞凋亡造成影响。抑制剂LY294002可使肌肉组织的pH值、ATP含量急剧降低,并与肌肉组织中其他能量代谢发生作用,从而导致肌肉组织的凋亡。此外,AKT还能够激发己糖激酶和磷酸果糖激酶,这两种物质对糖分解都有限速作用,从而提高代谢水平[24]。
SDH是线粒体呼吸链复合物II中的底物酶,它与其他呼吸链底物酶一起参与线粒体内的电子转移和ATP合成[25]。当SDH活性下降时,线粒体内的ATP合成可能会受到影响,进而影响细胞内的代谢和生存。降低ATP水平可能会激活AMPK信号途径,从而抑制mTOR信号途径,提高细胞凋亡的水平。本研究发现,贮藏期间对照组CS活性显著高于LY294002组(P<0.05),表明PI3K/AKT信号途径会导致线粒体膜电位的降低,从而影响氧化磷酸化过程的进行,并降低SDH的活性,导致细胞凋亡的发生。CS参与三羧酸循环代谢途径,本实验结果表明,PI3K/AKT通路被阻断后,使CS活性下降,三羧酸循环途径和细胞代谢途径的进行会受到影响,从而导致细胞生存受损,促进细胞凋亡的发生。本研究也表明,PI3K/AKT信号途径在线粒体膜电位和MPTP的调节中具有重要的作用,抑制该途径会导致膜电位的下降和MPTP开放程度的增加,进而启动凋亡途径。这与Wang Linlin等[26]研究发现MPTP开放受到ROS和Ca2+的影响,在死后肌肉压痛过程中介导细胞凋亡中起重要作用的结果相一致。
PI3K/AKT是一个抗细胞凋亡的重要途径,而Bcl-2基因家族是其下游抗细胞凋亡分子,在调节细胞凋亡中发挥重要作用[27]。Caspase-3在线粒体途径中起着关键作用,其活化是引起细胞凋亡的关键[28]。已知PI3K/AKT信号通路可调控多种组织器官的凋亡,而PI3K/AKT信号通路的活化可抑制凋亡。PI3K可抑制Caspase-3激活,发挥抗细胞凋亡作用[29-30]。当PI3K/AKT信号通路的基因表达降低时,能够在肝内胆管细胞癌中上调BAX、Caspase-3和Caspase-9基因的表达,从而引起细胞凋亡[31]。硫化氢可调控BCL-2的表达,引起骨髓间充质干细胞线粒体凋亡[32]。本研究发现,PI3K/AKT信号途径可以促进Caspase-3靶向各种细胞蛋白进行降解,引发细胞形态学和功能性变化,进而引发细胞凋亡。Karahashi等[33]也发现,脂多糖(lipopolysaccharide,LPS)可以提高BAX的表达,并促进细胞的凋亡。抑制PI3K/AKT信号途径后也会影响其他与细胞凋亡相关的协同分子表达,例如p53和BCL-2家族等。此外,在STC-1小鼠中LPS治疗可使BCL-2/BAX下降,Caspase 3的表达升高引起肠道内分泌细胞的凋亡[34]。
4 结论
WB结果表明,随着贮藏时间的延长,PI3K和AKT蛋白表达量均减少,验证了PI3K/AKT信号通路被抑制的有效性。贮藏期间,与对照组相比,LY294002处理使线粒体ATP、糖原含量、SDH和CS活性显著下降(P<0.05);线粒体ROS水平不断增加,细胞内氧化应激水平和MPTP开放程度增加,膜电位显著下降;凋亡因子Caspase-3活性显著高于对照组(P<0.05),表明PI3K/AKT信号途径通过促进ROS产生并与PI3K相互作用,介导了下游Caspase-3的活化,导致线粒体结构和功能的损伤,进一步诱导细胞凋亡途径的发生。
