基于脂质组学研究胡椒碱对肥胖大鼠脂代谢基因昼夜节律的影响
2024-05-20张玮芸HOChiTang吕慕雯
张玮芸,HO Chi-Tang,吕慕雯,*
(1.华南农业大学食品学院,广东 广州 510642;2.罗格斯大学食品科学系,美国 新布朗斯维克 08901)
生物钟系统作为一种重要的调控系统,存在于哺乳动物的细胞、器官和组织中,它由中枢生物钟系统和外周生物钟系统共同组成,控制着机体行为和生理功能的昼夜节律振荡[1]。中枢生物钟系统位于下丘脑视交叉上核,由许多单细胞昼夜节律振荡器组成[2]。外周生物钟系统主要存在于肝脏、肠道、心脏和胰腺等外周组织中。中枢生物钟系统可直接接收来自视网膜的光照输入信号,并通过神经与体液将时间信息传递至机体的外周组织中,同步外周生物钟的节律性振荡,从而维持机体代谢稳态[3]。中枢和外周生物钟系统共享同一套生物钟分子机制,生物钟的节律性振荡依赖于自动调节转录/翻译反馈环,包括昼夜运动输出周期(circadian locomotor output cycles kaput,Clock)基因、脑和肌肉芳香烃受体核转运样蛋白1(brain and muscle-arnt-like 1,Bmal1)基因、周期(periods,Pers)基因、隐花色素(cryptochromes,Crys)基因、维甲酸相关孤儿受体(retinoic acid-related orphan receptors,Rors)基因和孤儿核激素受体(reverse erythroblastosis virus α/β,Reverbα/β)基因等[4]。
目前许多研究表明,生物钟系统可参与调控机体的昼夜节律,进而参与调节各系统的生理生化反应,预防与代谢紊乱相关疾病的发生与发展[5-6]。而由基因和环境变化所造成的昼夜节律紊乱也会引发宿主脂质代谢异常并加速肥胖的发展[7]。生物钟系统已被证明可以通过调节脂质代谢中合成与分解的关键步骤发挥其调节作用[8]。例如,Clock或Bmal1敲除小鼠都表现出葡萄糖耐受不良、胰岛素分泌减少、对高脂肪饮食喂养的敏感性增加、食欲亢进和超重等现象[9]。此外,在外周组织(骨骼肌、胰岛β细胞和肝脏)特异性Bmal1敲除动物模型中,机体的葡萄糖稳态也出现失调的现象。因此,脂质代谢的昼夜节律振荡受到核心生物钟基因Bmal1的调节,同时受到REVERBs、过氧化物酶体增殖物激活受体γ(peroxisome proliferators-activated receptor-gamma,PPARγ)和ROR所介导的一系列生物钟调节元件的反馈作用。
胡椒碱(1-piperoylpiperidine,PIP)来源于胡椒(PipernigrumLinn.)和荜拨(PiperlongumLinn.)等胡椒属植物,是胡椒发挥活性作用的主要生物成分[10]。据报道,PIP具有抗肥胖、抗炎、保护肝脏、调节机体代谢等生物功效[11-12]。本团队前期研究发现PIP以Bmal1/Clock依赖的方式调节HepG2肝细胞的脂质代谢,表明生物钟基因在PIP调节代谢过程中发挥关键作用[13]。然而,PIP对高脂饮食(high fat diet,HFD)大鼠脂代谢的昼夜节律、脂质组成及其相关代谢途径的影响尚不明确。因此,本研究通过建立HFD诱导的肥胖大鼠模型,在明确PIP减脂效果的基础上,采用余弦函数拟合分析PIP对肥胖大鼠肝脏中生物钟基因和脂代谢相关基因的昼夜节律恢复作用,并结合脂质组学探究PIP干预后肥胖大鼠的肝脏脂质代谢物变化,基于生物钟基因的节律性表达探究PIP对大鼠减肥降脂作用的可能机制。
1 材料与方法
1.1 材料与试剂
SD大鼠(使用许可证号:SYXK(粤)2019-0136)购于广东省医学实验动物中心。大鼠标准饲料和45%脂肪供能高脂饲料购于江苏省协同医药生物工程有限责任公司。
PIP(纯度98%)西安天丰生物科技股份有限公司;总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(highdensity lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、谷草转氨酶(aminotransferase aspartate,AST)测试盒、谷丙转氨酶(alanine aminotransferase,ALT)测试盒南京建成生物工程研究所;TRIzol试剂盒、cDNA反转录试剂盒、SYBR Green qPCR试剂盒 北京全式金生物技术股份有限公司。其他化学试剂均为分析纯。
1.2 仪器与设备
冷冻离心机、Vanquish液相色谱仪、QE质谱仪 美国赛默飞世尔科技公司;RM2135轮转式切片机 德国Leica公司;CFX96型实时聚合酶链式反应(real-time polymerase chain reaction,real-time PCR)仪 美国伯乐公司;MB-96高通量组织研磨器 浙江美壁仪器有限公司;BE-2600混匀仪 海门其林贝尔仪器制造有限公司。
1.3 方法
1.3.1 实验动物饲喂及分组
选取72 只4 周龄的雄性SD大鼠(100~150 g)进行实验。在温度(25±2)℃、相对湿度(65±5)%条件下饲养所有大鼠。光-暗循环周期为12 h,用授时时间(zeitgeber time,ZT)表示,ZT0为开灯时间(早8时),ZT12为关灯时间(晚20时)。适应1 周,将所有大鼠随机分为3 组(每组24 只大鼠),分别为饲喂标准饲料组(记为ND组)、饲喂高脂饲料组(记为HFD组)、饲喂高脂饲料并同时灌胃30 mg/kgmbPIP组(记为PIP组)。所有大鼠均自由饮水,每周测量体质量、摄食量和饮水量。喂养9 周后,在ZT0、ZT6、ZT12和ZT18收集粪便样本。实验结束后,所有大鼠均用戊巴比妥钠(45 mg/kgmb)麻醉,并在禁食12 h后,从ZT0开始,每隔6 h处死一批大鼠(每组n=6)。
1.3.2 血液及组织样品的采集和生化指标的测定
考虑到教材中的内容滞后于时事,所以遥感课程的教师密切关注国内外遥感领域的最新发展动态,选取与遥感课程相关的时事热点、趣闻轶事,使其贯穿于教学始末,并适当地补充能够反映最新遥感技术及其应用成果的内容。比如介绍在我国遥感发展历程中具有里程碑意义的“三大战役”等。
采用大鼠活体心脏穿刺采血法取血于真空采血管中,将采集的大鼠血液静置4 h,在4 ℃、3 500 r/min条件下冷冻离心15 min,取上层血清转入离心管中,按照试剂盒说明书测定血清中的ALT、AST、TC、TG、HDL-C和LDL-C的水平。采集大鼠肝脏并称取总质量后,放入生理盐水中漂去杂质,精确剪取肝脏和附睾脂肪相同部位组织称质量,于-80 ℃冰箱中保存备用。在相同部位剪取部分肝脏组织放入体积分数为4%的多聚甲醛固定液中,制作石蜡组织切片。
1.3.3 肝脏病理学分析
将肝脏用磷酸盐缓冲液洗涤,固定在4%多聚甲醛溶液中,进行修剪、脱水、包埋、切片、染色(苏木精-伊红染色法)、封片制片。在光学显微镜下观察肝脏的病理切片结果。
1.3.4 脂质组学肝脏样本处理
取适量样本于2 mL管中,加入750 μL氯仿-甲醇混合溶液(体积比为2∶1),涡旋振荡30 s,加入2 颗钢珠于高通量组织研磨器中,50 Hz研磨60 s,重复2 次。取研磨后的样本在冰上放置40 min,加入190 μL H2O,混匀振荡30 s,在冰上静置10 min,12 000 r/min室温离心5 min,取下层液300 μL于新的2 mL离心管中,再加入500 μL氯仿-甲醇混合溶液(体积比2∶1),混匀振荡30 s,在12 000 r/min室温离心5 min,取下层液400 μL转移到2 mL离心管中,样品用真空浓缩仪浓缩。取200 μL异丙醇溶解样品,用0.22 μm滤膜过滤后得到待测样本,每个待测样本各取20 µL混合成为质控(quality control,QC)样品,剩余待测样本采用液相色谱-质谱(liquid chromatography-mass spectrometry,LC-MS)联用仪检测。
1.3.5 LC-MS检测
LC条件:使用ACQUITY UPLC®BEH C181.7 µm(2.1 mm×100 mm)色谱柱,自动进样器温度为8 ℃,流速为0.25 mL/min,柱温为50 ℃,进样量2 μL,进行梯度洗脱。流动相A为乙腈-水(体积比60∶40)(内含0.1%甲酸+10 mmol/L甲酸铵),流动相B为异丙醇-乙腈(体积比90∶10)(内含0.1%甲酸+10 mmol/L甲酸铵)。梯度洗脱程序:0~5 min,70%~57% A、30%~43% B;5~5.1 min,57%~50% A、43%~50% B;5.1~14 min,50%~30% A、50%~70% B;14~14.1 min,30% A、70% B;14.1~21 min,30%~1% A、70%~99% B;21~24 min,1% A、99% B;24~24.1 min,1%~70% A、99%~30% B;24.1~28 min,70% A、30% B。
MS条件:使用电喷雾离子源,正负离子喷雾电压分别为3.50 kV和2.50 kV,鞘气体积流量30 arb,辅助气体积流量10 arb。毛细管温度325 ℃,以分辨率35 000进行全扫描,扫描范围m/z150~2 000,采用高能碰撞裂解进行二级裂解,碰撞电压为30 eV,同时动态排除非必要的MS/MS信息。
1.3.6 反转录real-time PCR检测mRNA表达
在肝脏样品中加入TRIzol试剂提取组织内总RNA,使用微量紫外分光光度计测定其纯度和浓度,利用反转录试剂盒将提取的RNA反转录为cDNA。以cDNA为模板加入SYBR Green qPCR试剂,于real-time PCR仪中反应得到各样品的Ct值,运用2-ΔΔCt法计算各基因相对表达量。引物序列见表1。

表1 目标基因和内参引物序列Table 1 Primer sequences used for amplification of target genes and internal reference genes
1.4 数据统计与分析
采用SPSS Statistics 21和Origin 2022软件进行数据处理和作图,用单因素方差分析(One-way ANOVA)确定组间其他数据的显著性,结果以±s表示。用Python软件进行余弦分析,拟合余弦方程为f(t)=M+Acos(tπ/12-φ);其中f(t)为时间对应的基因表达水平;M为波动变化的中线称为中值;A为振幅;φ为峰值相位,是振荡达到峰值的时刻。
2 结果与分析
2.1 PIP对大鼠饮食、体质量和肝脏指数的影响
如表2所示,在9 周的喂养结束后,HFD组大鼠体质量增长率高度显著高于ND组(P<0.001),其肝质量比显著高于ND组(P<0.05);而PIP组的大鼠体质量增长率高度显著低于HFD组(P<0.001),其肝质量比显著低于HFD组(P<0.05)。这表明PIP可以抑制HFD喂养大鼠体质量增长和肝脏增大。同时,3 组间的摄食量无显著差异,表明PIP并不是通过减少能量摄入发挥降脂效果。

表2 PIP对HFD大鼠饮食、体质量和肝质量比的影响Table 2 Effect of PIP on food intake,body mass and liver index of HFD-induced rats
2.2 PIP对肥胖大鼠血脂水平的影响
AST和ALT是反映肝脏细胞损伤和细胞膜完整性的重要指标,当肝脏受损时,细胞中转氨酶被释放到血液中,血清中的AST和ALT水平显著升高[14-15]。因此,本实验通过检测血清中ALT、AST、TC、TG、HDL-C和LDL-C的水平,评估PIP对HFD诱导脂肪肝和高脂血症的预防作用。如图1A、B所示,与ND组相比,HFD组的血清ALT水平(P<0.01)和AST水平明显升高(P<0.05),表明长期摄入高脂食物造成了肝脏损伤;与HFD组相比,PIP组大鼠的ALT和AST水平显著下降(P<0.05),表明PIP对HFD诱导肥胖大鼠的肝脏损伤具有防护作用。如图1C~F所示,与ND组相比,HFD组的血清TC和TG水平高度显著升高(P<0.001)、LDL-C水平极显著升高(P<0.01)、HDL-C的水平显著降低(P<0.05);与HFD组相比,PIP组的血清TC、TG、LDL-C水平显著降低(P<0.05),这些结果表明PIP缓解了HFD引起的大鼠血脂水平紊乱。综上,PIP改善了长期摄入HFD引起的大鼠肝脏损伤和血脂水平紊乱。


图1 PIP对HFD大鼠生理指标的影响Fig.1 Effect of PIP on physiological indexes of HFD-induced rats
2.3 PIP对大鼠肝脏生物钟基因昼夜节律紊乱的影响
最近的研究表明,HFD可以影响哺乳动物体内的生物钟系统,干扰神经、体液和激素等信号的传递过程,导致机体代谢紊乱[16-17]。肝脏作为机体重要的代谢器官,也是外周生物钟系统最重要的组成部分,在调节能量代谢和维持生物体的正常生理功能方面发挥着至关重要的作用[18-21]。同时,许多植物化学物质已被证明可以通过影响生物钟的振幅或相位等调节生物钟系统,缓解由昼夜节律紊乱引起的代谢综合征[22-23]。为了研究PIP对HFD诱发昼夜节律紊乱的影响,本实验测定了不同时间点肝脏中生物钟基因Bmal1、Clock、Cry1、Per2、Reverbα和Sirt1的mRNA表达水平,并对数据进行余弦分析(图2、表3)。如表3所示,各组中除HFD组中Per2未呈现出节律性表达(P>0.05),其他生物钟基因均呈现出节律性表达(P<0.01)。与ND组相比,HFD诱发了肝脏的昼夜节律紊乱,具体表现为Clock表达的振幅极显著减小且峰值相位出现延迟(P<0.01),Cry1表达的振幅极显著增大且峰值相位出现提前(P<0.01),Reverbα表达的峰值相位出现延迟(P<0.01)。与HFD组相比,PIP组大鼠Clock(P<0.05)和Per2(P<0.01)表达的振幅显著增大,Cry1表达的振幅显著减小(P<0.01),Bmal1、Clock、Cry1和Sirt1的峰值相位出现回复(P<0.01)。这些结果表明,PIP可以削弱HFD引起的大鼠肝脏生物钟基因表达的昼夜节律紊乱。

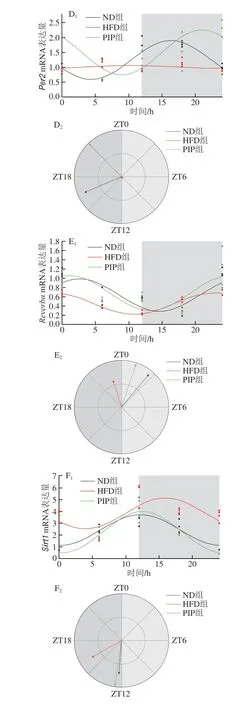
图2 PIP对HFD大鼠肝脏生物钟基因昼夜节律的影响Fig.2 Effect of PIP on the expression of hepatic circadian clock genes in HFD rats

表3 肝脏生物钟基因的昼夜节律参数Table 3 Circadian rhythm parameters of liver circadian clock genes
2.4 大鼠肝脏脂质代谢物的多元统计分析
为了进一步研究PIP对HFD引起的肝脏脂代谢紊乱的影响,本实验基于脂质组学方法分析了与脂代谢相关的潜在脂质生物标志物的变化。如图3A、B所示,正交偏最小二乘判别分析(orthogonal partial least squares discrimination analysis,OPLS-DA)和偏最小二乘判别分析(partial least squares discriminant analysis,PLS-DA)结果表明,各组内样本聚集较好,组间有所离散,表明HFD和PIP处理都影响了大鼠脂代谢模式。从图3C可以看出,ND vs HFD组存在160 种差异脂质代谢物,HFD vs PIP组存在78 种差异脂质代谢物,ND vs PIP组存在187 种差异脂质代谢物,表明各组之间脂质代谢物存在一定程度的差异。


图3 PIP对HFD大鼠肝脏脂代谢分子的影响Fig.3 Effect of PIP on liver lipid metabolism in HFD-induced rats
通过对比两组间P<0.05、变量重要性预测(variable importance projection,VIP)≥1、变化倍数(fold change,FC)≥1.5或≤0.67的化合物,生成两组间差异脂质种类聚类热图。如图3D、E所示,与ND组相比,HFD组中26 个代谢物上调和23 个代谢物下调;与HFD组相比,PIP组中34 个代谢物上调和15 个代谢物下调。值得注意的是,PIP可以逆转HFD条件下昼夜节律紊乱引起的差异脂质代谢物水平变化,如图3F、表4所示,PIP下调了HFD引起的TG(20:2e_18:1_18:2)、TG(20:3e_18:1_18:3)和TG(18:0_16:0_18:2)水平变化,上调了溶血磷脂酸(lysobisphosphatidic acids,LBPA)(16:0_18:1)、双甲基磷脂酸(bis-methyl phosphatidic acid,BisMePA)(38:8e)、磷脂酰乙醇胺(phosphatidyl ethanolamine,PE)(16:0p_22:6)和甲基磷胆碱(methylphosphocholine,MePC)(3 2:4 e)的水平。因此,这些结果表明,L B PA(16:0_18:1)、TG(18:0_16:0_18:2)、BisMePA(38:8e)、PE(16:0p_22:6)、MePC(32:4e)、TG(20:2e_18:1_18:2)、TG(20:3e_18:1_18:3)可能是PIP发挥降脂作用的潜在生物标志物。

表4 肝脏差异脂质信息Table 4 Information of differential liver lipids of ND vs HFD and HFD vs PIP groups
2.5 PIP对大鼠肝脏脂代谢基因昼夜节律的影响
目前的研究表明,长期摄入高脂食物会导致能量摄入和消耗不平衡、扰乱生物钟,导致脂代谢紊乱[24-25]。江芷晴等[26]的研究表明,在高脂饲喂条件下,肝脏生物钟基因节律性表达异常,肝脏脂肪分解减少,内源性脂肪合成异常增加,脂代谢基因的昼夜节律出现紊乱。本研究采用余弦拟合分析了PIP对HFD条件下肝脏脂代谢基因的昼夜节律的影响,结果如图4、表5所示。与ND组相比,HFD处理诱发了乙酰辅酶A羧化酶(acetyl-CoA carboxylase,Acc)mRNA表达的节律性表达缺失,PparγmRNA表达的振幅增大(P<0.01),肉碱棕榈酰转移酶1(carnitine palmitoyl transferase,Cpt-1)、肝脏X受体α(liver X receptor α,Lxrα)和腺苷酸激活蛋白激酶(AMP-activated protein kinase,Ampk)mRNA表达的振幅减小(P<0.01),Pparγ(P<0.05)、胆固醇调节元件结合蛋白(sterol regulatory element binding protein-1c,Srebp-1c)(P<0.01)mRNA表达的峰值相位出现延迟,CCAAT增强子结合蛋白β(CCAAT enhancer binding proteins β,Cebpb)mRNA表达的峰值相位出现提前(P<0.01),表明HFD诱发了脂代谢相关基因的节律性表达紊乱。与HFD组相比,PIP组中Pparγ、Srebp-1c、Cpt-1和LxrαmRNA表达的振幅趋近ND组(P<0.01),Fas(P<0.05)、Pparγ、Srebp-1c和Cebpb(P<0.01)的峰值相位也出现回复,表明PIP可改善由HFD引起的肝脏脂代谢相关基因昼夜节律的改变,部分恢复机体正常的昼夜节律。


图4 PIP对HFD大鼠肝脏脂代谢基因昼夜节律的影响Fig.4 Effect of PIP on circadian rhythm-mediated liver lipid metabolism genes in HFD-induced rats

表5 肝脏脂代谢基因的昼夜节律参数Table 5 Circadian rhythm parameters of liver lipid metabolism genes
2.6 脂质标志物、生物钟基因和脂质代谢基因之间的相关性分析
采用Spearman相关性分析和方差分析评估生物钟基因表达水平、肝脏中潜在脂质标志物和脂质代谢基因之间的相关性。如图5所示,TG(20:3e_18:1_18:3)、TG(20:2e_18:1_18:2)和TG(18:0_16:0_18:2)与Fas、Pparγ、Acc、Srebp-1c、Sirt1和Cebpb基因的表达水平呈正相关,与Clock、Cpt-1、Ampk、Per2、Bmal1、Lxrα、Cry1和Reverbα基因的表达水平呈负相关。相反,LBPA(16:0_18:1)、BisMePA(38:8e)、PE(16:0p_22:6)和MePC(32:4e)与Fas、Srebp-1c、Sirt1、Acc和Pparγ基因的表达水平呈负相关,与Lxrα、Clock、Reverbα和Bmal1基因的表达水平呈正相关。结果表明生物钟基因在LBPA(16:0_18:1)、BisMePA(38:8e)、PE(16:0p_22:6)和MePC(32:4e)的含量变化中起到重要的作用,而且LBPA(16:0_18:1)、BisMePA(38:8e)、PE(16:0p_22:6)和MePC(32:4e)有可能是PIP调节HFD引起昼夜节律紊乱的重要靶点。

图5 脂质标志物与肥胖相关的生物钟基因和脂质代谢基因之间的Spearman相关性Fig.5 Spearman correlation between biological clock genes and lipid metabolism genes associated with lipid biomarkers and obesity
3 讨论
研究表明,HFD可改变昼夜节律和能量代谢。同时,昼夜节律和新陈代谢之间的相互作用在维持机体的代谢稳态中发挥着重要的作用[27]。本研究通过设置不同的时间点进行取样检测,证明了PIP对肝脏生物钟和脂代谢基因昼夜节律的影响,并探讨了其可能的作用机制。
PIP是黑胡椒中的主要刺激性生物碱成分,在体外和体内实验均显示出显著的降脂活性。Shah等[28]发现,在HFD诱导的雄性SD大鼠中,灌胃剂量为40 mg/kgmb的PIP具有降脂和抗肥胖的功效。Brahmanaidu等[29]发现灌胃不同剂量(20、30 mg/kgmb和40 mg/kgmb)的PIP均能逆转HFD引起的动物体质量增加,改善了血浆和组织中脂质水平,增强了肝脏抗氧化能力,而且存在明显的量效关系。在本研究中,HFD大鼠在长期经口摄入30 mg/kgmbPIP后,其血清TC、TG和LDL-C水平显著降低,此结果与前人的研究结果[29]相一致,证实了PIP能够显著改善HFD大鼠的血脂水平。
随着研究的深入,研究人员发现生物钟系统可参与调控机体的糖脂代谢节律,从而干预与代谢紊乱相关的疾病[30]。已有研究指出,大约1/3的基因在小鼠体内表现出昼夜节律振荡,但是昼夜节律控制的基因在不同组织中的表达水平存在差异,表明昼夜节律的转录过程具有组织特异性[31]。Hans等[32]研究发现肝脏中的脂质代谢基因存在节律振荡,并与肥胖的发展密切相关。在本研究中,HFD条件下大鼠肝脏的脂质代谢基因(Acc、Pparγ、Cpt-1、Lxrα、Ampk、Srebp-1c、Cebpb)的节律性振荡均产生了不同程度的紊乱,表明HFD破坏了肝脏脂质代谢基因表达水平的昼夜节律,这与Hans等[32]的研究结果相一致。有研究指出,Per2基因通过直接调节Pparγ的表达控制脂质代谢。Wang Tao等[33]发现在Per1敲除小鼠中,Pparγ及其与TG合成相关的靶基因振幅出现紊乱,表明机体的脂代谢昼夜节律由内源性生物钟系统驱动。Pparγ和Lxrα可增强肝细胞中的Srebp-1c表达水平,且Srebp-1c可促进Fas和Acc等脂肪酸合成相关基因的转录,在脂肪生成中起着核心作用[34]。在摄入PIP后,HFD大鼠肝脏中Pparγ、Srebp-1c、Cpt-1和Lxrα的节律性近似于ND组,同时肝脏损伤和血脂水平也显著降低,证实PIP通过改善HFD引起的肝脏脂质代谢基因表达水平的昼夜节律紊乱,减少了肝脏损伤并降低了血脂,说明PIP通过调整肝脏脂质代谢基因的节律振荡发挥减肥降脂功效,与川芨素、白藜芦醇、辣椒素等活性物质的降脂机制一致[35]。经过脂质组学分析和相关性分析,发现LBPA(16:0_18:1)、BisMePA(38:8e)、PE(16:0p_22:6)和MePC(32:4e)与脂质代谢基因表达密切相关,这说明上述脂质代谢物可能是PIP调节HFD引起脂质代谢昼夜节律紊乱的重要靶点。这个发现为研究脂质代谢相关基因昼夜节律表达水平的改变对脂质代谢物产生影响的机制奠定了基础。未来仍需进一步探究PIP调控脂质代谢相关基因节律性表达的作用机制。
4 结论
本研究首先构建了高脂饲料诱发的大鼠肥胖模型,探究了PIP对肥胖大鼠脂代谢昼夜节律的调节作用。实验结果表明,PIP可以减轻HFD诱导的肝脏损伤,降低血脂水平,缓解肝脏生物钟和脂代谢基因表达的昼夜节律紊乱。此外,对大鼠肝脏脂质组学分析,发现PIP处理恢复了HFD引起的TG(20:2e_18:1_18:2)、TG(20:3e_18:1_18:3)、TG(18:0_16:0_18:2)、LBPA(16:0_18:1)、BisMePA(38:8e)、PE(16:0p_22:6)和MePC(32:4e)的水平变化,且LBPA(16:0_18:1)、BisMePA(38:8e)、PE(16:0p_22:6)和MePC(32:4e)与肝脏生物钟基因的表达水平具有显著相关性,表明其可能是PIP通过生物钟基因调节肝脏脂代谢的关键脂质组分。综上所述,PIP作为一种多功能性的植物化学物质,具有调节高能量饮食诱发的脂质代谢昼夜节律紊乱的潜力。在未来研究中,采用特定器官生物钟基因敲除鼠将更有利于阐明PIP调控肝脏脂代谢昼夜节律的作用机制。
