传统发酵牦牛乳制品中微生物群落及其与代谢产物相关性
2024-05-20梁晓琳张哲川王宇豪刘红娜
梁晓琳,张哲川,王宇豪,丁 波,刘红娜,*
(1.西北民族大学生物医学研究中心,生物工程与技术国家民委重点实验室,中国-马来西亚国家联合实验室,甘肃 兰州 730030;2.西北民族大学生命科学与工程学院,甘肃 兰州 730030)
微生物发酵是青藏高原牧民延长鲜牦牛乳货架期和丰富乳品风味的有效途径。由于牧区缺乏新鲜蔬菜水果,以牦牛乳为原料的自然发酵乳制品便成为藏区牧民日常饮食的主要构成部分。这类乳制品能提供足够的营养,是牧民抵御高寒高海拔环境的能量来源,同时也是牧民重要的经济来源[1]。牦牛酥油、曲拉、牦牛酸奶是我国特色传统发酵乳制品,其中酥油是以牦牛乳脂肪为原料发酵数小时至3 d的高脂乳制品,曲拉是由脱脂牦牛乳制成的天然发酵干制奶酪,牦牛酸奶是一种添加发酵剂发酵8~24 h的发酵乳[2]。开放的生产方式使这些手工制作的乳制品微生物结构复杂,形成一系列与风味相关的代谢物。通过比较传统发酵牦牛乳制品的微生物群落结构,明确其与代谢产物的关系,为调控发酵牦牛乳制品的品质提供理论基础。
稳定的微生物群落结构是保证发酵乳制品品质与安全的基础[3]。高通量测序常被用于分析发酵食品中微生物群落,包括微生物动力学、食品安全和功能健康等方面[4]。对发酵牦牛乳制品而言,目前研究主要集中在简单的微生物区系分析和乳酸菌种类鉴定[5-7]。据报道,乳制品的发酵初期品质主要与细菌(如乳酸菌)和酵母(如酵母菌)有关[8]。有学者证实了各种细菌是建立成熟奶酪风味特性的关键[9]。此外,广阔的青藏高原是丰富的微生物资源库[10]。为此,除了研究发酵牦牛乳制品个别特征菌属的相对丰度和作用,还需要进一步分析整体的微生物群落构成。
食品中的微生物丰度与代谢物有关,例如有机酸和脂质[11-12]。Li Yandie等[13]利用非靶向代谢组学技术检测发酵干酪中特定代谢物和风味前体化合物,如有机酸、脂质、氨基酸等。Unno等[14]通过分析成熟奶酪中的代谢物鉴定重要的风味化合物,并间接揭示可能存在的细菌。使用代谢组学还可筛选与切达干酪质量相关的生物标志物[15]。尽管如此,发酵牦牛乳制品中微生物群和代谢物及其影响品质的相互关系仍然知之甚少,青藏高原的微生物资源更是未知。因此,深入研究不同类型发酵乳制品的微生物组成,明确各菌属对代谢产物的贡献,对稳定发酵牦牛乳制品的品质具有重要指导意义。
本研究以传统发酵牦牛乳制品为对象,采用Illumina MiSeq第二代测序技术研究不同类型发酵牦牛乳制品的微生物多样性;同时,基于气相色谱-飞行时间质谱(gas chromatography-time-of-flight mass spectrometry,GCTOF-MS)非靶向代谢组学技术通过多元统计分析筛选差异代谢物。结合微生物和代谢组学结果,对传统发酵牦牛乳制品优势微生物的多样性与代谢组分进行关联分析,旨在为更好地提高不同类型传统发酵乳制品的品质和实现工业化生产提供理论依据。
1 材料与方法
1.1 材料与试剂
从牦牛奶主要产区中国甘肃甘南牧区合作市当周草原(东经102°、北纬34°)采集酥油、曲拉、牦牛酸奶各3 份(共9 份)。在采样过程中,牦牛酸奶(YY1、YY2、YY3)收集100~300 mL,酥油(YG1、YG2、YG3)、曲拉(QL1、QL2、QL3)各100 g,一式3 份,将所有样品置于无菌瓶中编号,并放于冰盒内保存。取样完毕后,24 h内将样品转移到实验室以备实验。
所有分离用有机溶剂均为国产分析纯,购自国药集团化学试剂有限公司。
1.2 仪器与设备
Pico-21台式离心机 美国赛默飞世尔科技公司;YXQ-LS-100SII立式压力蒸汽灭菌 上海博迅实业有限公司医疗设备厂;DYCZ-21电泳槽、DYY-6D电泳仪 北京六一生物科技有限公司;ETC 811聚合酶链式反应(polymerase chain reaction,PCR)仪 北京东胜创新生物科技有限公司;GL-88B旋涡仪 海门市其林贝尔仪器制造有限公司;7890 GC-TOF-MS仪(配有DB-5MS毛细管柱)美国安捷伦公司。
1.3 方法
1.3.1 微生物基因组的提取及测序
取适量样品放入2 mL 样品管,在组织破碎仪中破碎提取。参照OMEGA试剂盒E.Z.N.ATMMag-Bind Soil DNA提取试剂盒提取样品DNA。利用含有Barcode引物341F(5’-CCTACGGGNGGCWGCAG-3’)和805R(5’-GACTACHVGGGTATCTAATCC-3’)扩增细菌16 SrRNA V3~V4 区域;利用ITS1F(5’-CTTGGTCATTTAGAGGAAGTAA-3’)和ITS2R(5’-GCTGCGTTCTTCATCGATGC-3’)扩增真菌ITS1~ITS2区域,在Illumina MiSeq™/HiSeqTM平台进行测序。
1.3.2 GC-TOF-MS代谢物测定
代谢物提取:根据Nie Xin等[16]的研究稍作修改。取样本(25±1)mg于2 mL EP管中,加入500 μL预冷提取液,涡旋30 s,冰水浴超声10 min,将混合物均质。然后以4 ℃、12 000 r/min离心15 min。移取100 μL上清液于1.5 mL EP管中,真空干燥提取物。
代谢物衍生化:向干燥后的代谢物加入40 μL甲氧胺盐试剂,轻轻混匀后,放入烘箱中80 ℃孵育30 min,随后向每个样品中加入60 μL衍生试剂N,O-双(三甲基硅烷基)三氟乙酰胺(含有体积分数1%三甲基氯硅烷),将混合物70 ℃孵育1.5 h,冷却至室温后随机上机检测。
GC-TOF-MS具体分析条件如表1所示。

表1 GC-TOF-MS分析条件Table 1 Analytical conditions for GC-TOF-MS
1.4 数据处理与分析
以相似性97%对各样本有效数据进行操作分类单元(operational taxonomic units,OTU)划分,选取代表性的OTU序列与Silva数据库(http://www.arb-silva.de)进行比对注释,确定各OTU的分类学信息,进而计算各样品在门和属水平的相对含量。基于OTU聚类分析结果,进行α多样性分析。
将获得的GC-TOF-MS原始数据进行偏离值过滤、缺失值过滤、填补及数据标准化处理。根据人类代谢组数据库(Human Metabolome Database,HMDB)和有机小分子生物活性数据库(PubChem (nih.gov))进行鉴定。数据导入SIMCA 14.1软件进行主成分分析(principal component analysis,PCA)和偏最小二乘判别分析(partial least squares-discriminant analysis,PLS-DA)。并利用京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库(https://www.kegg.jp/kegg/pathway.html)进行代谢通路分析。使用GraphPad Prism 9.0软件统计分析和绘图,采用ANOVA进行组间差异显著性检验,P<0.05表示差异显著。
2 结果与分析
2.1 不同传统发酵牦牛乳制品中微生物群落结构分析
Shannon指数可用于估算样品中微生物多样性;Chao1 指数反映群落中OTU 数目即群落丰富度;Shannoneven指数反映物种个体数目在群落中分配的均匀程度。在细菌的测序结果中,YG1具有最高的Chao1指数(表2),说明此酥油样品中细菌群落丰富度较高。QL2具有最高的Shannon指数、Shannoneven指数,说明QL2细菌群落多样性最高,且细菌群落分布均匀;而YY组细菌群落的多样性和丰富度最低。真菌的测序结果显示,QL2样品具有最高的Shannon指数和Shannoneven指数(表3),表明QL2样品的真菌群落多样性最高且数目分配状况均匀,与细菌微生物群落特征相似。此外,YY组的Shannon指数整体较高,表明酸奶样品真菌群落较为复杂。所有样本覆盖率高(>99.8%),本测序结果能反映不同传统乳制品样本中微生物群落真实状况。

表2 Illumina测序细菌统计信息Table 2 Statistics of Illumina sequencing data of bacterial community

表3 Illumina测序真菌统计信息Table 3 Statistics of Illumina sequencing data of fungal community
发酵乳制品的微生物种类和数量直接影响产品的品质和安全性[9]。为了更好地了解不同传统发酵牦牛乳制品的微生物群落,对OTU标签进行了门和属水平的分类。3 种传统牦牛乳制品样品共鉴定出4 个细菌门(图1A),包括厚壁菌门(Firmicutes)、变形杆菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和放线菌门(Actinobacteria),共占样品中细菌菌落总数的99%以上。此外,在真菌门水平的相对丰度中发现,子囊菌门(Ascomycota)是发酵牦牛乳制品的优势真菌门,其次是担子菌门(Basidiomycota)(图1B)。结果表明,在门水平上这些传统乳制品间的微生物菌群具有相似性。

图1 基于门水平3 种乳制品样品中细菌(A)、真菌(B)菌群结构分析结果Fig.1 Structural analysis of bacterial (A) and fungal (B) communities at the phylum level in three fermented yak milk products
由图2A可知,属水平上,不同类型的传统发酵乳制品的微生物群落结构不同。在YY和QL样品中发现10 个优势细菌属,YG样品中共鉴定出16 个优势细菌属。乳杆菌(Lactobacillus)为YY和QL的优势细菌,含量显著高于YG样品,部分样品还检测到链球菌属(Streptococcus)。乳杆菌可产生α-半乳糖苷酶,推测此酶对酸奶和曲拉发酵过程中风味形成相关的碳水化合物代谢起重要作用,进而影响产品的风味。同时,乳杆菌还具有降低人体肠道pH值、代谢乳糖、抑制人体肠道内的病原菌以维持肠道微生态平衡等功效[17]。而YG样品以乳球菌属(Lactococcus)为主。乳球菌和乳杆菌作为发酵剂,在发酵乳制品中起到促进凝乳的作用[18]。其次,QL和YG鉴定的优势细菌还有明串珠菌(Leuconostoc)。乳杆菌、乳球菌、链球菌和明串珠菌是乳制品中优势菌属,主要是来自厚壁菌门,它们通过消耗乳糖和其他碳水化合物、蛋白质、肽和脂肪产生短肽、游离氨基酸、短链脂肪酸和芳香族化合物,有助于乳制品形成风味和产生营养成分[19]。特别的是,醋酸杆菌属(Acetobacter)主要在QL样品中被检测到,而Zhu Yan等[20]对青藏高原曲拉的细菌群落研究中也发现曲拉样品共有的优势菌为醋酸杆菌,但不同来源的样品中微生物群落存在显著差异,推测该菌对曲拉的品质有独特影响。然而,部分样品含有食源性致病菌及与环境污染有关的细菌属,如不动杆菌(Acinetobacter)、肠杆菌(unclassified_Enterobacteriaceae)、金黄杆菌(Chryseobacterium)、肠球菌(Enterococcus)等。致病菌的存在是由于传统发酵牦牛乳制品通常是在家庭作坊生产的,采用开放式的自然发酵生产工艺,容易受到挤奶方式、牦牛生理状况和饲养方式、乳制品生产方法的影响[21]。改善生产过程中的环境卫生条件,有助于减少或避免感染致病菌,稳定牦牛乳制品的质量安全。在真菌属中,传统乳制品中共有真菌属为地霉属(Geotrichum),其他真菌属种类及含量均存在一定差异(图2B)。地霉属存在于牛乳及乳制品中,如生产卡门培尔干酪、罗奎福特干酪和青纹干酪时需要依靠霉菌[22-23]。毕赤酵母(Pichia)在YY组和QL组中均能检测到,而克鲁维酵母(Kluyveromyces)主要存在于YY组中。克鲁维酵母是蒙古发酵乳制品酸马乳的主要分离物,这是因为马乳比其他动物乳含有更高的糖浓度和更低的脂肪浓度[24]。YG组使用乳脂肪制作,QL组使用的是脱脂乳(大部分为蛋白质),而YY组使用的是新鲜牦牛乳,各组别的组分有所差异,发酵方式和用于发酵的底物也各不相同。对于YY组,来自牦牛乳中的乳糖作为底物被分解[25],促进乳糖发酵酵母的生长繁殖。因此,本研究中克鲁维酵母为YY组特有的菌属。此外,3 类发酵牦牛乳制品的制作工艺不同也影响了它们的微生物组成。结果表明,不同类型的发酵牦牛乳样本中的微生物群在属水平上表现出较高的生物多样性。

图2 基于属水平3 种乳制品样品中细菌(A)、真菌(B)菌群结构分析结果Fig.2 Structural analysis of bacterial (A) and fungal (B) communities at the genus level in three fermented yak milk products
综上所述,有必要系统探索传统发酵牦牛乳制品的菌群结构,加快从传统的生产模式过渡到现代标准化的生产进程,这将有助于稳定发酵牦牛乳制品的品质。
2.2 不同传统牦牛发酵乳制品多元统计分析
代谢组学技术已被广泛应用于食品研究中,利用GC-TOF-MS分析可鉴定样品的发酵代谢物[26]。采用PCA突显代谢组学数据的总体分布趋势以及组间样本的差异程度。由图3可知,PC1的方差贡献率为51.2%,PC2的方差贡献率为20.9%。从主成分轴上可明显划分为酥油、曲拉和酸奶3 组,且曲拉和酸奶组与酥油组差异较大,这可能是因为不同的加工制作方法和发酵程度使3 种发酵乳制品逐渐形成复杂的微生物群落,从而导致相应产品中代谢产物的差异[26]。

图3 不同传统乳制品中代谢物PCA得分散点图(A)、PLS-DA得分散点图(B)、响应排序检验图(C)Fig.3 PCA scatter plot (A),PLS-DA scatter plot (B) and permutation test plot (C) for metabolites in different traditional fermented yak milk products
为进一步体现组别之间的差异,对样品采用有监督模式的PLS-DA方法。分别为71.9%、70.1%,PLS-DA和PCA的结果均表明这3 组样本集能明显分离,说明它们之间的代谢物差异明显。这说明代谢物差异受传统发酵乳制品种类的影响。为了防止模型过度拟合,对PLS-DA模型进行排列检验,R2=(0.0,0.493),Q2=(0.0,-0.154),结果表明本研究中的模型具有良好的可预测性和可重复性,没有过度拟合,可以进一步筛选3 组样本聚类的差异代谢物。
2.3 不同传统发酵牦牛乳制品差异代谢物及代谢途径分析
基于变量投影重要性(variable importance in the projection,VIP)预测值和P值的选择能识别差异显著的代谢物。根据VIP≥1和P<0.05,共鉴定出51 种显著差异代谢产物,主要包括脂质和类脂质分子(21 种)、有机酸及其衍生物(17 种)、有机杂环化合物(4 种)等(图4A)。根据其丰度变化进行层次聚类分析,并以热图概述不同发酵乳制品中代谢物类型。如图4B所示,3 种传统发酵牦牛乳制品可以明显分为3 个类别,其中曲拉和牦牛酸奶样品之间的化学相似性更大,这与PCA和PLS-DA的预测结果一致。51 种代谢产物被分为4 个聚类。
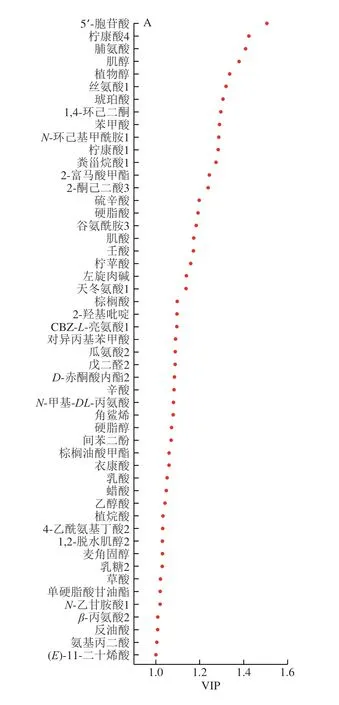

图4 不同类型乳制品通过PLS-DA建模VIP值(A)、代谢物的层次聚类分析热图(B)和差异代谢物KEGG富集图(C)Fig.4 PLS-DA VIP scores (A),hierarchical cluster heatmap (B) and KEGG enrichment map (C) of differential metabolites
第1聚类由14 种代谢产物组成,包括植烷酸、衣康酸、2-羟基吡啶、乳酸、对异丙基苯甲酸、角鲨烯、辛酸、瓜氨酸、D-赤酮酸内酯、乳糖、硬脂醇、蜡酸、戊二醛、棕榈油酸甲酯,其中8 种代谢物属于脂质和类脂质分子,主要为酥油的特征代谢物。乳酸是由丙酮酸通过乳酸脱氢酶产生,给酥油带来良好的风味和醇厚的口感[27]。乳糖是乳及乳制品中主要的滋味贡献物质。乳酸菌将乳糖分解为单糖,产生包括乳糖酶在内的多种代谢酶类,代谢产生多种风味物质[28]。同时,研究发现酥油样品组中存在角鲨烯。据报道,角鲨烯具有抗氧化、抗肿瘤、提高缺氧耐受力、抗心血管疾病、抗菌消炎等作用[29]。这些代谢物对酥油的风味品质和营养起重要作用。
第2~3聚类属于曲拉样品的代谢物,主要由10 种有机酸及其衍生物、7 种脂质和类脂质分子、2 种有机杂环化合物等25 种化合物组成。有机酸及其衍生物作为发酵制品中丰富而显著的差异代谢物,具有呈香、呈味作用,同时也可在发酵过程中抑制杂菌的生长[30-31]。Wang Yujing等[22]对云南酸乳扇的研究发现,有机酸一部分来源于牦牛乳经过发酵乳糖后的转化,另一部分来源于发酵过程中微生物代谢产生,如酵母菌在发酵过程中能产生琥珀酸,醋酸菌、乳酸菌等产酸菌可以产生乙酸、乳酸、草酸、丙酮酸等各种有机酸[32]。这些有机酸各具独特的风味,只有当各种有机酸比例相互协调时,才能保证产品的品质。本研究在不同乳制品差异代谢物中检测到的有机酸及其衍生物有草酸、乳酸、琥珀酸等。琥珀酸能产生鲜味,是三羧酸循环和糖酵解的重要中间产物[33],各样品中的琥珀酸含量差异很可能与发酵工艺和贮藏时间有关。发酵时间以及贮存时间过长都会导致琥珀酸含量升高。脯氨酸、天冬氨酸、丝氨酸等可通过氨基酸转化酶转化为挥发性气味化合物,为乳制品提供良好的滋、气味。造成不同类型发酵乳制品间氨基酸的差异可归因于微生物中的氨基酸溶出不同[34]。
第4聚类中发现酸奶含有较多的脂质和类脂质分子与有机酸及其衍生物,包括棕榈酸、硬脂酸等多种脂肪酸,对乳制品风味的形成具有重大作用。这类脂肪酸主要来源于原料乳,由于曲拉的生产原料乳为脱脂牦牛乳,因此在曲拉样品中较少检出。4-乙酰氨基丁酸普遍存在于酥油、酸奶组中,其具有降低血压、改善脑功能、增强记忆力的生理活性[35]。β-丙氨酸的含量在酸奶组中显著高于其他两个样品组。总之,由于生产工艺、发酵微生物的作用和发酵环境等多种因素影响,传统乳制品的代谢物复杂多样。
发酵乳制品的风味和品质受到不同的代谢物质和反应共同调控,除了对代谢物质差异进行分析,还需进一步对其代谢通路进行分析。KEGG代谢途径用于分析探索差异代谢物可能的代谢途径,图4C颜色由蓝到黄代表富集因子依次增加;气泡大小代表富集到该通路的差异代谢物数目。本研究发现传统发酵牦牛乳制品存在新陈代谢途径、ABC转运、碳水化合物代谢、乙醛酸和二羧酸代谢、中心碳代谢、氨基酸的生物合成、脂肪酸的生物合成、不饱和脂肪酸的生物合成、精氨酸和脯氨酸代谢、矿物质吸收、半乳糖代谢、嘌呤合成代谢12 种代谢途径。这些代谢途径与氨基酸和脂质分解代谢密切相关,表明牦牛乳制品中的脂肪分解和氨基酸代谢可能是影响产品质量的关键。
2.4 微生物属水平与差异代谢物的相关性分析
发酵乳制品微生物群和代谢产物之间存在密切关系。选取差异代谢物中VIP值前10的代谢物与微生物群落的结果(属水平)进行Pearson相关性分析,结果如图5所示。在细菌网络中,大多数细菌属彼此之间呈正相关[20]。而本研究从细菌之间的相互作用及细菌与代谢物之间的相关性显示乳球菌与乳杆菌呈负相关。在微生物-代谢关系中,乳杆菌与除植物醇外的9 种代谢物呈显著正相关,乳球菌则恰好相反。当乳球菌增加时乳杆菌数量降低,两者存在竞争抑制关系,它们的相对含量对乳制品风味有显著影响,进而导致酸奶、曲拉及酥油间风味存在差异。结果表明,发酵乳制品中的微生物并不是孤立存在的,而是形成了复杂的和相互作用的生态网络。在切达奶酪微生物-代谢关系研究中还发现链球菌属、乳杆菌属、乳球菌属、巨大球菌属和明串珠菌属与氨基酸显著相关[36]。本研究发现脯氨酸(甜味氨基酸)只与乳杆菌和链球菌呈正相关,说明乳杆菌和链球菌对甜味的产生有间接作用。克鲁维酵母和毕赤醇母与有机酸呈显著正相关(P<0.05),这是由于酵母分解乳糖同时生成大量的有机酸。细菌属中,乳杆菌属、乳球菌属与代谢物有较高的相关性,真菌属中克鲁维酵母属、毕赤酵母属、地霉属和短梗霉属(Aureobasidium)与代谢物有较高的相关性,推测它们对3 种发酵牦牛乳风味品质和营养的形成有重要贡献。由此可见,各类微生物的作用机制有所差异,进而形成了不同类型发酵牦牛乳制品代谢产物与营养物质的迥异。本研究揭示了3 种发酵牦牛乳制品的微生物结构及代谢的关联,为进一步基于假设的靶向研究与途径分析相结合提供了基础,这将有利于牦牛乳制品行业的产业化和标准化生产。
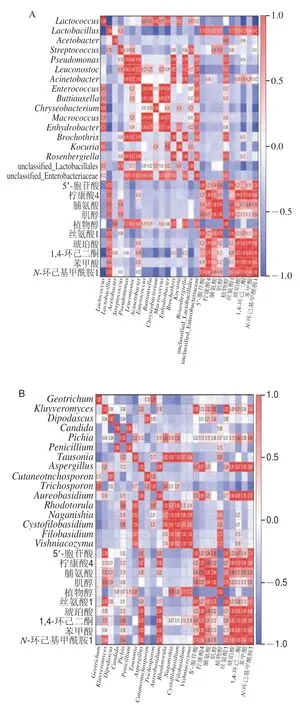
图5 所有乳制品样品中差异代谢物与属水平细菌(A)、真菌(B)的Pearson相关性分析Fig.5 Pearson correlation analysis of differential metabolites with bacteria (A) and fungi (B) at the genus level in fermented yak milk products
3 结论
本实验研究3 种传统牦牛乳制品微生物群落结构及其对代谢产物的贡献,揭示了属水平上微生物丰度差异,特别是乳杆菌、乳球菌、毕赤酵母和克鲁维酵母。不同类型的发酵牦牛乳制品筛选的51 种差异代谢物中主要包括脂质和类脂质分子、有机酸及其衍生物、有机杂环化合物等。使用KEGG富集分析得到12 种代谢途径,大部分与氨基酸和脂质分解代谢密切相关。传统发酵牦牛奶样品的微生物组成与代谢物之间有紧密联系。乳杆菌和链球菌与脯氨酸呈正相关,克鲁维酵母和毕赤醇母与有机酸呈显著正相关,推测这些是影响产品品质的关键菌。然而,影响发酵乳制品品质的因素比较复杂,微生物、代谢产物与发酵牦牛乳制品风味的关系有待通过其他组学方法进一步验证,包括宏基因组学、蛋白质组学和元转录组学。
