基于化学史与学科逻辑的“化学反应限度”单元教学设计
2024-05-19郭津含王秀红杨海艳武衍杰
郭津含 王秀红 杨海艳 武衍杰


摘要: 教学设计需兼顾学生认知心理发展特征及知识的整体性。基于化学史,纵向厘清概念形成与发展的思维路径,提取符合学生心理发展规律的认知逻辑;基于学科逻辑,横向厘清现代化学理论视域下的概念结构体系,提取凸显知识系统与完整的客观逻辑。通过十个学习任务完成有关“化学反应限度”的存在、表征与调控,突破或解决以往教学中学生的迷思问题,发展学生的定量认识,取得较好的教学效果。
关键词: 化学反应限度; 化学史; 学科逻辑; 定量认识; 单元教学
文章编号: 1005-6629(2024)02-0041-07
中图分类号: G633.8
文献标识码: B
1 问题的提出
化学反应限度描绘了化学反应中的一种重要状态,是中学化学课程中重要的核心概念。课标要求:认识化学平衡常数是表征反应限度的物理量,知道化学平衡常数的含义;了解浓度商和化学平衡常数的相对大小与反应方向间的联系[1]。人教版教材选择性必修1将这部分内容划分为三个板块:化学反应限度的存在、表征与调控。
由于教学内容理论性较强,在以往的教学中,学生常因这部分的学习内容产生迷思,主要表现为:(1)不能理解为什么“ΔG<0或ΔG>0说明的是方向,而ΔG=0说明的却是限度”(反应限度的存在方面);(2)不能理解科学家最初是如何想到生成物浓度的幂之积与反应物浓度的幂之积的比值是定值,对于教材中碘化氢教学素材的数据处理方式感到很突兀(反应限度的表征方面);(3)认为化学反应方向改变时限度也会有一致性的改变(反应限度的调控方面)。这些问题的产生与教材的编写逻辑和学生的认知逻辑之间的矛盾有一定关系,教材编写逻辑偏重于学科知识的系统性与完整性,即“学科逻辑”,而学生认知逻辑偏重于思维的成长,理解事情发展的来龙去脉[2]。也就是说,教材更多地呈现“是什么”,而学生需要理解“为什么是”。已有研究大多基于某一方面对内容进行剖析理解,且集中于“化學平衡常数”的教学内容[3]。基于已有研究,本研究以横向与纵向二维视角构建“化学反应限度”单元整体教学设计:立足学科逻辑横向梳理多个版本的高中教材及大学教材,以解决“是什么”的问题;立足化学史纵向梳理“化学反应限度”相关理论建立的发展历程,以解决“为什么是”这一问题,继而将二者有机融合,构建顺应学生认知规律的学习逻辑。
2 教学主题内容及相关研究
2.1 基于化学史的纵向梳理
以化学史为时间线索,明晰各时期历史贡献与化学反应限度的内在关联,整理如表1所示。
鉴于对化学史的梳理,获得以下启示:
(1) 利用化学史厘清概念的形成与发展的思维路径。人们认识化学反应限度,先后经历了几个阶段:①定性地认识到化学反应存在“可逆性”;②通过动力学实验数据找到定量表征反应限度的规律;③基于热力学理论定量地证明并表征反应限度的存在;④基于热力学理论定量地计算化学反应限度的数值。可见,“化学反应限度”是典型的定量类核心概念,应着力凸显其定量的认识功能。
(2) 利用化学史提取符合学生心理发展规律的认知逻辑。动力学领域最早印证了化学反应限度的存在,并明确指出反应限度与“有效质量”的关系,借助质量作用定律可以帮助学生很好地建立反应限度与物质浓度的关系,解决学生的迷思问题。考虑到质量作用定律仅适用于基元反应,可以利用教材中非基元反应数据加以验证,如此既能尊重化学史的客观发展时序,顺应学生的认知规律,也能提高教学素材使用的科学性。可见,在突破学生迷思问题方面,化学史能够给予有效的指引。
2.2 基于学科逻辑的横向梳理
以现代化学理论为研究线索,将高中各版本教材及化学经典著作[7,8]中对于化学反应限度的存在、表征和调控等相关内容整理如下。
2.2.1 化学反应限度的存在依据
(1) 基于质量作用定律的动力学依据。质量作用定律是根据大量实验数据获得的经验依据,仅适用于基元反应。即反应
aA+bBcC+dD,若正逆反应均为基元反应,便有v正=k正ca(A)cb(B), v逆=k逆cc(C)cd(D),当正逆反应速率相等时,基元反应平衡常数K基元=k正/k逆[9]。
(2) 基于吉布斯函数的热力学依据。封闭系统中,反应向状态函数G减小的方向进行,达到最小值时即为平衡态。化学反应的自发方向决定于系统相对于平衡态所处位置,若处于平衡态左侧,发生正反应;在平衡态右侧发生逆反应(图1)[10]。因此,ΔG>0时,反应不能自发进行;ΔG<0时,反应以不可逆的方式自发进行;ΔG=0时,反应以可逆的方式自发进行,达到平衡[11]。
2.2.2 化学反应限度的表征方式
(1) 基于热力学原理的表征——化学平衡常数。根据范特霍夫动态平衡原理ΔGθ=-RTlnKθ可以看出,标准态(298K, 100kPa)时,只要有热力学函数ΔGθ数据,便可获得Kθ,利用Kθ可以对反应发生的倾向进行理论层面的定量预判,以此指导生产实践。
(2) 基于工业生产直观需求的表征——平衡转化率(或平衡产率)。工业上,常用平衡转化率α(或平衡产率)来表示一定条件下的反应限度,与热力学平衡常数相比,平衡转化率更为直接。
2.2.3 化学反应限度的调控方式
(1) 基于化学平衡常数K的改变调控反应限度。根据ΔGθ=-RTlnKθ的推导式Kθ=e-ΔGθRT可知,影响Kθ的因素包括ΔGθ与T,改变这两个条件即可调控反应限度。改变ΔGθ可利用反应之间的耦合;改变温度T需要结合反应的热效应,根据范特霍夫等温方程推导式lnK2K1=ΔHR1T1-1T2可知,当ΔH>0时升温提高反应限度,ΔH<0时降温提高反应限度,|ΔH|越大,即热效应越明显,温度对反应限度的影响就越大。
(2) 基于浓度熵Q的改变调控反应限度。根据K-Q关系可实现反应限度的调控,需要注意的是,当Q改变,令Q<K时反应正向移动,但反应限度α是否增大仍需进一步讨论,Q的改变首先调控的是方向,至于反应限度α是否为最佳,需要控制反应物的投料关系。
鉴于对学科逻辑的梳理,获得以下启示:
(1) 利用学科逻辑厘清现代化学理论视域下的内容结构体系。以吉布斯函数G证明存在反应限度是最符合科学本质的认识方式,将教材中“化学反应方向”内容前置于“化学反应限度”,结合图1既能证明反应限度是普遍存在的,也能解决前文提及的迷思问题,为了不给学生增加学习负担,借鉴人教版教材呈现ΔG的方式,教学中以资料的形式让学生认识。
(2) 利用学科逻辑厘清概念建构过程中的教材处理方式。定量类概念是定性概念的延伸与发展,这类概念的形成是以学生大量的感性认识为基础的[12]。教材在必修阶段以正逆反应速率相等、化学实验等方式让学生从定性的角度认识到化學反应存在限度;进入选择性必修阶段,教材引入化学平衡常数及平衡转化率定量表征反应限度,利用K-Q关系定量调控反应限度,因此,在教学设计时要侧重于建构“定量认识化学反应限度”的进阶性视角。
经过以上对化学史与学科逻辑的梳理可以发现,化学反应限度的存在、表征与调控的背后均有定量理论作为支撑,见表2。
为建构学生对化学反应限度的定量认识,应着力于探究“量的关系”,让学生有意识地辨析数据的作用,以数据作为证据进行分析与解释、推理与论证,从培养“量”的意识到发展“量”的思维,最后达成“量”的认识[13]。
3 “化学反应限度”单元教学设计
3.1 单元教学目标
(1) 认识化学反应存在限度,并对反应限度进行定量表征,且表征的方式不唯一。
(2) 建立基于浓度商与化学平衡常数调控反应方向与限度的定量分析模型;能够掌握在K不改变而Q改变时调控反应限度的方式。
(3) 认识影响化学平衡常数K的因素,能够利用K的影响因素调控化学反应限度。
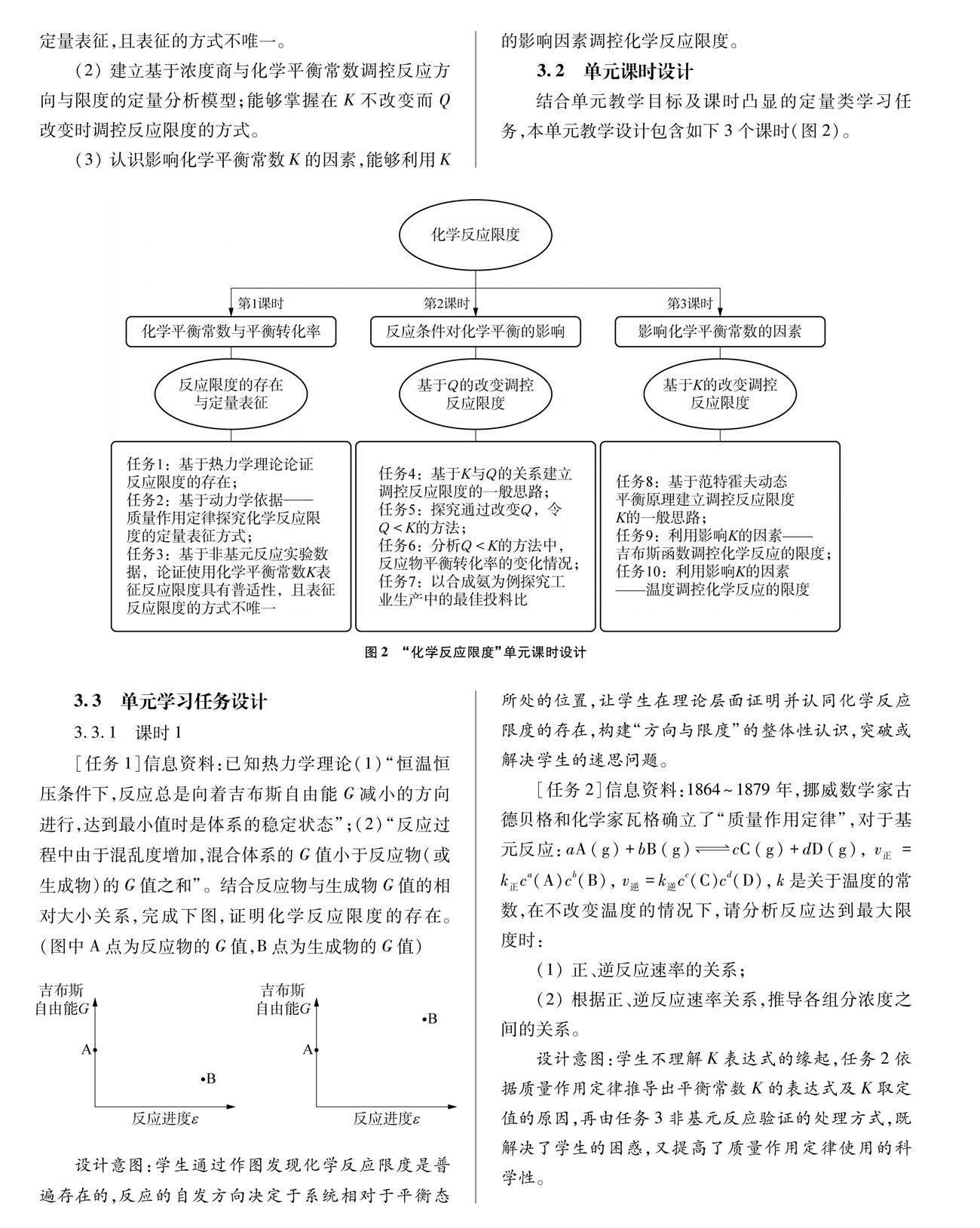
3.2 单元课时设计
结合单元教学目标及课时凸显的定量类学习任务,本单元教学设计包含如下3个课时(图2)。
3.3 单元学习任务设计
3.3.1 课时1
[任务1]信息资料:已知热力学理论(1)“恒温恒压条件下,反应总是向着吉布斯自由能G减小的方向进行,达到最小值时是体系的稳定状态”;(2)“反应过程中由于混乱度增加,混合体系的G值小于反应物(或生成物)的G值之和”。结合反应物与生成物G值的相对大小关系,完成下图,证明化学反应限度的存在。(图中A点为反应物的G值,B点为生成物的G值)
设计意图:学生通过作图发现化学反应限度是普遍存在的,反应的自发方向决定于系统相对于平衡态所处的位置,让学生在理论层面证明并认同化学反应限度的存在,构建“方向与限度”的整体性认识,突破或解决学生的迷思问题。
[任务2]信息资料:1864~1879年,挪威数学家古德贝格和化学家瓦格确立了“质量作用定律”,对于基元反应:aA(g)+bB(g)cC(g)+dD(g),v正=k正ca(A)cb(B), v逆=k逆cc(C)cd(D),k是关于温度的常数,在不改变温度的情况下,请分析反应达到最大限度时:
(1) 正、逆反应速率的关系;
(2) 根据正、逆反应速率关系,推导各组分浓度之间的关系。
设计意图:学生不理解K表达式的缘起,任务2依据质量作用定律推导出平衡常数K的表达式及K取定值的原因,再由任务3非基元反应验证的处理方式,既解决了学生的困惑,又提高了质量作用定律使用的科学性。
[任务3]
(1) 探究非基元反应H2(g)+I2(g)2HI(g)在457.6℃达到平衡状态时,各组分的浓度关系与任务2所得结论是否一致;
(2) 计算序号1~3对应条件下的平衡转化率(α)(见下表),对比使用K与α表征反应限度的异同。
设计意图:其一,利用非基元反应论证K表征反应限度的普适性;其二,感受化学反应限度的表征方式不唯一。一个平衡常数可以对应多个平衡转化率,K的规律性更强,α的直观程度更高,因限度的表征方式不同为后续的调控作出指引。
3.3.2 课时2
[任务4]化学平衡常数K用于表征平衡时各组分浓度的关系,浓度商Q用于表征任意时刻各组分浓度的关系,请分析:
(1) K与Q之间具有怎样的关系?
(2) K与Q满足什么关系时,有利于化学反应正向进行?
(3) 根据Q的表达式,讨论减小Q的方式有哪些?
(4) 已知K是关于温度的函数,根据2NO2(g)N2O4(g)的温度实验,讨论通过改变温度增大K的规律是什么?
设计意图:建立利用Q≠K的关系调控反应方向与限度的视角,形成“调控浓度改变Q和调控温度改变K”的初级的整体性认识思路。
[任务5]以工业合成氨反应为例,定性分析通过改变Q实现Q<K平衡正向移动的方案。提示:从改变单一组分浓度和等比例改变各组分浓度的角度进行分析。
设计意图:任务5是任务4的具体应用,在开放性任务中,学生基于现实需求主动探索方案,并在任务6中加以验证,使其从传统任务的分析解释水平走向更高层次的评价创造水平。
[任务6]上述实现Q<K的方案中,达到新平衡时,定量计算并分析反应物平衡转化率的变化情况,判断平衡正向移动是否意味着反应物平衡转化率增大,见下表。
各组分的浓度设V=1L 充入2mol N2、 6mol H2设α=50%将体积减小为0.5L
设计意图:错把“方向等同于限度”是学生易产生的迷思概念,学生经过数据探究发现平衡正移后,α可能增大、减小或不变,有益于自主建构“方向不同于限度,平衡正移不代表反应限度会增加”这一核心认识,从而引出工业生产中对最佳投料关系的探讨。
[任务7]绘制合成氨工业中,调整氮气与氢气的投料比时二者的平衡转化率变化趋势如下图,请结合下图分析氮气与氢气的最佳投料比。
设计意图:方向与限度虽有矛盾,二者的平衡点在于现实意义的需求,也就是生产效益的最大化。任务7意在让学生感受到理论层面的矛盾会基于实际效益达成统一。
3.3.3 课时3
[任务8]信息资料:化学反应限度的热力学依据为范特霍夫平衡原理ΔGθ=-RTlnKθ。请根据该表达式分析影响化学反应限度的因素。
设计意图:范特霍夫平衡原理是化学平衡极为重要的热力学依据,在中学阶段以信息形式引入将有助于学生从本质上理解影响反应限度的因素问题。从ΔGθ=-RTlnKθ的关系式中可以看出影响反应限度K的因素是狀态函数ΔG与温度T,从而建立基于K的改变调控反应限度的分析思路。
[任务9]金属钛的生产原料TiCl4通常由TiO2制取,若由TiO2直接氯化,反应为:TiO2(s)+2Cl2(g)TiCl4(l)+O2(g),记为反应①。
(1) 根据表中数据计算该反应的ΔGθ以及Kθ,基于热力学视角说明该反应能否发生;
(2) 分析可能驱动反应①的方法;
(3) 计算2C(s)+O2(g)2CO(g)的ΔGθ以及Kθ,思考用该反应驱动反应①的方法。
设计意图:建立“基于影响K的因素——吉布斯函数调控化学反应限度”的思路,形成“可以用一个反应来驱动另一个反应,反应间的耦合可以改变反应限度”的认识。
[任务10]工业上以煤炭为原料,通入一定量的空气,经过系列反应可以得到满足不同需求的原料气,具体反应如下:
反应1:C(s)+O2(g)CO2(g)
ΔH1=-394kJ·mol-1
反应2:2CO(g)+O2(g)2CO2(g)
ΔH2=-566kJ·mol-1
反应3:2C(s)+O2(g)2CO(g)
ΔH3=-222kJ·mol-1
(1) 已知:利用ΔGθ=-RTlnKθ=ΔHθ-T·ΔSθ可以推导出lnK2K1=ΔHR1T1-1T2,根据该关系式分析:改变温度对反应限度的影响(已知:K1为T1温度下的反应限度,K2为T2温度下的反应限度);
(2) 结合制取原料气的三个反应,分析为获得以CO为主的原料气,应如何调控反应的温度和压强;
(3) 当利用控温调控反应限度出现矛盾时,如何抓住主要矛盾?请结合(1)中关系式分析。
设计意图:建立“基于影响K的因素——温度调控化学反应限度”的思路。分析lnK2K1=ΔHR1T1-1T2可知,“针对一个反应,改变温度可以调控反应限度”,“针对不同反应,改变温度对反应限度的影响程度不同”,|ΔH|越大,温度对反应限度的影响越大,要根据需要抓住主要矛盾。培养学生既能调控单一平衡,也能调控真实生产中的多重平衡,使学生由定性走向定量的高阶认识水平。
4 教学效果与反思
4.1 教学效果
为测查学习效果,笔者对学生进行后测检验。以工业生产中生产条件的选择和调控类陌生情境试题为例,测查学生能否基于K-Q关系在定量水平上解决真实问题;以陌生耦合反应的热效应判断为例,测查学生的定量推理能力。测试结果表明,82.2%学生能够想到以浓度商与平衡常数为分析工具并准确判断反应方向,66.7%学生能利用K判断单一反应和耦合反应的热效应;13.3%学生在具体定量关系中运算出现失误,20%学生解读图像和曲线时遇到障碍。可见,学生已经初步具备了定量思考意识与定量分析能力,不过对于复杂程度更高的定量问题解决能力仍需长期培养。
4.2 教学反思
以学科逻辑与化学史作为教学设计的依据,一个呈现“是什么”,一个破解“为什么”,将二者有机融合能更好地构建出顺应学生认知发展的学习逻辑。从必修到选择性必修,要求学生对化学反应限度的认识完成定性到定量的跨越。学生最初对计算存在一定的畏难情绪或思维障碍,通过三课时的学习,发展了定量思维,在后期学习等效平衡问题时,学生能自发地利用K证明等效平衡模型。然而,定量思维的培养不是一蹴而就的,后续的教学中仍需适宜地创造定量认知情境,进一步发展学生的定量思维。
参考文献:
[1]中华人民共和国教育部制定. 普通高中化学课程标准(2017年版2022年修订)[S]. 北京: 人民教育出版社, 2020: 30~31.
[2]杜尚荣, 李森. 中小学教材编写逻辑体系的反思与重构——兼论教材编写的教学逻辑体系[J]. 课程·教材·教法, 2014, 34(10): 34~39.
[3][6]彭小平, 徐宇峰. 基于化学史和数据探究的“化学平衡常数”教学研究[J]. 化学教育(中英文), 2018, 39(15): 20~24.
[4]《化学思想史》编写组. 化学思想史[M]. 长沙: 湖南教育出版社, 1986: 213~225.
[5]赵匡华. 化学通史[M]. 北京: 高等教育出版社, 1990: 260~269.
[7][11]宋天佑. 无机化学[M]. 北京: 高等教育出版社, 2019: 80.
[8][9][10]彭笑刚. 物理化学讲义[M]. 北京: 高等教育出版社, 2012: 193~195, 472~475.
[12]薛青峰. 核心素养视域下中学化学计算教学的再思考——以“定量类化学概念”的教学为例[J]. 化学教学, 2020, (2): 42~45.
[13]薛青峰. 在实验教学中促进学生定量观建构的实践与思考[J]. 化学教学, 2020, (9): 59~62.
