基于miR-665/DRAM1信号介导的自噬探讨补阳还五汤延缓血管衰老的作用
2024-05-16叶才博陈祥宇杜杰勇杨玉彬舒尊鹏张莉
叶才博,陈祥宇,杜杰勇,杨玉彬,舒尊鹏,张莉
(1. 广东药科大学附属第一医院,广东 广州 510080;2. 广东药科大学中药学院,广东 广州 510006;3.北京师范大学文理学院,广东 珠海 519085)
血管老化是指血管的结构和功能随着年龄增长而发生退行性改变的过程,是机体衰老的重要表现[1]。血管衰老能够增加心血管疾病(Cardiovascular diseases,CVD)发生的风险,严重影响我国老年人群的健康状况[2]。延缓血管衰老是降低CVD发生和发展的重要举措,目前仅热量限制具有明确的延缓衰老作用[3],因此,探寻延缓血管衰老的机制和有效措施已成为全社会研究的热点。
中医在抗衰老方面有着丰富经验,形成了独具特色的方法和理论体系。中医理论认为,生命的本质在于气血,人体生长壮老的过程都离不开气血的变化。“气虚血瘀”是人体衰老的本质之一[4],机体气虚无力行血致血行瘀滞,气血运行不畅,加速机体衰老,通过益气活血法可纠正气虚血瘀之证,发挥延缓衰老的作用[5-6]。补阳还五汤是益气活血的经典名方,能通过促进内皮祖细胞修复损伤血管内皮[7],清除自由基[8],改善免疫功能[9]等延缓衰老。研究发现,补阳还五汤及补阳还五汤苷类组分能够通过促进内皮祖细胞增殖、迁移及成管等途径发挥抗内皮祖细胞衰老的作用[10]。课题组前期研究发现补阳还五汤能通过上调去乙酰化酶(Sirtuin1,SIRT1)表达抑制衰老相关血管平滑肌细胞(Vascular smooth muscle cells,VSMCs)的迁移和侵袭[11],通过抑制基质金属蛋白酶Ⅱ(Matrix Metalloproteinase 2,MMP-2)延缓VSMCs衰老[12],然而其潜在作用机制暂未明了。
microRNAs(miRNAs)是目前研究较多的非编码RNAs,通过碱基配对与靶基因形成部分共价结合,减少靶基因翻译表达并降低其稳定性,即转录后调控,调节衰老相关关键分子通路中的基因和蛋白表达,最终影响衰老引起的各种CVD的发生与发展[13]。自噬可通过降解受损蛋白质和细胞器等参与衰老及衰老相关CVD的病理过程[14-15]。课题组前期miRNAs测序证实microRNA-665(miR-665)是年轻和衰老VSMCs中差异表达最显著的miRNA[16],能通过调节下游靶基因lncRNA GAS5/Syndecan 1延缓VSMCs衰老[16-17]。研究发现,miR-665与DNA损伤调节自噬调节因子1(DNA damage-regulated autophagy modulator1,DRAM1)存在结合位点[18],DRAM1能够通过p53/DRAM1途径诱导自噬溶酶体聚集,激活细胞自噬[19]。因此,miR-665可能通过靶向调节DRAM1调控自噬,进而调控衰老。
研究表明,雌激素对青壮年雌性大鼠VSMCs具有抗应激性衰老效应[20],雌激素缺乏能促进心肌细胞衰老[21]。因此,为了降低雌激素对自然衰老模型的影响,本研究采用自然衰老的雄性SD大鼠进行补阳还五汤干预,检测血管衰老、miR-665基因及自噬相关蛋白表达,探讨补阳还五汤延缓血管衰老的作用及自噬相关转录后调控机制,为寻找并干预衰老相关的miRNAs及其调节的特定靶基因提供新的思路。
1 材料
1.1 实验动物
6只4周龄和30只20月龄无特定病原体(Specifiled pathogen free,SPF)级雄性SD大鼠,购自广东省医学实验动物中心,生产许可证号:SCXK(粤)2018-0002,饲养环境:室温为20~26 ℃,相对湿度为40%~70%,12 h昼夜更替,自由进食和饮水。本研究经广东药科大学动物伦理委员会批准(伦理编号:GYFYGZR2017008),并且遵循实验动物保护法以及动物实验准则。
1.2 细胞与试剂
293T细胞(ATCC,美国);大鼠衰老相关β-半乳糖苷酶(Senescence associated β-galactosidase,SA-β-Gal)ELISA试剂盒(MM-71042R1,江苏酶免实业有限公司);大鼠晚期糖基化终产物(Advanced glycation end products,AGEs)ELISA试剂盒(MM-0776R1,江苏酶免实业有限公司);HE染液(G1005)、Masson三色染色液(G1006)和EVG染液(G1042)购自武汉赛维尔生物科技有限公司;BestarTMqPCR RT kit(2220)、BestarTMqPCR MasterMix(2043)购自DBI公司;双荧光素酶报告基因试剂盒(E1910,Promega);miR-665 mimic和miR-NC由广州锐博生物技术有限公司合成。抗体:DRAM1(GTX85483,美国Gene Tex公司);p16(WL01418,沈阳万类生物科技有限公司);LC3Ⅱ/Ⅰ(83506,美国CST公司);p62(GB111998,武汉赛维尔生物科技有限公司);Beclin1(PB9076,博士德生物科技有限公司);GAPDH(60004-1-Ig)和辣根过氧化物酶标记的山羊抗鼠/兔IgG(SA00001-1/SA00001-2)购自Proteintech公司。
1.3 补阳还五汤制备
补阳还五汤方剂为黄芪四两(120 g),当归尾二钱(6 g),赤芍一钱半(4.5 g),地龙一钱(3 g),川芎一钱(3 g),红花一钱(3 g),桃仁一钱(3 g),购自广东药科大学附属第一医院。生药按组分剂量配制混合,蒸馏水浸泡30 min,先后煎煮2次,取2次滤液合并,80 ℃水浴蒸发浓缩至每1 mL含原生药材2 g,4 ℃冰箱保存,用前充分摇匀并加热到室温。
2 方法
2.1 分组与给药
将6只4周龄SPF级雄性SD大鼠设为年轻组,将30只20月龄SPF级雄性SD大鼠随机分为5组:衰老组、补阳还五汤低剂量组、补阳还五汤中剂量组、补阳还五汤高剂量组和白藜芦醇组,每组6只。补阳还五汤低、中、高剂量组大鼠分别给予补阳还五汤9.25、18.5、37.0 g·kg-1灌胃(分别相当于成人用生药量的0.5、1、2倍),白藜芦醇组大鼠给予白藜芦醇80 mg·kg-1剂量腹腔注射,用于验证补阳还五汤延缓血管衰老的有效性。每日1次(补阳还五汤高剂量组大鼠分2次灌胃),连续给药14周。年轻组与衰老组大鼠灌胃等量的生理盐水。根据伦理要求对大鼠进行麻醉后,打开胸腔,选取主动脉弓以下长约2 cm的胸主动脉血管组织进行后续实验。
2.2 ELISA法检测血管SA-β-Gal活性和AGEs水平
根据ELISA试剂盒实验步骤进行操作,约1 g大鼠胸主动脉血管组织充分匀浆,2 000 r·min-1离心20 min后取上清液,用酶标仪在450 nm波长下测定吸光度,通过标准曲线计算样品中大鼠血管SA-β-Gal活性和AGEs水平。
2.3 血管组织HE、Masson和EVG染色
剪取主动脉弓以下约0.5 cm胸主动脉,8%中性福尔马林固定,常规石蜡包埋,切片厚度为4 μm。选取圆形或近似圆形的切片进行实验。HE染色:石蜡切片脱蜡至水,HE染液染色,中性树脂封片后显微镜下观察血管组织结构。Masson染色:石蜡切片脱蜡至水,Masson染液染色,1%醋酸漂洗分化,中性树脂封片后显微镜下观察血管组织胶原纤维沉积。EVG染色:石蜡切片脱蜡至水,EVG染液染色,三氯化铁进行背景分化,VG染液复染,中性树脂封片后显微镜下观察血管组织弹力纤维结构。
2.4 qPCR检测miR-665表达水平
根据说明书用TRIzol从大鼠胸主动脉血管组织中提取总RNA。紫外分光光度仪上测RNA浓度,以1 μg总RNA为模板,按照Bestar qPCR RT Kit说明书配制逆转录反应体系,总体系为10 μL,合成cDNA第一链。采用染料法(SYBR Green Ⅰ)在Agilent StrataGene Mx3000P qPCR仪中进行qPCR分析,U6用作内参。数据按照2-ΔΔCt方法处理。所有引物由引物设计软件3.0(Applied Biosystems)设计并由Invitrogen公司合成,序列见表1。

表1 引物序列Table 1 Primer sequences
2.5 透射电镜观察血管自噬小体
大鼠胸主动脉加入3%戊二醛固定4 h以上,PBS漂洗3次,每次10 min,4 ℃冰箱过夜。然后用1%锇酸固定2 h,PBS漂洗3次,每次10 min,4 ℃冰箱过夜。不同浓度乙醇依次梯度脱水,无水丙酮和环氧树脂渗透、包埋,烘箱内烘烤固化,超薄切片机切片,3%醋酸铀-枸橼酸铅双染色后进行透射电镜观察。
2.6 双荧光素酶报告
设计及合成包含miR-665结合位点的靶基因3′-UTR片段,将其插入至含荧光素报告基因的pmirGLO载体(Promega)中,构建成DRAM1报告质粒(野生型)。同时构建DRAM1突变型报告质粒。293T细胞转染前1天传代至96孔板,第2天细胞生长约50%~60%,用Lipofectamin 2000进行miR-665 mimic和DRAM1报告质粒联合转染。48 h后用双荧光酶素报告系统(Promege, Madison,WI)进行分析。
2.7 Western blot检测p16、LC3Ⅱ/Ⅰ、Beclin1、p62和DRAM1蛋白表达
用PBS冲洗胸主动脉,将血管移入匀浆器,加入含蛋白酶抑制剂的组织裂解液进行研磨,4 ℃条件下14 000 r·min-1离心10 min,取上清即组织总蛋白。15~30 μg组织蛋白样品,12%SDS-PAGE电泳,100 V转移1 h至硝酸纤维素薄膜,放入封闭液中37 ℃封闭1 h;一抗(p16 1∶500;Beclin1 1∶1 200;p62 1∶800;LC3Ⅱ/Ⅰ 1∶1 000;DRAM1 1∶1 000;GAPDH 1∶5 000)4 ℃过夜。反复洗膜后,用辣根过氧化物酶标记的山羊抗鼠/兔IgG(1∶5 000)室温孵育1 h,洗膜后,滴加ECL化学发光试剂,放入化学发光仪显影,用图像分析测定各条带灰度值作定量分析。
2.8 免疫组化法检测DRAM1蛋白表达
大鼠胸主动脉用4%多聚甲醛固定后常规脱蜡、梯度乙醇脱水、抗原修复及阻断内源性过氧化物酶。组织切片用3%BSA室温封闭30 min,加入DRAM1抗体(1∶400)孵育,4 ℃过夜。PBS漂洗3次后滴加生物素标记二抗,室温孵育50 min,PBS漂洗后滴加DAB显色液,室温孵育10 min。苏木素复染3 min,1%盐酸乙醇分化、氨水返蓝、脱水封片、拍照。
2.9 统计学分析
3 结果
3.1 补阳还五汤延缓血管衰老
SA-β-Gal的数量和大小随着细胞衰老不断累积,其活性与衰老程度紧密相关,为体内外鉴定细胞衰老的生物标志物[22]。AGEs是非酶糖基化反应的终产物,能直接反映衰老状态和体内糖基化水平,是检测衰老的重要指标[23]。p16的激活为细胞衰老发生的重要标志,为细胞衰老的关键效应物[24]。如图1所示,与年轻组相比,衰老组大鼠血管SA-β-Gal活性、AGEs水平和p16蛋白表达明显增加(P<0.01);与衰老组相比,不同剂量补阳还五汤和白藜芦醇干预均可使SA-β-Gal活性明显下降(P<0.01),AGEs水平和p16蛋白表达明显下调(P<0.05,P<0.01)。血管的组织形态也会随着衰老而改变。如图2所示,HE染色结果显示,年轻组大鼠血管内膜光滑,中膜细胞排列整齐,各层结构完整清楚,形态分布规则;与年轻组相比,衰老组大鼠血管组织排列紊乱,中膜明显增厚(P<0.01);与衰老组相比,不同剂量补阳还五汤组和白藜芦醇组大鼠血管组织排列相对整齐,中膜增厚程度明显减轻,以补阳还五汤中剂量、高剂量及白藜芦醇组具有统计学意义(P<0.05,P<0.01)。Masson染色结果显示,年轻组大鼠血管内膜结构平整,平滑肌细胞排列规则;与年轻组相比,衰老组大鼠血管平滑肌细胞增生并排列紊乱,胶原纤维明显增加(P<0.01);与衰老组相比,不同剂量补阳还五汤和白藜芦醇干预明显降低大鼠血管胶原纤维,以补阳还五汤中剂量、高剂量和白藜芦醇组具有统计学意义(P<0.05,P<0.01)。EVG染色结果显示,年轻组大鼠血管弹力纤维排列整齐有序;与年轻组相比,衰老组大鼠血管弹力纤维出现明显断裂和排列紊乱;与衰老组相比,不同剂量补阳还五汤和白藜芦醇干预能减少大鼠血管弹力纤维的断裂和紊乱。结果表明,补阳还五汤能够降低血管中SA-β-Gal活性、AGEs水平和p16蛋白表达,改善血管形态和弹力纤维结构,减少血管组织胶原纤维,有效延缓血管衰老。

注:与年轻组比较,**P<0.01;与衰老组比较,图1 各组大鼠血管组织SA-β-Gal活性、AGEs水平(n=5)和p16蛋白表达(n=3)Fig.1 SA-β-Gal activity, AGEs levels (n=5) and p16 protein expression (n=3) in vascular tissues of rats in each group
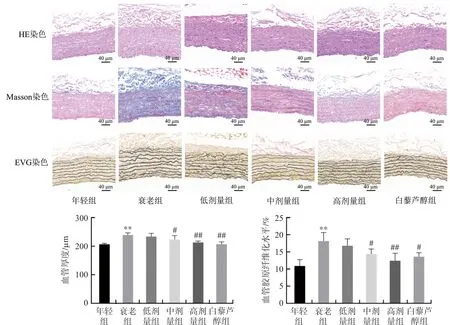
注:与年轻组比较,**P<0.01;与衰老组比较,图2 各组大鼠血管组织HE、Masson和EVG染色Fig.2 HE, Masson, and EVG staining in vascular tissues of rats in each group
3.2 补阳还五汤下调衰老血管中miR-665基因表达
课题组前期miRNA芯片检测发现miR-665是年轻和衰老VSMCs最差异表达的miRNA[16]。体内qPCR检测结果如图3所示,与年轻组相比,衰老组大鼠血管中miR-665表达明显上调(P<0.01);与衰老组相比,补阳还五汤呈剂量依赖性下调血管中miR-665的表达,以高剂量组具有统计学意义(P<0.01)。

注:与年轻组比较,**P<0.01;与衰老组比较,图3 各组大鼠血管组织miR-665表达Fig.3 Expression of miR-665 in vascular tissues of rats in each group
3.3 补阳还五汤增强衰老血管自噬水平
自噬在衰老进程中发挥重要的调节作用[25],LC3、Beclin1和p62参与了自噬发生的起始、延长、成熟和降解,是判断自噬过程的关键指标[26]。如图4所示,透射电镜结果显示,与年轻组相比,衰老组大鼠血管内自噬小体数量明显减少;与衰老组相比,补阳还五汤干预后血管内自噬小体数量增加,以高剂量组增加明显。Western blot结果显示,与年轻组相比,衰老组大鼠血管中LC3Ⅱ/Ⅰ和Beclin1蛋白表达水平明显下调(P<0.01),p62蛋白表达水平明显上调(P<0.01);与衰老组相比,不同剂量补阳还五汤明显上调Beclin1蛋白表达(P<0.05,P<0.01),中剂量和高剂量补阳还五汤显著上调LC3Ⅱ/Ⅰ蛋白表达(P<0.01),下调p62蛋白表达(P<0.01)。

注:红色箭头代表自噬小体。与年轻组比较,**P<0.01;与衰老组比较,图4 各组大鼠血管组织自噬小体数量及LC3、Beclin1、p62蛋白表达Fig.4 The number of autophagosomes and the protein expressions of LC3,Beclin1 and p62 in vascular tissues of rats in each group
3.4 miR-665靶向DRAM1基因并负调控DRAM1蛋白表达
miRNAs通过调节自噬相关蛋白/因子调控自噬通路是衰老相关调控的重要机制[27]。如图5所示,TargetScan预测miR-665与自噬相关基因DRAM1的3'-UTR存在结合位点。双荧光素酶基因报告发现,与293T细胞联合转染miR-NC和野生型DRAM1报告质粒组相比,联合转染miR-665 mimic和野生型DRAM1报告质粒组的荧光素酶活性显著降低(P<0.01);293T细胞联合转染miR-NC和突变型DRAM1报告质粒组与联合转染miR-665 mimic和突变型DRAM1报告质粒组相比,荧光素酶活性无显著差异。同时,293T细胞中分别转染miR-NC和miR-665 mimic,Western blot检测DRAM1蛋白表达水平,与miR-NC相比,miR-665 mimic可使DRAM1蛋白表达明显下调(P<0.05)。

注:与miR-NC比较,图5 miR-665对下游自噬相关蛋白DRAM1的影响Fig.5 Effect of miR-665 on the downstream autophagy-related protein DRAM1
3.5 补阳还五汤上调衰老血管DRAM1蛋白表达
为了观察补阳还五汤对miR-665下游自噬相关蛋白DRAM1表达的影响,如图6所示,免疫组织化学结果显示,与年轻组相比,衰老组大鼠血管中DRAM1蛋白表达明显降低(P<0.01);与衰老组相比,补阳还五汤干预呈剂量依赖性上调DRAM1蛋白表达水平,以高剂量组具有统计学意义(P<0.05)。Western blot分析结果与免疫组织化学结果一致,衰老能够降低大鼠血管中DRAM1蛋白表达(P<0.01),补阳还五汤干预上调衰老大鼠血管中DRAM1蛋白表达,以高剂量组具有统计学意义(P<0.05)。

注:与年轻组比较,**P<0.01;与衰老组比较,图6 各组大鼠血管组织DRAM1蛋白表达Fig.6 Expression of DRAM1 protein in vascular tissues of rats in each group
4 讨论
随着我国人口老龄化程度的不断加深,衰老引起的CVD逐年增加,干预血管衰老迫在眉睫。中医理论认为,人体的生长壮老反映气血盛衰的过程,气血失调、气虚血瘀是人体衰老的主要机制[28]。清代著名医家王清任总结发挥对气虚血瘀致衰的认识,首创益气活血法以及益气活血名方补阳还五汤,使后世医家通过益气活血法延缓衰老有理可循[5]。补阳还五汤重用黄芪补益元气助血行,当归尾活血而不伤血,桃仁、红花、赤芍、川芎活血祛瘀,地龙通经活络,全方重在补气以活血,通补兼施,祛瘀而不伤正。药理研究发现,黄芪-当归配伍[29]、羟基红花黄色素A[30]和川芎[31]可通过提高抗氧化能力延缓衰老。课题组前期研究证实补阳还五汤可抑制VSMCs的年龄相关迁移和侵袭[11],延缓VSMCs衰老[12]。本研究进一步证实补阳还五汤能够降低衰老大鼠血管中SA-β-Gal活性、AGEs水平和p16蛋白表达,改善血管形态和弹力纤维结构,减少血管组织胶原纤维,延缓血管衰老。
研究发现,心力衰竭患者血管内皮细胞中miR-665表达上调,破坏冠状动脉微血管生成,过表达miR-665能够增加血管内皮细胞凋亡[32];缺血再灌注小鼠心肌组织中miR-665表达上调,过表达miR-665能够诱导细胞凋亡及增加线粒体氧自由基水平[33]。课题组前期的体外研究证实,在衰老VSMCs中miR-665表达水平上调[16-17],本研究通过体内实验发现,衰老血管组织中miR-665表达水平同样出现上调,补阳还五汤干预能够降低衰老大鼠血管miR-665的表达,说明miR-665表达上调加速衰老进程,补阳还五汤能够逆转衰老引起的miR-665表达延缓血管衰老。
自噬是真核细胞在自噬相关基因的调控下,受损细胞器和大分子物质通过与溶酶体融合形成自噬小体,最终被及时清除的过程[34]。自噬发生时,Beclin1招募胞浆中的自噬相关的蛋白,与位于自噬胞膜表面的LC3相互作用,参与形成自噬小体[35]。p62是自噬过程中的一种降解产物,当p62被降解时表示自噬被激活[36]。衰老信号抑制细胞自噬,扰乱细胞内稳态,激活衰老相关通路,导致衰老的发生[37]。研究发现,心脏中的自噬水平随着年龄增长而降低,增强自噬能够延缓心肌细胞衰老[38];在小鼠和人类肌肉中,LC3Ⅱ/Ⅰ的表达会随着年龄的增长而下降[39]。本研究结果显示,衰老大鼠血管内自噬小体数量减少,LC3Ⅱ/Ⅰ和Beclin1蛋白表达明显下调,p62蛋白表达明显上调,说明血管衰老伴随着细胞自噬的受损。补阳还五汤具有调控自噬的作用,能促进缺血脑组织自噬发生[40-41]。本研究发现,补阳还五汤能够增加血管组织自噬小体数量,上调LC3Ⅱ/Ⅰ和Beclin1蛋白表达,下调p62蛋白表达,表明补阳还五汤能够通过增强细胞自噬延缓血管衰老。
miRNAs能够调节自噬相关基因或蛋白表达调控自噬通路[42-43]。研究发现,miR-665与自噬关系密切,抑制真菌性角膜炎中miR-665-3p的表达可增加ATG5蛋白表达,上调自噬并减轻炎症[44]。miR-665在肠缺血再灌注损伤小鼠肠道组织中表达增加,自噬流减少;靶向抑制miR-665能够下调ATG4B的表达,恢复自噬流,缓解炎症和减轻过度凋亡[45],说明miR-665的表达下调促进下游自噬相关蛋白表达,诱导自噬的发生。本研究利用生物信息学预测出miR-665靶定下游自噬相关因子DRAM1,同时采用双荧光素酶报告证实了miR-665与DRAM1能够直接靶定,过表达miR-665后发现DRAM1蛋白表达下调,表明miR-665靶向负调控DRAM1蛋白的表达。DRAM1能够增加溶酶体酸化,促使溶酶体与自噬小体融合以及溶酶体中p62的降解,增加自噬小体的清除,增强自噬[46];过表达DRAM1能够促进自噬小体的形成,增加细胞质中LC3的分布[47]。本研究结果发现,衰老组大鼠血管中DRAM1蛋白表达水平下调,补阳还五汤能够逆转衰老引起的DRAM1表达下调且呈剂量依赖性增加其表达。所有的结果表明,衰老能够上调miR-665表达,抑制DRAM1蛋白表达,减轻细胞自噬;补阳还五汤通过抑制血管miR-665表达促进DRAM1蛋白表达,增强细胞自噬,延缓血管衰老(图7)。

图7 补阳还五汤延缓血管衰老的可能机制Fig.7 Possible mechanism of Buyang Huanwu Decoction delaying vascular aging
综上所述,本研究采用雄性SD大鼠自然衰老模型,清楚揭示了补阳还五汤能够明显延缓血管衰老,这一过程伴随自噬水平的改善。补阳还五汤可能是通过靶向抑制miR-665促进DRAM1蛋白表达,改善血管自噬,达到延缓血管衰老的作用。目前,关于延缓血管衰老、降低衰老相关的CVD风险及潜在机制的研究已大量开展,本研究表明,补阳还五汤能够通过自噬相关的转录后调控发挥抗衰老作用,可能成为预防及治疗衰老相关CVD的药物。
