丁香酸调控胆汁酸代谢和肠道屏障改善胆汁淤积肝病的研究
2024-05-16罗欣成鹏陆茵韦忠红
罗欣,成鹏,陆茵,2,3,韦忠红,3
(1.南京中医药大学药学院,江苏省中药药效与安全性评价重点实验室,江苏 南京 210023;2.江苏省中医药防治肿瘤协同创新中心,江苏 南京 210023;3.江苏省中医药与再生医学研究国际合作联合实验室,江苏 南京 210023)
胆汁淤积是一种由肝内外各种原因(药物、病毒、肝内外胆管发育异常等)所致的胆汁形成、分泌和(或)排泄障碍,使胆汁不能正常代谢而淤积于肝胆系统的疾病,胆汁酸特别是具有肝细胞毒性的疏水性胆汁酸在肝脏的蓄积是胆汁淤积性肝损伤的重要机制[1-2]。胆汁酸的代谢过程中,约有95%的胆汁酸在肠道中被重吸收并通过门静脉系统进入肝脏,重新结合并分泌到胆汁中,实现肝肠循环[3]。故促进胆汁酸的排泄从而减少其重吸收是改善胆汁淤积所致肝损伤的重要策略。目前,熊去氧胆酸(Ursodesoxycholic acid, UDCA)已用于原发性胆汁性肝硬化的临床治疗。然而,仍然存在大量患者对UDCA治疗反应不佳,最终进展为肝硬化和肝衰竭[4-5]。因此,迫切需要开发更为有效治疗肝内胆汁淤积的药物。
丁香酸(Syringic acid, SA)是一种天然的酚类化合物,广泛分布于橄榄、香料、葡萄、谷物及大青叶、石斛、马兰等中草药中[6-7]。已有大量研究表明,SA具有抗氧化、抗微生物、抗炎、抗癌和保护心脏、肝脏等多种药理作用[8-11]。现有研究表明,在四氯化碳诱导的慢性肝损伤小鼠模型[12]中,静脉注射SA可以显著降低天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)活性和炎性细胞因子水平,改善肝脏纤维化。在结肠炎小鼠模型[8]中,SA通过调节肠道微生物组成从而保护肠黏膜屏障。然而,目前关于SA对肝内胆汁淤积疾病的调节作用及机制方面的研究较缺乏,本研究从SA对α-萘异硫氰酸酯(Alpha-nephthyl isothiocyanate, ANIT)诱导的胆汁淤积小鼠肝脏损伤的保护作用方面入手,基于胆汁酸代谢和肠道屏障功能探讨其作用机制,为胆汁淤积肝损伤治疗提供潜在药物。
1 材料
1.1 动物
6周龄SPF级雄性C57BL/6J小鼠20只,体质量(20±2)g,购自上海斯莱克实验动物有限责任公司,实验动物生产许可证:SCXK(沪)2017-0005,实验过程中所有操作均符合南京中医药大学实验动物伦理委员会规定,动物伦理号:202303A068。常规饲养:自由饮食饮水,温度(23±2) ℃,相对湿度(53±2)%,12 h黑暗光照周期,适应性饲养1周。
1.2 药物与试剂
丁香酸购自上海源叶生物科技有限公司(货号:530-57-4);ANIT购自Sigma-Aldrich(货号:N4525-10g);橄榄油购自上海阿拉丁生化科技股份有限公司(货号:O108686-500mL);AST试剂盒(货号:C010-2-1)、ALT试剂盒(货号:C009-2-1)、ALP试剂盒(货号:A059-2-2)、总胆红素(TBIL)试剂盒(货号:C019-1-1)、间接胆红素(DBIL)试剂盒(货号:C019-2-1)购自南京建成生物工程研究所;HE染色液购自雷根生物科技有限公司(货号:DH0006);小鼠总胆汁酸检测试剂盒购自Crystal Chem(批号:#80470);Hiscript RT Super Mix for qPCR(货号:R323-01)与ChamQ SYBR qPCR Master Mix(货号:Q331-02)购自诺唯赞生物技术有限公司。
1.3 仪器
Mantra 1.0.1型组织切片成像系统(PE公司);1510型全波长酶标仪(Thermo Fisher公司);AllegraX-30R型高速冷冻离心机(BECKMAN COULTER公司);BSA224S-CW分析天平(Sartorius公司);ABI-7500荧光定量PCR仪(Applied Biosystems life公司);HF-X质谱仪(Thermo QE公司)。
2 方法
2.1 动物分组、造模及给药
20只小鼠适应性喂养1周后,随机分为对照组,模型组,丁香酸低、高剂量(70、140 mg·kg-1)组,每组5只。连续灌胃给药7 d。对照组和模型组灌胃相应体积的生理盐水。第5天灌胃给药2 h后,除对照组给予空白橄榄油外,其余各组动物均腹腔注射62.5 mg·kg-1ANIT的橄榄油进行造模,记录小鼠的体质量变化。
2.2 脏器指数计算
分析天平称量记录小鼠肝质量,根据公式对每只小鼠脏器指数进行计算。脏器指数=肝质量/体质量×100%。
2.3 肝功能指标及胆汁酸含量检测
按照试剂盒说明书检测小鼠血清中ALT、AST、ALP活性,DBIL、TBIL水平及肝脏和粪便中的胆汁酸含量。
2.4 HE染色观察组织病理变化
小鼠组织用4%多聚甲醛固定后,乙醇梯度脱水、二甲苯透明、石蜡包埋后切成4 μm切片。随后,脱蜡切片水洗后进行HE染色,显微镜下观察各组组织病理变化。
机制创新的原点意义可以体现在方方面面,例如,基于市场自发秩序,在中国这样的大国内部,不同地区之间资源禀赋和发展水平差异巨大,各地间完全可以通过合作,形成相互产业配套,实现最优产出水平。
2.5 LC-MS/MS非靶向代谢组学分析
2.5.1 代谢物提取 吸取每例样品100 μL,加入400 μL甲醇(-40 ℃预冷),涡旋10 min(4 ℃,2 000 r·min-1),离心5 min(12 000 r·min-1,4 ℃),取上清300 μL,真空浓缩至干。加入100 μL甲醇水溶液(甲醇∶水=1∶4,v/v)复溶,涡旋3 min(4 ℃,2 000 r·min-1),离心5 min(12 000 r·min-1,4 ℃),取上清进行进样分析。
2.5.2 色谱分离 整个分析过程中样品置于8 ℃自动进样器中,使用HSS T3色谱柱进行分离。其中进样量5 μL,柱温40 ℃,流速0.25 mL·min-1;色谱流动相A:5 mmol·L-1甲酸铵水,B:乙腈;C:0.1%甲酸水,D:0.1%甲酸乙腈;色谱梯度洗脱程序如下。①负离子:0~1 min,2%B;1~9 min,2%→50%B;9~12 min,50%→98%B;12~13.5 min,98%B;13.5~14 min,98%→2%B;14~17 min,2%B。②正离子:0~1 min,2%D;1~9 min,2%→50%D;9~12 min,50%→98%D;12~13.5 min,98%D;13.5~14 min,98%→2%D;14~17 min,2%D。样本队列中插入QC样品,用于监测和评价系统的稳定性及实验数据的可靠性。
2.5.3 质谱采集 每例样品分别采用电喷雾电离(ESI)进行正离子和负离子模式检测。质谱条件:电离源:ESI离子源;鞘气流速:30;辅助气:10;喷雾电压:2.5 kV(+)/2.5 kV(-); S-Lens RF:50;毛细管温度:325 ℃;辅助气温度:300 ℃;二级碰撞能量(NCE):30;隔离窗口m/z1.5,Top N=8。扫描范围:m/z70~1 050,扫描方式:正、负离子分别扫描。
2.5.4 代谢物鉴定 原始数据经Compound Discovery程序进行峰对齐、保留时间校正和提取峰面积。代谢物结构鉴定使用Compound Discovery程序经精确质量数匹配(<10×10-6)和二级谱图匹配的方式,检索HMDB、KEGG、METLIN等数据库注释物质。
2.6 qPCR检测结肠紧密连接蛋白表达
称取80 mg结肠组织加入研磨管,加1 mL TRIzol裂解至组织消失。取匀浆每管加入200 μL氯仿,剧烈振摇15 s,室温静置3 min,12 000 r·min-1,4 ℃,离心15 min。吸取上层水相加入等量异丙醇,来回颠倒,室温静置3 min,12 000 r·min-1,4 ℃,离心15 min。弃上清,1 mL 75%乙醇洗涤,7 500 r·min-1,4 ℃离心10 min。弃上清,置于通风橱内干燥至透明。加入30 μL DEPC水溶解RNA,55 ℃孵育10 min。Nano DropTMOne/One C检测RNA浓度及纯度,将样本稀释为500 g·L-1。按试剂盒说明逆转成cDNA,引物由生工生物工程(上海)股份有限公司合成,引物序列见表1,点板,上机。
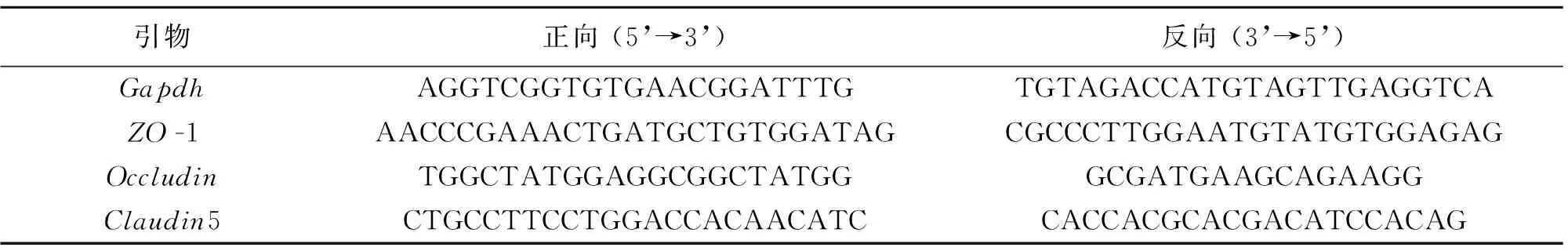
表1 引物序列Table 1 Primer sequence
2.7 统计学分析
3 结果
3.1 丁香酸对胆汁淤积小鼠肝脏指数的影响
如表2所示,与对照组相比,模型组小鼠肝脏指数显著升高(P<0.01)。与模型组比较,SA低剂量和高剂量组肝脏指数显著降低(P<0.01),提示丁香酸缓解了ANIT小鼠肝脏的水肿情况。
表2 丁香酸对ANIT小鼠肝脏指数的影响Table 2 Effect of syringic acid on liver index
3.2 丁香酸对胆汁淤积小鼠肝功能的影响
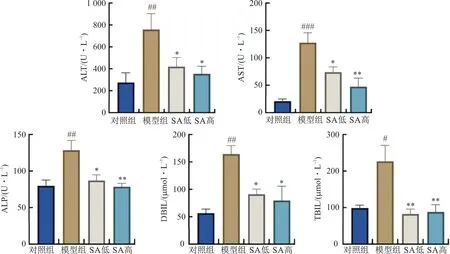
注:与对照组比较,#P<0.05,##P<0.01,###P<0.001;与模型组比较,图1 丁香酸对ANIT小鼠肝功能的影响Fig.1 Effect of syringic acid on liver function in ANIT mice
3.3 丁香酸对胆汁淤积小鼠肝脏组织病理学的影响
如图2所示,对照组肝组织结构正常,肝细胞排列整齐,肝细胞间肝窦明显清晰,无明显组织病理学损伤。模型组小鼠肝组织明显多处肝细胞肿胀、局灶性坏死,汇管区及肝窦伴大量炎性细胞浸润。与模型组相比,丁香酸组小鼠肝细胞排列较为紧密,形态较为正常,未见明显坏死区域,汇管区炎性细胞浸润及小叶间胆管破坏明显减弱,表明丁香酸可有效改善ANIT小鼠的肝脏损伤。

注:箭头指向炎性浸润。标尺=100 μm。图2 丁香酸对ANIT小鼠肝脏组织病理学的影响Fig.2 Effect of syringic acid on pathological changes of liver tissue in ANIT mice
3.4 丁香酸对胆汁淤积小鼠结肠组织病理学的影响
如图3所示,与对照组相比,模型组出现明显淋巴细胞浸润,隐窝形态异常且数量减少;与模型组相比,丁香酸组淋巴细胞浸润减少,隐窝结构趋于正常,杯状细胞数量增加。
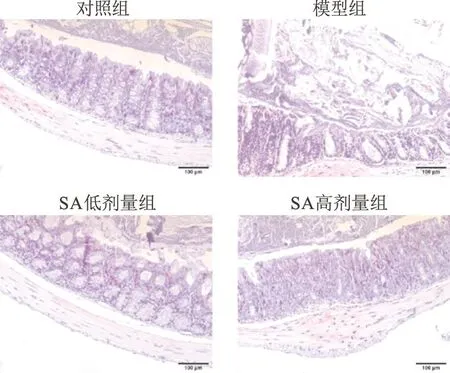
图3 丁香酸对ANIT小鼠结肠组织病理学的影响(标尺=100 μm)Fig.3 Effect of syringic acid on pathological changes of colon tissue in ANIT mice(Scale bar=100 μm)
3.5 丁香酸对胆汁淤积小鼠结肠紧密连接蛋白mRNA表达的影响
如图4所示,与对照组相比,模型组小鼠结肠中ZO-1、Occludin、Claudin-5的mRNA表达水平降低(P<0.05);与模型组相比,SA低剂量组结肠中Claudin-5的表达显著升高(P<0.05),SA高剂量组结肠中ZO-1、Occludin、Claudin-5的表达显著升高(P<0.05)。表明ANIT小鼠的肠道上皮细胞紧密连接损伤,而丁香酸可以改善这种肠道机械屏障的损伤。
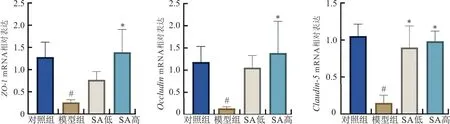
注:与对照组比较,#P<0.05;与模型组比较,图4 丁香酸对ANIT小鼠结肠紧密连接蛋白表达的影响Fig.4 Effect of syringic acid on colonic tight junction protein expression in ANIT mice
3.6 丁香酸对小鼠血清代谢物的影响
3.6.1 代谢组学实验结果稳定性分析 模型组与SA高剂量组小鼠血清样本代谢产物PLS-DA得分如图5所示,2组的代谢产物存在明显分离,表明其代谢产物间存在显著差异。其中模型组与SA高剂量组正离子模式下参数模型(对Y变量数据集)可解释度(R2Y)和模型可预测度(Q2)分别为0.993和0.675,负离子模式下R2Y和Q2分别为0.983和0.735,正、负离子模式数据建立的PLS-DA模型未发生过拟合,表明模型有较好的稳定性和可靠性。
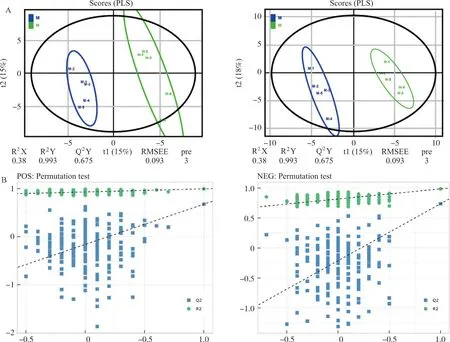
正离子模式 负离子模式图5 模型组和丁香酸高剂量给药组PLS-DA图(A)及置换检验图(B)Fig.5 PLS-DA plots (A) and permutation plots (B) in model group and syringic acid high-dose dosing group
3.6.2 丁香酸给药组调控的代谢物筛选 为了进一步分析丁香酸治疗胆汁淤积小鼠调控的代谢物,根据差异倍数FC>2或FC<0.5且P<0.05的筛选标准,血清中变化的代谢产物用火山图、表格进行展示。结果表明,共筛选到40种显著变化的代谢产物,其中上调代谢物11种,下调代谢物29种,包括脂质和类脂分子、类苯类化合物和有机氮化合物等。火山图中红色代表上调的代谢物,蓝色代表下调的代谢物。其中差异倍数变化最大(|log2FC|≥5)的代谢产物包括胆汁酸、棕榈酰肉碱、3-乙酰苯酚和壬酸香草酰胺。详见表3,图6。
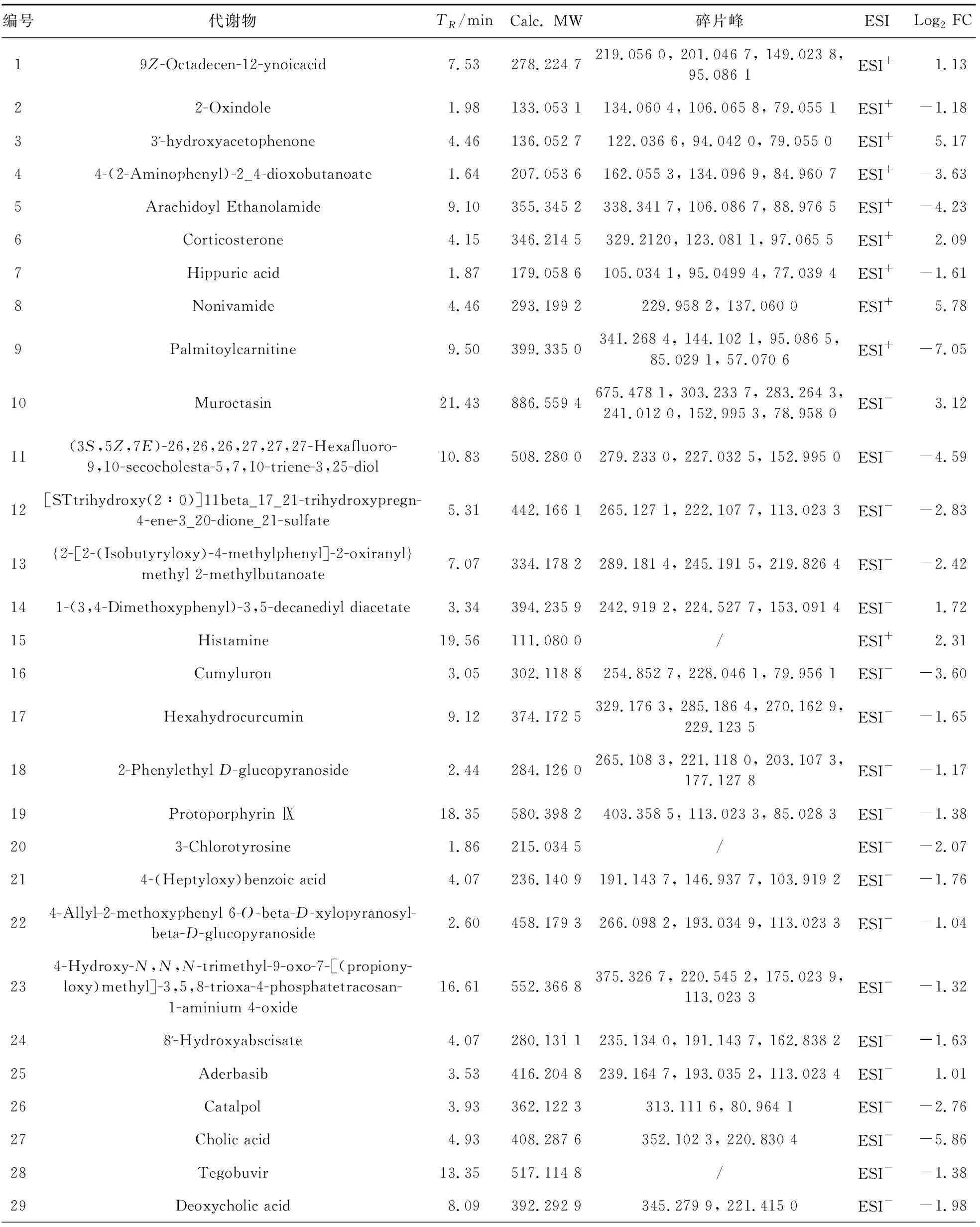
表3 SA高剂量组调控的血清代谢物Table 3 Serum metabolites regulated by the SA high dose group
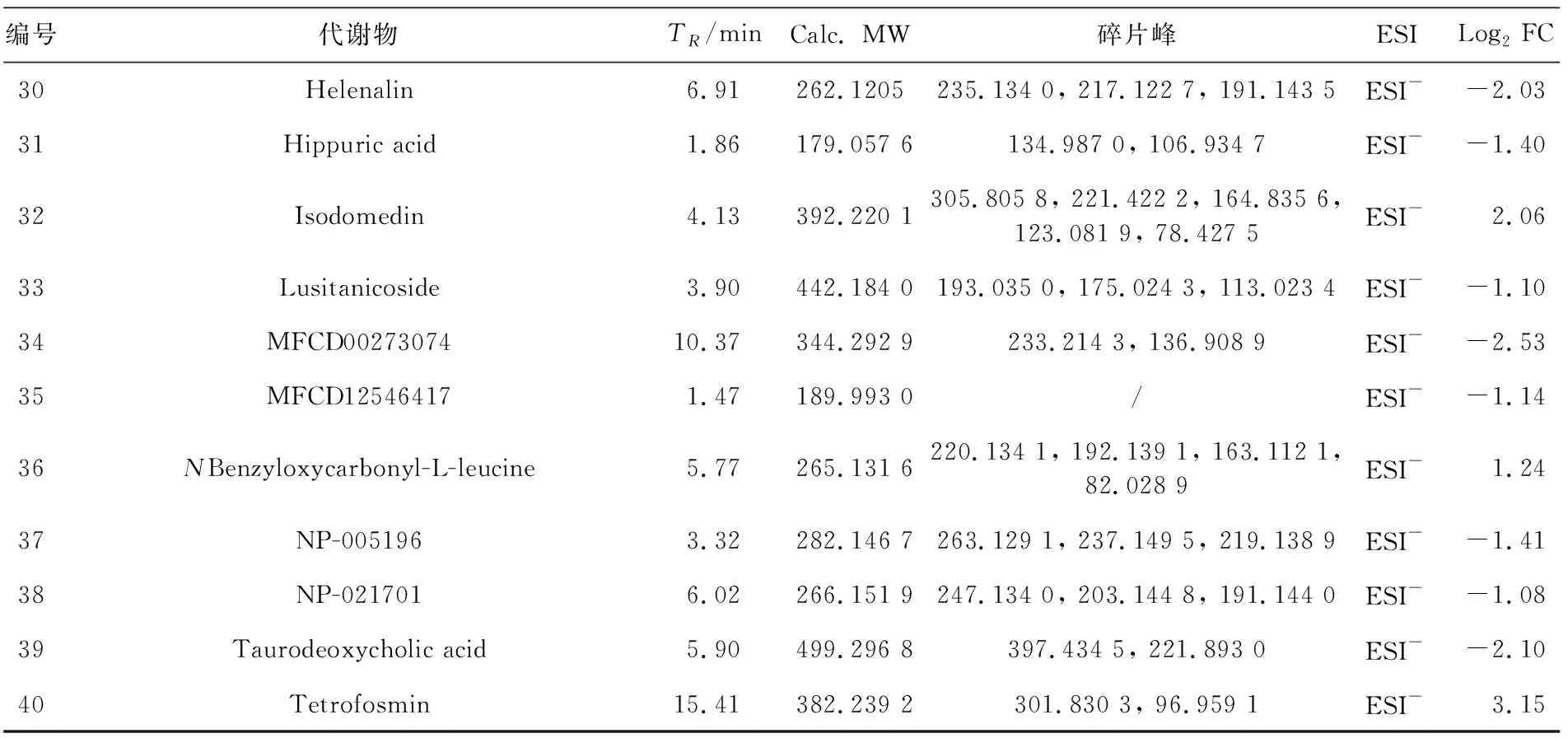
(续表)
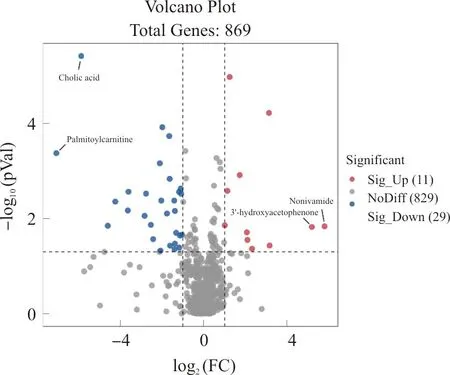
图6 小鼠血清代谢产物火山图Fig.6 The volcano map of metabolites in mice serum
3.6.3 代谢产物通路富集分析 如图7所示,对模型组与SA高剂量组之间的不同代谢产物进行KEGG通路富集分析,主要富集的通路包括代谢通路、次生代谢物的生物合成、次级胆汁酸生物合成、胆汁分泌和脂肪酸代谢,表明丁香酸可能通过促进胆汁酸代谢缓解胆汁淤积性肝损伤疾病的进展。

图7 小鼠血清代谢产物KEGG通路富集分析Fig.7 The KEGG pathway of metabolites in mice serum
3.7 丁香酸对胆汁淤积小鼠肝脏中总胆汁酸含量的影响
如图8所示,与对照组相比,模型组小鼠肝脏中总胆汁酸含量显著升高(P<0.001);与模型组相比,丁香酸组小鼠肝脏中总胆汁酸含量下降显著(P<0.001),表明丁香酸能减少肝脏胆汁酸的堆积。
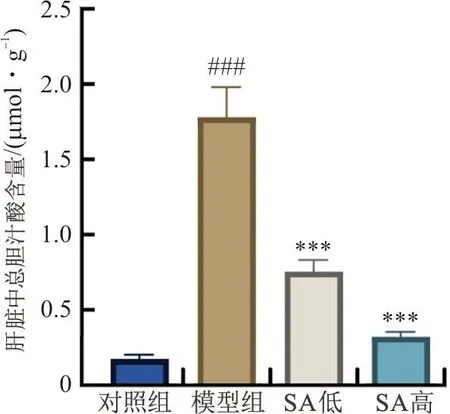
注:与对照组比较,###P<0.001;与模型组比较,图8 丁香酸对ANIT小鼠肝脏中总胆汁酸含量的影响Fig.8 Effect of syringic acid on total bile acid concentration in liver in ANIT mice
3.8 丁香酸对胆汁淤积小鼠粪便中总胆汁酸含量的影响
如图9所示,与模型组相比,丁香酸组小鼠粪便中总胆汁酸含量显著升高(P<0.05,P<0.01),提示丁香酸能促进ANIT小鼠的胆汁酸排泄从而改善其胆汁淤积性肝损伤。
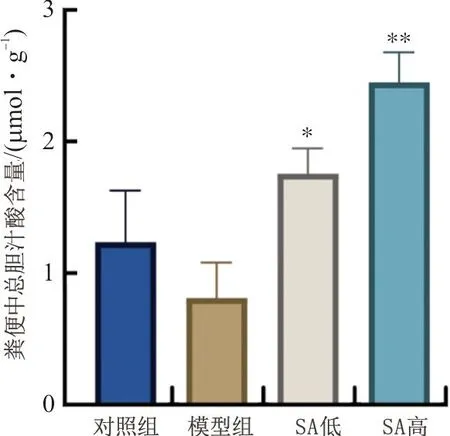
注:与模型组比较,图9 丁香酸对ANIT小鼠粪便中总胆汁酸含量的影响Fig.9 Effect of syringic acid on total bile acid concentration in feces in ANIT mice
4 讨论
胆汁淤积性肝病是指胆汁肝肠循环受阻与有毒性胆酸盐积聚引起肝毒性的一类疾病,最常用的化学造模药物是ANIT[13]。ANIT可通过破坏胆管上皮细胞导致胆汁引流阻塞,也会使肝小叶间胆管周围产生炎症反应及胆管增生、阻塞,使肝细胞及胆管上皮细胞变性、坏死,引起高胆红素血症[14]。本研究利用腹腔注射ANIT造小鼠肝内胆汁淤积模型,避免了ANIT对胃肠道的直接损伤,且不会影响口服药物的吸收[15]。
胆汁淤积常见的检测指标包括反应肝细胞损伤的ALT与AST,黄疸诊断指标ALP、TBIL与DBIL[16-17]。故本研究对各组小鼠血清ALT、AST、ALP活性及TBIL、DBIL水平进行检测,并结合肝脏病理组织的观察。结果表明,丁香酸给药可显著降低ANIT小鼠血清中ALT、AST、ALP活性和TBIL、DBIL水平,减轻肝细胞局灶性坏死及炎性细胞浸润情况,表明丁香酸可有效改善胆汁淤积小鼠胆道阻塞,减轻胆汁淤积小鼠肝细胞损伤。
肠道屏障作为肠-肝相互作用的解剖和功能基础,是抵御病原微生物的重要防线,在维持胆汁酸平衡中发挥重要作用。肠黏膜屏障损伤将促进毒性微生物或抗原内容物转运进入肝脏,引发肝脏炎症及损伤。胆汁酸具有调节肝脏代谢、塑造肠道菌群和维持肠道完整性的重要信号功能。胆汁酸信号是维持黏液层,紧密连接和肠道-血管屏障完整性的关键[18]。此前的研究也发现,在肝硬化大鼠中,胆汁酸以及FXR激动剂可改善肠道屏障功能障碍和减少细菌易位[19-20]。而肠道上皮和内皮细胞的物理和生物学功能,对于维持肠道屏障至关重要,紧密连接蛋白包括Claudin、Occludin、ZO-1等共同控制着上皮细胞的转运过程和黏膜屏障的通透性[21]。近期一项研究表明,胆汁酸受体TGR5通过影响JAM-A表达和磷酸化,加强了胆道上皮屏障功能,从而改善胆汁淤积小鼠的肝损伤[22]。因此,本研究进一步探讨了丁香酸对于肠道屏障的影响。首先,我们对结肠组织进行HE染色整体评价结肠损伤情况。结果发现,相比于对照组,模型组小鼠结肠组织存在明显病理损伤,丁香酸治疗可以明显改善ANIT小鼠的结肠损伤状况。此外,qPCR验证了丁香酸可以促进ANIT小鼠结肠组织中紧密连接蛋白ZO-1、Occludin、Claudin-5 mRNA的表达,表明丁香酸可以改善胆汁淤积小鼠的结肠上皮屏障损伤,这可能是丁香酸治疗胆汁淤积小鼠的重要机制之一。
95%的胆汁酸通过肝肠循环维持胆汁酸池的稳态,其余的5%在肠道微生物作用下生成次级胆汁酸,并通过门脉循环重新吸收或排泄在粪便中[23]。因此,我们采用非靶向代谢组学对胆汁淤积小鼠内源性代谢物进行系统全面的分析,试图找出丁香酸干预后调控的代谢物。结果发现,模型组和丁香酸高剂量组之间存在40个不同的代谢产物,其中包括11个上调和29个下调代谢物,并且脂质分子胆汁酸和棕榈酰肉碱在其中下调最为显著,KEGG通路主要富集到次生代谢物的生物合成、次级胆汁酸生物合成及胆汁分泌通路,表明丁香酸可能是通过促进胆汁酸的代谢从而改善胆汁淤积疾病。接着,我们进一步测定了小鼠肝脏和粪便中的总胆汁酸含量,结果发现丁香酸治疗后ANIT小鼠肝脏中的胆汁酸含量显著降低,而粪便中胆汁酸含量增加,表明丁香酸促进了胆汁淤积小鼠的胆汁酸排泄。
综上,本研究通过建立ANIT诱导的胆汁淤积小鼠模型,发现丁香酸对胆汁淤积性肝损伤具有一定保护作用,其作用机制可能是通过改善肠上皮屏障和促进胆汁酸的代谢改善小鼠的肝脏损伤。
