白术内酯Ⅲ调控ASCT2介导的线粒体-溶酶体互作诱导肝星状细胞衰老的抗肝纤维化机制研究
2024-05-16符秋雨王飞虾张峰郑仕中付金柏
符秋雨,王飞虾,张峰,郑仕中,付金柏
(1.南京中医药大学药学院,江苏 南京 210023;2.江苏省中医院药学部,江苏 南京 210029)
肝纤维化是病毒性肝炎、酒精或非酒精性肝病、免疫性肝病、药物性肝病等的共同病理过程,其终末阶段将发展为肝硬化、肝衰竭或肝细胞癌[1-2],严重威胁人类的健康与生命,然而临床一直缺乏有效治疗药物。深入探究肝纤维化的发病机制具有重要意义[3]。在肝损伤期间,静息的肝星状细胞(Hepatic stellate cell,HSC)激活并转化为肌成纤维细胞后,促进细胞增殖、合成并分泌大量的细胞外基质(Extracellular matrix,ECM),过量的ECM导致肝纤维化[4]。现有的研究表明,抑制HSC活化增殖和诱导其凋亡是治疗肝纤维化的有效途径[5]。此外,在实验性纤维化逆转过程中观察到衰老的HSC胶原蛋白生成和增殖减少[6]。因此,诱导HSC衰老为肝纤维化的防治提供了新的方向[7]。
肝脏作为重要代谢器官,对机体必需的多种物质与能量代谢过程有特异性调节作用,这也深刻影响肝脏病理变化[8]。从代谢调控的角度研究肝纤维化发病机制,有望获得特异性强的药物靶标,从而推动安全高效抗肝纤维化药物的研发。HSC活化是一个高度依赖物质与能量代谢的过程。有研究表明,静息的HSC和活化的HSC之间的代谢基因具有显著性差异,其中蛋白质代谢是HSC活化时的主要能量来源[9]。丙氨酸-丝氨酸-半胱氨酸转运载体2(Alanine-serine-cysteine transporter 2, ASCT2)作为谷氨酰胺主要转运载体,具有谷氨酰胺转运功能,是极具潜力的肝纤维化治疗靶标[10]。中药及其提取物等具有成分复杂多样、功能广泛、毒性低的独特优势,在抗纤维化治疗方面具有巨大的潜力[11]。白术内酯Ⅲ是在中药白术中发现的主要生物活性成分,已被证明具有抗氧化、抗肿瘤、抗过敏反应、抗菌作用[12]。但目前在临床上还缺乏白术内酯Ⅲ具有抗肝纤维化作用的研究,因此,我们需要进行大量的临床前实验证明白术内酯Ⅲ的抗肝纤维化作用以及机制。近期的研究发现白术内酯Ⅲ具有抗肠纤维化和肾纤维化的作用[13-14]。此外,我们课题组前期发现白术内酯Ⅲ是ASTC2的天然抑制剂,且通过抑制ASCT2发挥抗肝纤维化的作用[15],但白术内酯Ⅲ通过抑制ASCT2促进HSC衰老的机制仍需进一步研究。因此,我们拟研究白术内酯Ⅲ对ASCT2依赖性谷氨酰胺代谢诱导HSC衰老抗肝纤维化的作用机制。
1 材料
1.1 细胞株
人肝星状细胞株LX2购自中国科学院细胞库。
1.2 动物实验
SPF级雄性ICR小鼠(18~20 g)25只, 购买于杭州医学院,生产许可证号:SCXK(浙)2019-0002。动物饲养于南京中医药大学实验动物中心,饲养环境控制为12 h的明暗循环,温度为22 ℃,湿度为40%~60%。本实验已通过南京中医药大学实验动物伦理委员会批准(伦理批号:202009A043)。
1.3 实验药物和试剂
药物:白术内酯Ⅲ(MedChemExPress,HY-N0203)。
试剂:玉米油(金龙鱼);CCl4(上海麦克林,C805325);鱼藤酮(MedChemExPress,HY-B1756);氯喹(Chloroquine,CQ,MedChemExPress,HY-17589A);MitoTracker-RedCMXRos(ThermoFisher, M7152);双荧光mRFP-eGFP-LC3(上海汉恒);JC-1试剂盒(上海碧云天,C2006);MDA(上海贝博,BB4709)、SOD(上海贝博,BB4711)、ROS(上海碧云天,S0033)试剂盒;EdU试剂盒(上海碧云天,C0071S);β-半乳糖苷酶(β-Gal)染色试剂盒(上海碧云天,C0602);Proteostat®Aggresome detection试剂盒(AmyJet Scientific,ENZ-51035-0025)。
抗体:β-actin(武汉爱博泰克,AC026);Goat anti-rabbit-IgG-HRP(武汉三鹰,10285-1-AP);α-SMA(武汉三鹰,14395-1-AP);LC3(武汉爱博泰克,A5618);CDKN2A/P16 INK4a(武汉爱博泰克,A23882);CDKN1A/P21(武汉爱博泰克,A19094);ASCT2 siRNA(江苏凯基);LAMP1-RFP Plasmid (上海柯雷)。
1.4 实验仪器
电泳仪(Bio-RAD,PP-1151);酶标仪(BioTek,Synergy2);凝胶曝光仪(Protein Simple,721BR027843);脱色摇床(Servicebio,TSY-A);离心机(Thermo,PIC017);电子天平(Sartorius,BSA224S-CW);倒置显微镜(Leica,DMIL);流式细胞仪 (Beckman Coulter,CytoFLEX);激光共聚焦显微镜(ZEISS,Airyscan 2)。
2 方法
2.1 小鼠肝纤维化模型的建立、分组及给药方式
30只小鼠被随机分为5组:空白组,模型组,低、中、高剂量组,每组6只。除空白组外,小鼠按5 mL·Kg-1腹腔注射含10% CCl4玉米油溶液,每周3次,连续8周,建立肝纤维化模型。从第 4 周开始,低、中、高剂量组分别腹腔注射20、30、40 mg·kg-1白术内酯Ⅲ。给药4周实验结束后异氟烷吸入麻醉小鼠,眼眶取血,随后脱颈处死并取完整肝脏,将肝脏分为两部分:第一部分用甲醛固定,第二部分在-80 ℃冷冻保存过夜。
2.2 组织病理学检测
通过对肝组织样本依次进行石蜡包埋、切片、固定,接着在一系列分级的乙醇溶液中进行脱水处理。观察肝组织结构及胶原沉积使用了HE、Masson、Sirius Red染色方法。最后使用倒置显微镜观察和拍照。
酒店后场管理人员区域的温度舒适性没有前场要求高,从成本的角度考虑,可以采用非联网型温控面板,直接在本地控制即可满足要求,若某些酒管需要远程控制,可以采用非联网型温控面板+BA楼控集中控制。
2.3 免疫组化
通过石蜡包埋肝组织样本,然后按 4 μm 厚度对组织进行切片。肝脏被快速固定在4%多聚甲醛中,然后依次进行脱蜡脱水、柠檬酸抗原修复、PBS洗涤、3%双氧水缓冲液阻断内源性过氧化物酶、3%BSA 封闭、加一抗(α-SMA)4 ℃孵育过夜、加二抗孵育 60 min、DAB 显色、苏木素复染、干燥脱水、封片处理,最后使用倒置显微镜观察和拍照。
2.4 细胞培养及转染实验
LX2培养在含10%FBS的DMEM培养基中,加入1%青霉素-链霉素抗生素,于37 ℃、5%CO2的无菌培养箱中培养。从白术内酯Ⅲ母液中按照所需浓度(40 μmol·L-1)取一定的体积,随后加入到培养基中,混匀后继续放至细胞培养箱中培养 24 h。同时,按照HiFectPlus 细胞转染试剂说明书(南京艾科轶生物,HiFectPlus-H-001)将LX2转染ASCT2 siRNA,按培养基∶增强稀释液∶转染试剂:siRNA=1 000∶100∶2∶1的体积配制转染体系,混合均匀后室温静置 30 min。随后加入到另一个培养基中,混匀后继续放至细胞培养箱中培养 24 h。
2.5 自噬流水平检测
LX2转染mRFP-eGFP-LC3,24 h后PBS洗涤3次。加入多聚甲醛固定15 min后,PBS洗涤3次。加入DAPI染色液染2 min,PBS洗涤3次。用抗淬灭剂封片。最后通过激光共聚焦显微镜观察和拍照。
2.6 MTT实验检测细胞活力
体外培养LX2细胞,细胞密度分布至90%左右时,消化收集细胞,加入完全培养基重悬,吸取200 μL细胞悬液加入到96孔板,每组设置6个复孔,提前配好药物或试剂,待细胞贴壁后加入到96孔板中,作用24 h后,加入20 μL现配的MTT溶液(PBS配制,浓度为5 mg·mL-1),在培养箱中培养4 h。孵育结束后,弃去上清,每孔加入150 μL DMSO,避光孵育10 min,酶标仪波长设置为490 nm,检测每个孔的吸光度。
2.7 Western blot检测
将500 μL的细胞裂解液(PMSF∶磷酸酶抑制∶RIPA=1∶1∶100)加入500 mg的肝组织样本或者大皿中,进行研磨或者吹打,然后冰上裂解1 h,将裂解好的组织或者细胞放入管中,4 ℃下离心15 min,吸取上清、测浓度。在蛋白质裂解物中加入相应比例的Loading Buffer,在沸水浴中煮沸15 min。先制12%的凝胶,电泳分离蛋白后,将蛋白转移到 PVDF膜上,随后用5%脱脂牛奶封闭PVDF膜2 h,4 ℃下PVDF膜与相关一抗孵育过夜,次日二抗孵育2 h。超敏化学发光试剂A液与B液等体积混合均匀后加于PVDF膜上,并用凝胶成像仪显影。使用 Image J 进行条带灰度定量。
2.8 细胞衰老β-半乳糖苷酶(Senescence-associated β-Galactosidase,SA-β-Gal)染色实验
按照SA-β-Gal染色试剂盒的说明书进行操作,加入β-Gal固定溶液室温孵育15 min,PBS洗涤3次,加入新鲜制备细胞染色工作溶液,在37 ℃避光条件下培养细胞过夜。最后使用显微镜观察和拍照。
2.9 EdU细胞增殖实验
按照EdU试剂盒的说明书进行操作,在细胞收集前2 h用37 ℃预热的EdU标记。标记后,用 4% 多聚甲醛将细胞固定10 min,并用 0.3% Triton X-100 透化。然后根据说明书中的步骤测定荧光强度。
2.10 MDA、ROS水平和SOD活力检测
根据相应试剂盒的说明书进行操作,最后使用酶标仪检测其相应水平。
2.11 线粒体膜电位检测
在LX2细胞中加入JC-1染色工作液,在37 ℃细胞培养箱中孵育30 min。在孵育期间,配制适量的JC-1 Buffer(1×),并放置于冰浴。孵育结束后,JC-1 Buffer(1×)洗涤3次。收集细胞,流式分析细胞内膜电位的变化。
2.12 蛋白小体聚集分析
在LX2细胞中加入多聚甲醛固定15 min,PBS洗涤3次。加入0.1%曲拉通通透30 min。用Proteostat®染料孵育30 min,PBS洗涤3次。细胞核染DAPI 20 s,PBS洗涤3次。最后使用激光共聚焦观察和拍照。
2.13 溶酶体数量检测
LX2转染LAMP1-RFP Plasmid,24 h后PBS洗涤3次。加入多聚甲醛固定15 min,PBS洗涤3次。加入DAPI染色液染2 min后,PBS洗涤3次。用抗淬灭剂封片。最后使用激光共聚焦显微镜观察和拍照。
2.14 数据处理及统计
3 结果
3.1 白术内酯Ⅲ抑制ASCT2诱导HSC衰老
为了探究白术内酯Ⅲ抑制ASCT2对HSC衰老的作用,分别使用ASCT2 siRNA和白术内酯Ⅲ处理LX2。MTT结果表明抑制ASCT2后,HSC细胞活力都有显著下降(图1A,P<0.01)。随后,进行EdU掺入实验检测HSC的增殖情况,结果显示抑制ASCT2后,HSC细胞增殖能力下降(图1B,P<0.01);接着,通过SA-β-Gal染色,发现ASCT2 siRNA以及白术内酯Ⅲ组的SA-β-Gal阳性染色细胞显著高于空白组(图1C,P<0.01)。以上结果验证了白术内酯Ⅲ通过抑制ASCT2诱导HSC发生衰老。

注:A.MTT检测细胞活力;B.流式细胞术检测EdU细胞增殖;C.光学显微镜观察并定量SA-β-Gal衰老染色的细胞;与空白组比较,**P<0.01。标尺=50 μm。图1 白术内酯Ⅲ抑制ASCT2诱导HSC衰老Fig.1 Atractylenolide Ⅲ inhibited ASCT2 to induce HSC senescence
3.2 白术内酯Ⅲ抑制ASCT2诱导溶酶体依赖性的HSC衰老
为了进一步研究ASCT2调控HSC衰老的机制,分别使用ASCT2 siRNA及白术内酯Ⅲ处理LX2。Western blot结果显示LC3-Ⅱ/Ⅰ的比值增大(图2A,P<0.01),即表明溶酶体功能出现缺失。接下来,利用LC3探针及错误蛋白堆积ProteoStat染色检测溶酶体功能,同时使用溶酶体标记物LAMP1的荧光质粒检测溶酶体数量,结果表明抑制ASCT2后,细胞的溶酶体数量增多、功能减弱(图2B~F,P<0.01)。抑制ASCT2后加入CQ清除溶酶体,结果显示加入CQ后细胞活力和自噬功能增加(图2G~H,P<0.01)。通过溶酶体标记物LAMP1的荧光质粒检测溶酶体数量,结果表明抑制ASCT2后加入CQ,LAMP1的表达下调(图2I~J,P<0.01)。综上,以上结果证明白术内酯Ⅲ通过抑制ASCT2会使HSC中溶酶体数量增多,功能缺失,进一步促进自噬。


注:使用ASCT2 siRNA或白术内酯Ⅲ处理LX2细胞,A.Western blot检测LC3-Ⅰ、LC3-Ⅱ的表达情况;B~C.LC3探针检测溶酶体功能;D~E.溶酶体标记物LAMP1荧光质粒检测溶酶体数量;F.错误蛋白堆积ProteoStat染色检测溶酶体功能。使用ASCT2 siRNA或白术内酯Ⅲ及CQ处理LX2细胞,G.Western blot检测LC3-Ⅰ、LC3-Ⅱ的表达情况;H.MTT法评估细胞活力;I~J.溶酶体标记物LAMP1荧光质粒检测溶酶体数量;与空白组比较,**P<0.01;与ASCT2组比较,#P<0.05,##P<0.01;与白术内酯Ⅲ组比较,ΔΔP<0.01。标尺=150 μm。图2 白术内酯Ⅲ抑制ASCT2诱导溶酶体依赖性的HSC衰老Fig.2 Atractylenolide Ⅲ inhibited ASCT2 to induce lysosome-dependent HSC senescence
3.3 白术内酯Ⅲ通过抑制ASCT2介导的线粒体-溶酶体互作诱导HSC的衰老
为进一步确定白术内酯Ⅲ抑制ASCT2使溶酶体数量增加,功能缺失的具体机制。首先使用ASCT2 siRNA及白术内酯Ⅲ处理LX2,试剂盒结果显示细胞内MDA、ROS水平上升,而SOD活力下降(图3A,P<0.01)。接下来,通过流式细胞术分析线粒体ROS水平和膜电位的情况,结果表明抑制ASCT2后线粒体ROS水平上升和线粒体膜电位下降(图3B~C,P<0.01)。在抑制ASCT2后加入Rotenone清除线粒体,细胞内的氧化还原稳态得到了恢复(图3D,P<0.01),同时通过溶酶体标记物LAMP1荧光质粒及溶酶体探针观察到加入Rotenone后,溶酶体数量下降到正常水平(图3E~H,P<0.01)。以上结果证明了白术内酯Ⅲ抑制ASCT2会使线粒体ROS增多从而诱导HSC溶酶体依赖性的衰老。


注:使用ASCT2 siRNA或白术内酯Ⅲ处理LX2细胞,A.HSC细胞中MDA、SOD、ROS水平;B.流式细胞术检测及定量分析线粒体ROS;C.流式细胞术测JC-1探针检孵育后的线粒体膜电位。使用ASCT2 siRNA或白术内酯Ⅲ及Rotenone处理LX2细胞,D.HSC细胞中MDA、SOD、ROS水平;E~F.溶酶体标记物LAMP1荧光质粒检测溶酶体数量;G~H.溶酶体探针检测溶酶体数量。与空白组比较,** P<0.01;与ASCT2组比较,## P<0.01;与白术内酯Ⅲ组比较,ΔΔ P<0.01。标尺=150 μm。图3 白术内酯Ⅲ通过抑制ASCT2介导的线粒体-溶酶体互作诱导HSC的衰老Fig.3 Atractylenolide Ⅲ induced HSC senescence through inhibition of ASCT2-mediated mitochondrial-lysosomal interaction
3.4 白术内酯Ⅲ通过诱导HSC衰老抗肝纤维化
接下来,为了探究白术内酯Ⅲ是否通过诱导HSC衰老抗肝纤维化,我们在CCl4诱导的肝纤维化小鼠中腹腔注射不同剂量的白术内酯Ⅲ,持续4周。HE、Masson和Sirius Red染色结果(图4A)表明,与模型组相比,白术内酯Ⅲ改善肝脏组织破坏以及胶原沉积。Western blot结果(图4B)表明白术内酯Ⅲ促进HSC衰老指标P16、P21的表达(P<0.01,P<0.001)。随后,检测了肝小叶中的SA-β-Gal阳性细胞,尤其是HSC。结果(图4C)显示,在白术内酯Ⅲ治疗下的纤维化肝脏中,SA-β-Gal阳性细胞数量增加,而α-SMA表达减少。SA-β-Gal细胞与具有阳性α-SMA的细胞共定位并发挥负相关作用。以上结果证明白术内酯Ⅲ通过诱导HSC衰老抗肝纤维化。
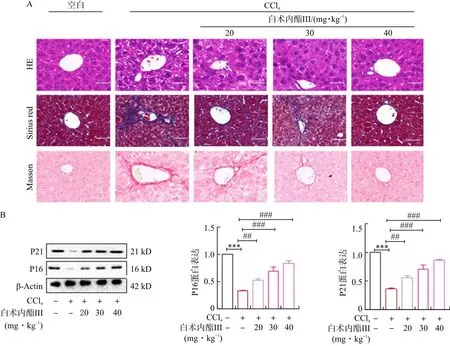

注:A.HE、Masson和Sirius Red染色,标尺=50 μm;B.Western blot分析衰老指标P16和P21蛋白表达;C.SA-β-Gal衰老染色以及α-SMA免疫组化染色的代表图像和量化,标尺=25 μm,箭头表示SA-B-Gal 染色阳性的细胞。与空白组比较,***P<0.01;与CCl4组比较,##P<0.01,###P<0.001。标尺=50 μm。图4 白术内酯Ⅲ通过诱导HSC衰老抗肝纤维化Fig.4 Atractylenolide Ⅲ inhibited liver fibrosis by inducing HSC senescence
4 讨论
细胞衰老在肝纤维化的发展过程中扮演着关键的角色。肝星状细胞作为肝纤维化的主要参与者之一,其衰老过程与纤维化的进展密切相关[16]。衰老的肝星状细胞在纤维化区域展现出明显的特征,包括胶原蛋白生成减少和增殖活性降低。深入研究细胞衰老与肝纤维化之间的关联有助于理解这一病理过程的分子机制。此外,通过干预细胞衰老的过程来调控肝星状细胞的活性,有望防止或减缓肝纤维化的进展[17]。这一领域的研究为未来开发更有效的肝纤维化治疗方法提供了重要的启示。
越来越多的研究表明,溶酶体-线粒体轴在细胞衰老中发挥重要作用[18]。溶酶体作为细胞内主要的消化和降解器官,其功能障碍直接影响细胞内的分子降解和循环[19]。当溶酶体功能受损,无法有效地清除受损的线粒体和其他细胞器,会导致细胞内脂褐素等废弃物质的积累,而脂褐素的积累导致线粒体ROS水平的上升。同时,增加的 ROS 水平反过来又靶向溶酶体,形成一个恶性循环[5, 19]。这种线粒体与溶酶体之间的相互作用,被称为溶酶体-线粒体轴,是细胞衰老的重要机制之一。因此,线粒体产生的ROS和溶酶体的功能障碍,都是触发和加速细胞衰老过程的关键因素。通过深入研究这些机制,有望为延缓细胞衰老和治疗与衰老相关的疾病提供新的策略和靶点。在本研究中,我们发现白术内酯Ⅲ通过抑制ASCT2诱导线粒体ROS增多和膜电位降低,进一步使溶酶体数量增加、功能缺失,从而促进HSC衰老。此外,我们在体内实验中发现白术内酯Ⅲ通过诱导HSC衰老抗肝纤维化。本实验结果为白术内酯Ⅲ成为逆转肝纤维化的有效药物提供了理论依据。
慢性肝病进展过程中无论病因如何,都涉及肝纤维化及伤口愈合反应的持续性激活。因此,逆转纤维化是降低慢性肝病发生率和死亡率,守护人类肝健康的关键事件。其中,活化的HSC又是肝纤维化病理机制的核心环节,围绕抗肝纤维化的研究大多与抑制肝星状细胞活化有关。本实验通过研究白术内酯Ⅲ抑制ASCT2影响线粒体-溶酶体互作诱导肝星状细胞衰老的机制,为逆转肝纤维化提供了新的治疗思路,使ASCT2成为抗纤维化药物研发的潜在靶点。尽管本实验揭示了白术内酯Ⅲ在体外对肝星状细胞衰老的作用,并进行了相关表型验证,但研究存在一定局限性。我们仅在体外环境中进行了相关实验,缺乏对复杂器官中各种分子和细胞类型相互作用的全面理解。白术内酯Ⅲ在临床应用中的具体效果仍需进一步的验证和研究。
