某国产试剂品牌在西门子Atellica-CH930全自动生化分析仪检测全程C反应蛋白的性能验证
2024-05-16邰祺雯李德全赵艳红花海珠
邰祺雯 李德全 赵艳红 花海珠*
1 苏州大学附属第一医院 (江苏 苏州 215006)
2 沈阳平安好医医学检验实验室有限公司 (辽宁 沈阳 110015)
内容提要: 目的:基于WS/T 408-2012《临床化学设备线性评价指南》、WS/T 492-2016《临床检验定量测定项目精密度与正确度性能验证》以及CNAS-GL037《临床化学定量检验程序性能验证指南》等文件评价某国产品牌在西门子全自动生化分析仪检测全程C反应蛋白的性能,为规范性能验证的实施及全程C反应蛋白的临床推广提供参考。方法:依据中国合格评定国家认可委员会以及国家卫生健康委员会临检中心推荐的方法对乳胶免疫比浊法全程C反应蛋白的正确度、精密度、线性区间、可报告范围、参考区间进行验证,试验结果在厂商规定的范围内或是满足本室的执行标准为性能验证通过。结果:通过选取2种浓度厂商提供的标准溯源物质进行偏移评估,检测结果均符合规定,正确度验证通过。同时验证重复性和精密度,2种浓度的批内标准差和实验室内标准差均小于厂商规定的范围,精密度验证通过。多项式回归最优拟合曲线为一阶线性微分方程y=1.088x-2.884,R2=0.9989,线性区间验证通过。临床可报告范围最高稀释倍数为16倍,高限为340mg/L。20名健康个体的检测结果均在厂商制定的参考范围内。结论:该品牌全程C反应蛋白检测试剂与西门子Atellica-CH930全自动生化分析仪联用性能稳定,可用于临床样品的检测。
按照中国合格评定国家认可委员会2012年发布的《医学实验室质量和能力认可准则》:CNAS-CL02:2012中的内容规定,医学检验实验室应当参考IS015189《医学实验室质量和能力认可准则》建立并运行质量管理体系,对医学检验项目进行标准操作程序的性能验证或性能确认[1]。既往行业内部对临床检验项目的性能验证方式和评价标准参差不齐,各实验室对应如何开展性能验证工作缺乏经验和参考对象,导致性能验证在实施的过程中容易出现要素不齐、方案不佳和标准错选等诸多情况[2,3]。
2019年2 月由中国合格评定国家认可委员会发布了CNAS-GL037:2019《临床化学定量检验程序性能验证指南》,其中包含GB/T 26124-2011《临床化学体外诊断试剂(盒)》、WS/T 408-2012《临床化学设备线性评价指南》、WS/T 416-2013 《干扰实验指南》、WS/T 420-2013《临床实验室对商品定量试剂盒分析性能的验证》、WS/T 492-2016《临床检验定量测定项目精密度与正确度性能验证》共5篇规范性引用文件,提供了准确有效的性能验证方案参考和方法解读[4]。
本实验完全按照其推荐的性能验证方法对某国产品牌试剂在进口厂商西门子最新机型Atellica-CH930全自动生化分析仪的开放试剂仓位中联合应用检测全程C反应蛋白的性能进行验证,为日后性能验证的规范化、同质化工作以及向临床推广全程C反应蛋白检验项目提供参考。
1.材料与方法
1.1 一般材料
本研究起止时间:2022年8月~2022年11月。
本试验收集由健康个体提供或者厂商声明的线性区间内低、高限浓度水平的肘静脉血液样品作为试验对象,样品性状正常,排除溶血、乳糜血、黄疸等不合格样品。经离心及提取上清后,避光-80°C冷冻保存于冻存管内。其中,健康个体的病史采集、体格检查、实验室检查结果均符合WS/T 404-2018《临床常用生化检验项目参考区间》的规定标准[5]。
仪器与试剂:本试验使用的检验仪器为西门子Atellica CH930型全自动生化分析仪,使用的试剂为九强乳胶免疫比浊法全程C反应蛋白(HCRP)检测试剂盒(批号:21-1215),校准品(GC-HCRP,批号:21-0510)及质控品(GQ-HCRP,批号:21-1125)。
1.2 方法
1.2.1 测量正确度验证
本试验应用偏移评估法进行正确度验证,选取由厂商提供的2种浓度的工作标准品(溯源性标准物质),每天重复测定2次,连续测定5d,记录检测结果。评价方式为计算全部检测结果的上验证限和下验证限,如厂商声明标准在本试验检测的上、下验证限区间范围内,则测量正确度验证通过。
1.2.2 测量精密度验证
精密度验证包括测量重复性和测量中间精密度,本试验同时验证重复性和中间精密度。每天检测1个分析批,每批检测2个水平的样品,每个样品重复检测4次,连续检测5d,每个分析批中检测质控品,如失控则剔除数据并增设分析批。数据分析前排除离群值,排除标准为离均差超过4SD,计算变异系数,小于厂商声明则为精密度验证通过。
1.2.3 线性区间验证
本试验应用多项回归分析的方式进行线性区间验证。在厂商声明的线性区间内选择样品冻存待用,通过高、低浓度样品进行等浓度间隔稀释制备6种浓度的试验样品,每个样品量为1.00mL,重复测定3次,计算均值、排除离群值,离群值排除方法为Grubbs法,所有试验均在1d内完成。对检测结果进行多项回归分析,其中实际检测值作为因变量,理论计算值为自变量,使用统计软件Prism 9进行统计分析,得到一阶、二阶和三阶多项式,对二阶和三阶的非线性系数与0进行t检验判断是否有显著性差异从而判断最优拟合曲线。判定标准为二阶和三阶的非线性系数与0无差异,最优拟合曲线为一阶时线性区间验证通过。
1.2.4 可报告范围的确定
选择厂商声明的线性区间上1/3区域样品,根据西门子Atellica CH930全自动生化分析仪设定的自动稀释倍数(2、4、8、16倍)作为待测稀释倍数,使用专用稀释液对样品进行稀释,每个稀释倍数的样品重复检测3次,计算均值、标准差和变异系数,同时计算与还原浓度的相对偏差,可报告区间高限为相对偏差<1/3总Tea的最大稀释倍数与检测区间高限的乘积。
1.2.5 参考区间验证
收集健康个体肘静脉采集的血液样品,排除不合格样品,病史采集、体格检查及实验室检查指标需均符合WS/T 404-2018《临床常用生化检验项目参考区间》规定标准。男性女性各10名,年龄20~60岁。验证标准为若检测结果在厂商声明参考区间之外的数据不超过2个,则为参考区间验证通过,若超过2个,则另选20名合格参考个体重新按照上述方案进行验证。
2.结果
2.1 测量正确度验证
2种浓度的溯源标准物质检测结果的95%上、下置信限均符合厂商声明的上、下验证限范围内,测量正确度偏移评估验证通过,详见表1及表2。
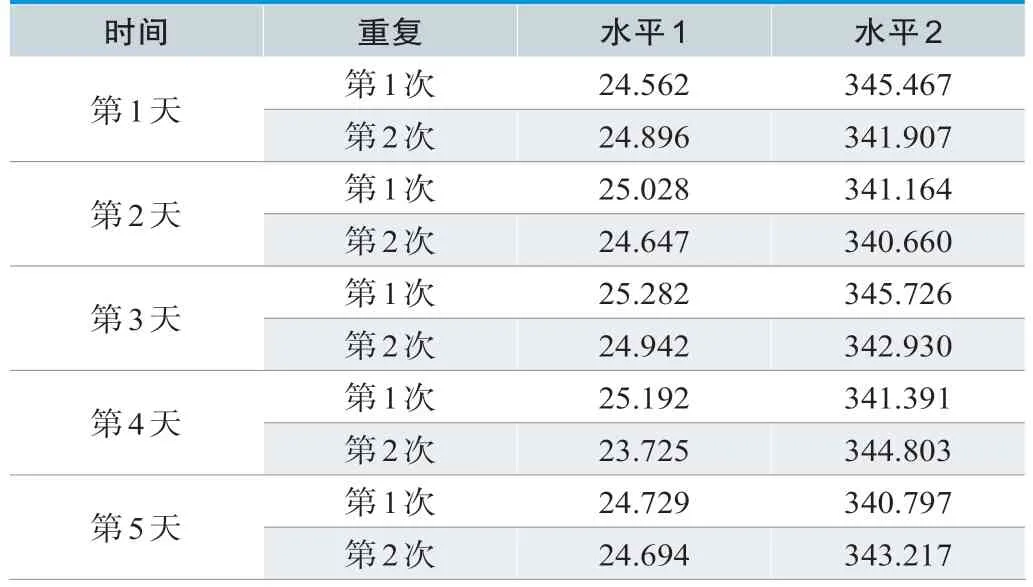
表1.测量正确度检测数据(mg/L)

表2.测量正确度偏移评估结果
2.2 测量精密度验证
2个浓度水平的测量精密度验证结果均低于厂商声明标准(批内变异系数<6.25%,实验室变异系数<8.33%)验证通过,如表3及表4所示。
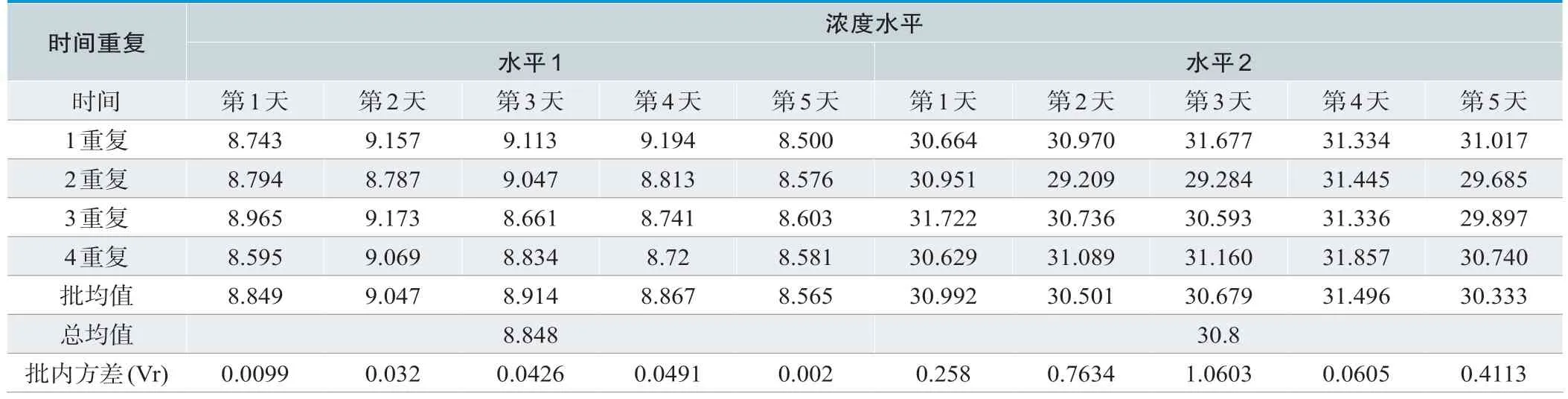
表3.测量精密度检测数据(mg/L)
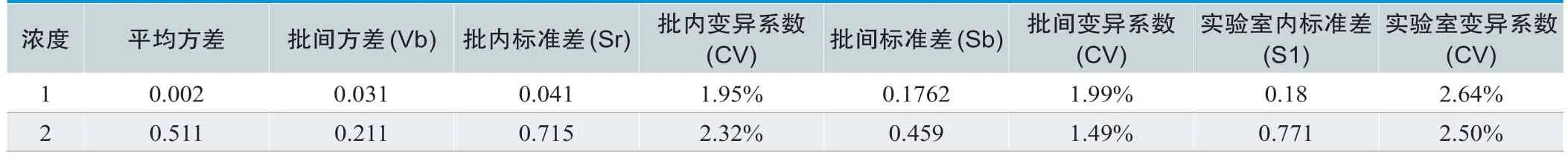
表4.测量精密度验证结果
2.3 线性区间验证
线性区间的等浓度间隔样品制备设计如表5所示,检测结果如表6所示,多项式方程如表7及图1所示,使用Prism 9.0统计软件进行分析得到一阶方程为y=1.088x-2.884,R2=0.9989,三阶方程的拟合曲线如图1所示。再对二阶和三阶的非线性系数与0进行t检验,结果二阶方程中的非线性系数1.97×10-4,三阶方程中的非线性系数1.016×10-6,6.925×10-4与0的差异均无统计学意义,因此最优拟和曲线为一阶线性微分方程,厂商声明的区间符合线性。

图1.多项回归拟合曲线(mg/L)
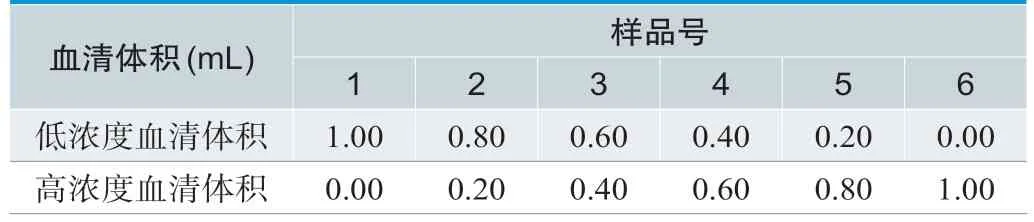
表5.等浓度间隔稀释样品制备设计
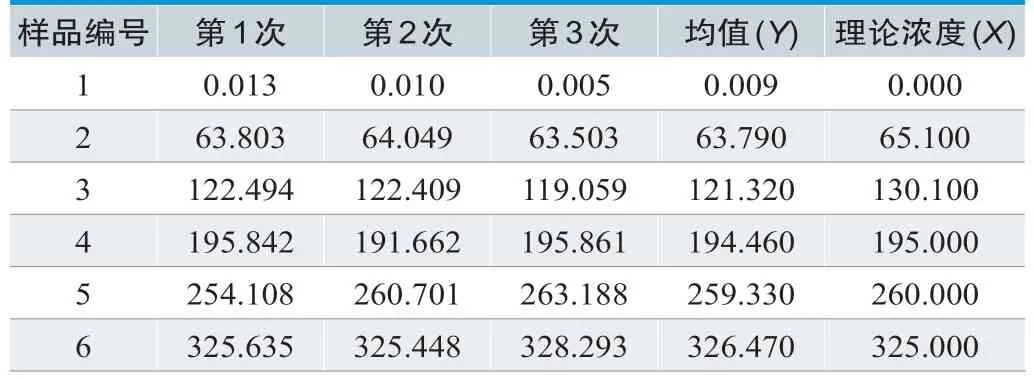
表6.线性区间检测结果(mg/L)

表7.多项式回归方程
2.4 可报告范围确定
在可报告范围的确定中,取最高稀释倍数16倍时相对偏差仍然<1/3 Tea,因此可报告范围确定为0~340mg/L,最高稀释倍数为16倍,如表8所示。
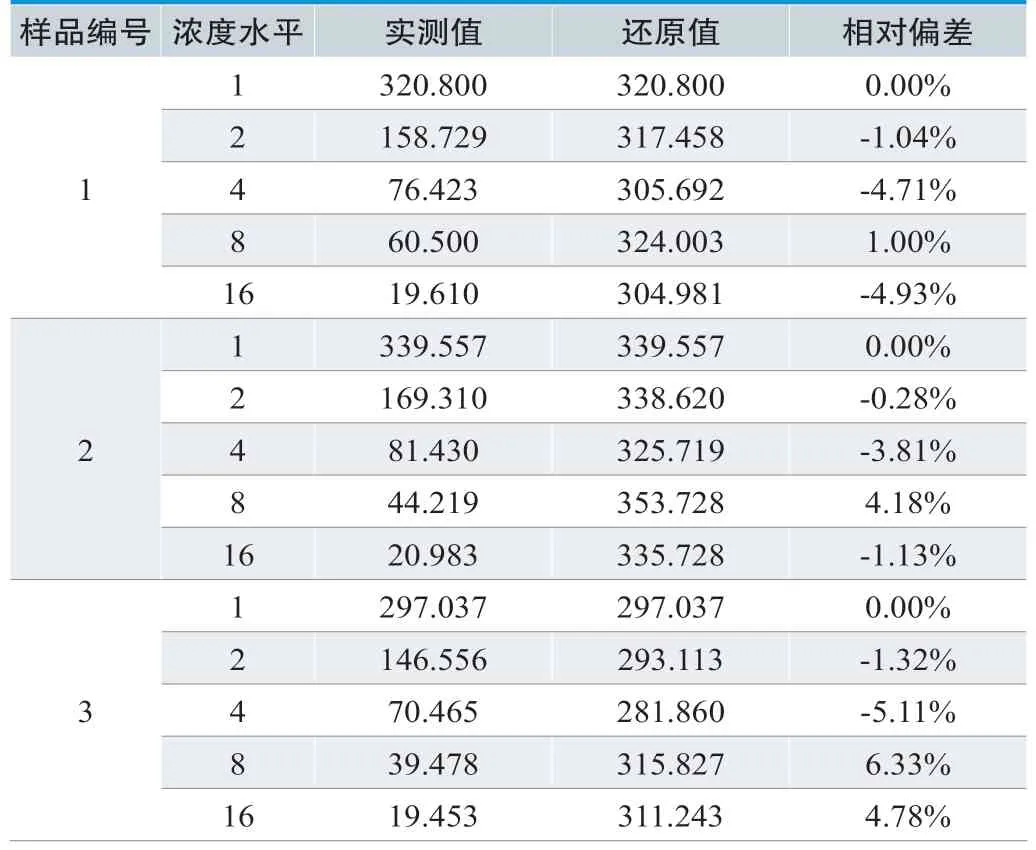
表8.可报告范围确定检测结果(mg/L)
2.5 参考区间验证
根据厂商提供的参考区间0.000~6.000mg/L,选取符合标准的个体样品20例,在20个检测值中,无声明区间外,验证通过。
3.讨论
检验项目的性能验证得以有效实施,是卫生资源合理利用、避免浪费的重要前提[6]。性能验证的主要目的是为了保证检验项目程序能够满足临床要求,保证样品检测结果的准确性和可靠性,因此性能验证也是检验与临床沟通的基本要求[7]。本试验所论述的检验项目全程C反应蛋白,是一次检测超敏C反应蛋白和常规C反应蛋白的新发展的检测技术,可以满足临床对新生儿、儿童和成年人感染性疾病的鉴别诊断与监测、抗生素的合理应用以及心血管疾病风险评估等多种需求,且方法学较为稳定,具有较好的临床意义[8]。因此,对全程C反应蛋白进行检验程序的性能验证也能够为临床主动送检提供参考与激励,支持检验新技术的研究与发展。同时,通过本试验的验证,可知国产试剂品牌与进口检测设备的开放试剂仓位联合应用的检验程序同样性能稳定,在进行检验试剂国产化、降低高值耗材的耗占比等节流管理方向上亦能提供参考。
综上所述,国产试剂品牌在西门子Atellica-CH930全自动生化分析仪检测全程C反应蛋白的测量正确度、测量精密度、线性区间、可报告范围及参考区间的验证及确认均通过,且试验方案与评价标准符合ISO15189的认可要求,也能够满足临床要求。
但是,本试验的局限性在于未成功进行特异性检验和一致性验证。其一,特异性检验未实施的原因是未能集齐浓度合理的干扰物质,本试验使用了不同浓度的自制干扰替代物质,进行过多次试验,但是均未能得到稳定的结果,且无量值溯源依据。其二,一致性检验未实施的原因是区域内无相同检验项目的使用方,同一检验项目在不同程序间的检测结果如具有一定的可比性,有助于区域内资源整合,也能够确保临床进行准确判断[9]。因此未能进行特异性和一致性验证是本次研究的局限所在。
