腹腔镜肾部分切除治疗多囊肾合并单侧肾癌病例报道
2024-05-15杨立胡俊孙曼李建秧杨银桂
杨立 胡俊 孙曼 李建秧 杨银桂
多囊肾合并肾癌在临床上并不常见,国内外对此类疾病的诊疗报道较少。多囊肾疾病本身的进展可能导致肾功能不全,而合并肾癌则增加了治疗的复杂性,目前对于这种情况的治疗策略和手术技术的经验非常有限。对于伴有单侧肾癌的多囊肾患者,可以选择肿瘤根治性切除或保留肾单位的肾部分切除术。然而,由于多囊肾实质组织中存在大小不一的囊泡并且肾脏体积增大并形态异常,行腹腔镜下的肾部分切除术与常规术式操作存在差异,目前尚无相关报道。本文就大理大学第一附属医院泌尿外科收治的1例多囊肾合并单侧肾癌患者的临床资料及手术治疗过程进行回顾并复习相关文献,分析总结了该类疾病的流行病学特点及腹腔镜下肾部分切除治疗的经验,现报告如下。
病例报告
患者,男,56岁,于2022 年3 月因“左侧腰腹部胀痛10日”入院,患者无发热,无肉眼血尿、尿频、尿急及尿痛症状。家族多囊肾遗传史不明,否认高血压、糖尿病及心脑血管疾病病史。入院查体:双肾区无叩击痛,双侧输尿管走行区无压痛。实验室检查:血肌酐增高至124μmol/L,尿素氮增高至8.84 mmol/L。CT 平扫及增强提示:肝及双肾多发囊状影,左肾内肿块大小约3.5 c m×3.5 c m,呈不均匀明显强化(图1)。CT 诊断:多囊肝、多囊肾,左肾占位考虑肾癌可能。术前诊断:多囊肝多囊肾;左肾癌可能。完善相关检查后在全身插管麻醉下行腹腔镜下肾部分切除术。

图1 术前腹部CT 平扫
术中采用经腹径路先置入3 个Trocar(观察镜置入12 mm Trocar位于脐上一横指及腹正中线外两横指处,左手操作通道置入5 mm Trocar位于锁骨中线下一横指处,右手操作通道置入12 mm Trocar位于锁骨中线下的脐下一横指水平处),置镜观察可见左肾布满体积大小不等的囊肿,于腹侧和下极将部分阻碍视野显露的部分囊肿去顶减压,并于平脐水平外侧三横指处加5 mm Trocar置入器械将肾向背外侧推移抬离辅助显露肾门,于肾静脉上方仔细游离出腹前侧肾动脉分支(术前评估其供应瘤体所在肾实质区域的血供),结合术前影像学定位先将瘤体大致位置的外周囊肿去顶,寻找并显露瘤体假包膜,使用无损伤血管夹进行选择性阻断腹前侧肾动脉分支,沿瘤体假包膜使用腔镜剪刀剜切,创面中遇切开的渗血血管使用Hemolok夹夹闭。移除切下的瘤体,先使用3-0倒刺线连续缝合创面深层,再使用2-0倒刺线连续关闭创面外层肾实质,开放阻断血管夹,共计选择性阻断35 min,观察缝合视野无显著出血,留置肾周引流管结束手术。术后观察大体肉眼标本见瘤体的假包膜完整。术后第1天复查血肌酐为136μmol/L,尿素氮6.70 mmol/L,术后第6天复查血肌酐为103μmol/L,尿素氮5.56 mmol/L,术后第7天康复出院。术后病理:镜下观见肿瘤组织的癌细胞体积大、边缘清楚、呈卵圆或多角形、核小而均匀、染色深,胞质少而呈透明状,透明细胞呈实性巢状排列,局部囊性变,未见坏死,肿瘤周围见萎缩肾小管。免疫组化:CD10(+),CD68(-),CK20(-),CK7(-),CK-P(+),E-cadherin(-),EMA(+),Ki-67(+<5%),Vi mentin(+),P504S(-),PAX-8(+),CD117(散在+)。术后病理报告:(左肾)透明细胞肾细胞癌伴囊性变,世界卫生组织/国际泌尿病理学会分级Ⅱ级。术后未行辅助治疗,于术后3个月后随访,行腹部CT 复查未见复发和转移(图2),抽血复查血肌酐107μmol/L,未提示肾功能出现显著变化。
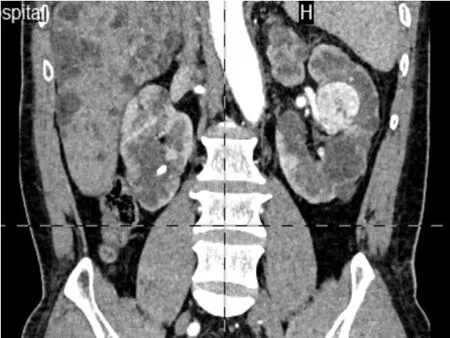
图2 术前腹部CT 增强
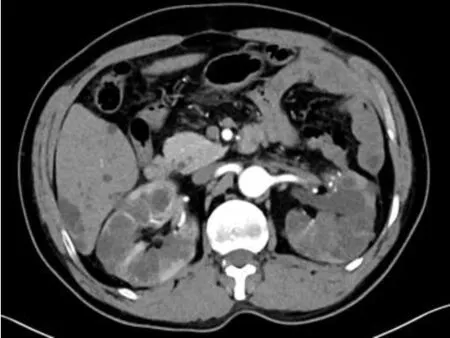
图3 术后腹部CT 平扫
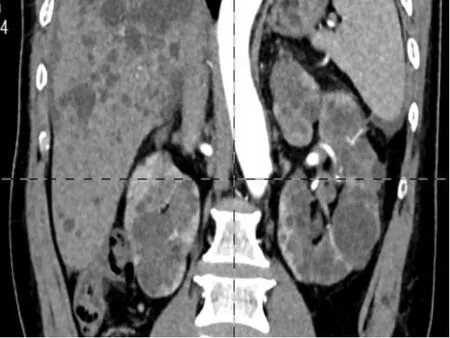
图4 术后腹部CT 增强
讨 论
国外有研究报道,多囊肾合并肾癌患者的终末期肾脏去除或行手术治疗发生率约5.00%~12.36%[1-2]。近期一项大规模人群队列研究通过倾向评分分析表明,多囊肾患者发生肾细胞癌的风险较一般人群(非多囊肾患者)显著升高[3]。有学者通过对肿瘤组织、囊肿组织和外周血样本分别进行全外显子组和转录组测序,发现多囊肾中肾癌的发生机制可能是由于VHL 缺失导致肿瘤形成过程中血管生成加速,即MAPK 信号通路激活如NRAS和MAPK1的表达增殖等因素导致[4]。多囊肾和肾细胞癌在疾病细胞和分子功能障碍致病机制方面具有一些共同特征,包括血管生成受损和代偿性血管内皮生长因子激活,例如PI3 K/AKT/mTOR 和Ras/Raf/ERK 通路在调节囊性和肿瘤细胞增殖和生长中起重要作用[5]。因此对于多囊肾患者,不仅需要监测和处理由疾病引起的并发症,还应注意肾细胞癌发生的可能。
多囊肾的治疗主要针对其导致的并发症,例如血尿、结石性梗阻或尿路感染,而伴有肾细胞癌的患者可以选择肾切除术[6]。我们考虑多囊肾并肾细胞癌的手术治疗方式主要依据肾细胞癌的临床分期、多囊肾所致肾功能不全或其他并发症情况等影响因素。国外少量病例报道可行的治疗方法是根治性切除术或肾部分切除术[4,7]。国内郭宏骞教授团队的研究报道,针对孤立性肾细胞癌的多囊肾患者,在超声造影引导下进行经皮肾消融术是一种可选择的较好治疗方式[8]。考虑到本例患者为中老年男性,肾功能血肌酐在正常上限代偿范围内,而肿瘤为单侧孤立性,尽管多囊肾体积较大且形态不规整,但行腹腔镜下手术治疗对患者来说恢复较快[9]。多囊肾的治疗原则是延缓疾病的进展并保护肾功能,如伴发肾透明细胞癌,则肿瘤切除成为首要考虑目标。对于肾功能仍处在代偿期且尚未进入透析阶段的患者,只要瘤体的大小和位置等条件允许,我们认为应首选肾部分切除术。本例肾肿瘤位于肾内,虽然是内生性肿瘤,但肿瘤周围分布着囊肿且瘤体距离肾包膜较近,采用腹腔镜下肾部分切除术可望达到手术目的。术前需向患者及家属详细说明手术难度及中转开放治疗的可能,腹腔镜下多囊肾行肾部分切除术最终中转开放方式处理可能性有13%[10]。
对于多囊肾的腹腔镜手术路径有经腹入路和腹膜后入路,研究报道两者的术后结局并无显著差异[11],腹腔镜肾部分切除术的手术路径选择主要取于决瘤体位置和手术操作复杂程度[12]。我们对本例患者的腹腔镜下手术径路、肾血管的阻断方式、如何完整切除及缝合等进行了总结,①腹腔镜手术径路首选经腹途径:因考虑多囊肾本身肾体积较大且形态分布不均,多个囊内存在感染和肾周粘连可能性大[13],肾实质空间已基本被水样囊液占据及肾包膜张力增加等因素影响,在术中我们选择经腹路径,避免腹膜后径路狭小的操作空间;②术中肾蒂血管显露及阻断:暴露肾蒂血管时,将阻碍暴露肾蒂视野的囊肿去顶并吸尽其中囊液,必要时于腹侧加5 mm Trocar置入辅助钳将患肾向背外侧推抬,可降低肾蒂血管显露难度;多囊肾肾实质皮髓质本身发育异常,后期逐渐又受到囊肿挤压破坏,肾内血流分布与正常情况存在差异;瘤体切除后缝合时缺乏实质组织衬垫,缝线可能穿越囊壁组织或肾内段间血管致缝合止血时间较长,进而延长患肾的缺血阻断时间,为避免热缺血损伤影响肾功能进一步恶化,我们在术中首选超选择性阻断的血管阻断方式,即游离出瘤体所在部位肾实质区域的供血分支动脉予以阻断;③瘤体的定位、切除及缝合:尽管本例为内生性肿瘤,结合术前阅片定位,术中可先将包绕瘤体的囊肿去顶,显露肾癌部分组织的假包膜,沿着假包膜外层面进行剜切,切开创面的肾内段间血管本身无肾实质压迫因而渗血较为明显,可单独缝合血管创面后再行双层缝合。
多囊肾合并肾癌病例国内外报道较少,目前尚无关于术后是否进行免疫治疗及免疫治疗对预后改善或影响的报道。因考虑免疫治疗中肾功能不全对机体影响,本研究中的患者术后未接受免疫治疗,影像学检查未显示复发,患肾体积较术前未出现显著增大且形态无明显变化,总肾功能稳定,然而,仍需进一步的远期随访。
