中性粒细胞外诱捕网、纤溶酶原激活抑制剂1对早产急性呼吸窘迫综合征患儿预后的影响
2024-05-13张敏杨立
张 敏 杨 立
北京市通州区妇幼保健院新生儿科,北京 101100
早产儿急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是新生儿重症监护中常见的严重并发症之一,其发病率和病死率极高,主要病理特征为细胞免疫和凝血系统异常引发肺泡膜损伤、肺水肿,导致氧合功能严重受损,严重影响早产儿的生存和发育[1]。中性粒细胞外诱捕网(neutrophil extracellular traps,NETs)是由中性粒细胞释放的一种特殊细胞外陷阱,由游离DNA(cell free-DNA,cf-DNA)、中性粒细胞弹性蛋白酶(neutrophil elastase,NE)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等组成[2]。当中性粒细胞受到感染或激活时,NETs 会形成并释放,起到限制病原微生物扩散的作用。然而,过度活化的NETs 可能导致炎症反应的过度放大和组织损伤,在多种疾病中发挥着不可忽视的作用[3]。纤溶酶原激活抑制剂1(plasminogen activator inhibitor-1,PAI-1)是一种调节凝血和纤溶平衡的重要蛋白质,其可抑制纤溶系统的活化,导致血栓形成和肺泡膜微循环障碍,与肺细胞损伤和纤维化进程相关[4]。NETs 和PAI-1 可能参与了ARDS 的发生、发展,但二者与早产儿ARDS 的研究相对缺乏。因此,本研究旨在探究早产ARDS 患儿血浆NETs、PAI-1 的水平变化与患儿预后结局的关联,以期为临床早产儿ARDS 的诊断、个体化治疗提供新思路。
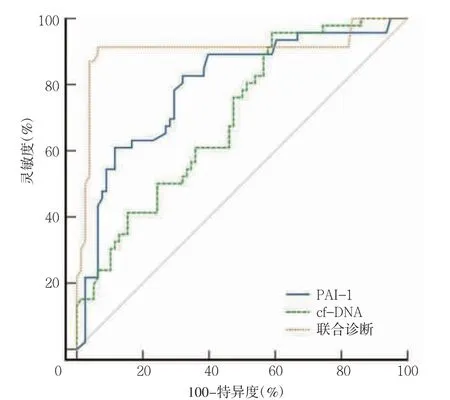
图1 cf-DNA、PAI-1 预测早产ARDS 患儿预后不良的ROC 曲线
1 对象与方法
1.1 研究对象
选取2020 年1 月至2022 年12 月北京市通州区妇幼保健院收治的早产ARDS 患儿125 例作为研究对象(ARDS 组),其中男71 例,女54 例;胎龄28~36周,平均(30.69±3.17)周。纳入标准:①ARDS 的诊断符合《“新生儿急性呼吸窘迫综合征”蒙特勒标准(2017年版)》[5]相关标准;②胎龄28~37 周;③需行气管插管有创通气;④监护人对收集新生儿资料进行研究具有知情权。排除标准:①合并先天性血液系统疾病;②合并其他先天性呼吸系统疾病;③合并染色体异常、遗传代谢性疾病、先天性心脏病等;④合并心、肝、肾功能严重损害。本研究经北京市通州区妇幼保健院伦理委员会的审批同意(2022-TZFY-010-01)。
1.2 研究方法
1.2.1 一般资料 收集并统计患儿的基本资料,包括性别、孕龄、Apgar 评分、出生方式、出生体重、ARDS 分级、孕妇产前激素使用情况及妊娠糖尿病情况。
1.2.2 样本采集 采集入组对象出生1 d 内静脉血2 ml,静置1 h,3 500 r/min 离心8 min(离心半径为14.5 cm),分离血浆,置于-80℃冷藏器中保存备用。
1.2.3 生化指标的检测 常温溶解样本,基于PicoGreen荧光染料法,使用荧光酶标仪测定血浆cf-DNA 水平,DNA 检测试剂盒购于美国Invitrogen 公司(货号:UA20200100595);双抗体酶联免疫吸附试验法检测NE、TNF-α、PAI-1 水平,NE 检测试剂盒购于深圳晶美生物技术有限公司(货号:SZBD20153768),TNF-α检测试剂盒购于武汉伊莱瑞特生物科技有限公司(货号:SZBD20204783),PAI-1 检测试剂盒购于上海杏宜生物科技有限公司(货号:SZBD2018034765)。
1.2.4 患儿预后监测 收集并统计患儿预后信息,预后不良定义为患儿死亡、病情无好转而转院治疗、有创通气>10 d,其余情况为预后良好。并据此进行分组。
1.3 统计学方法
采用SPSS 23.0 统计学软件进行数据分析。计量资料用均数±标准差()表示,比较采用t 检验;计数资料用例数或百分率表示,比较采用χ2检验;等级资料比较采用秩和检验;相关性分析使用Pearson 检验;早产ARDS 预后不良的影响因素采用logistic 回归分析;cf-DNA、PAI-1 对早产儿ARDS 预后不良的预测价值采用受试者操作特征(receiver operating characteristic,ROC)曲线评估,曲线下面积比较采用非参数秩和检验。以P<0.05 为差异有统计学意义。
2 结果
125 例早产ARDS 患儿预后不良47 例,预后良好78 例。
2.1 两组一般资料和生化指标比较
预后不良组cf-DNA、NE、TNF-α、PAI-1 水平高于预后良好组(P<0.05)。两组Apgar 评分、出生体重、ARDS 分级、分娩方式、产前激素使用、妊娠糖尿病比较,差异无统计学意义(P>0.05)。见表1。

表1 两组一般资料和临床资料比较
2.2 早产ARDS 患儿cf-DNA 与NE、TNF-α 的相关性
早产ARDS 患儿cf-DNA 与NE、TNF-α 呈正相关(r=0.645、0.687,P<0.001)。
2.3 早产ARDS 患儿不良预后的影响因素
以早产ARDS 患儿预后为因变量(不良=1、良好=0),cf-DNA、NE、TNF-α、PAI-1 为自变量(原值带入)进行logistic 回归分析。结果显示,cf-DNA、PAI-1 水平升高是早产ARDS 患儿预后不良的危险因素(OR=2.188、2.303,P<0.05)。见表2。
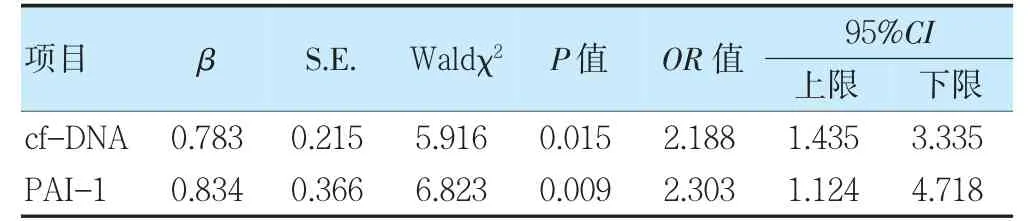
表2 早产ARDS 患儿不良预后的影响因素
2.4 cf-DNA、PAI-1 对早产ARDS 患儿预后不良的预测效能
cf-DNA、PAI-1 联合预测早产ARDS 患儿预后不良的曲线下面积高于各指标单独预测(Z=3.272、2.229,P=0.001、0.026)。见图1、表3。

表3 cf-DNA、PAI-1 对早产ARDS 患儿预后不良的预测效能
3 讨论
ARDS 是各种肺内外因素导致的肺组织弥漫性损伤,以顽固性低氧血症、呼吸困难为主要临床特征,在小胎龄、低体重的早产儿中时有发生[6]。早产儿肺炎、胎粪吸入、围生期窒息、菌血症等导致ARDS 的肺内外因素更易发生,加之其免疫力低下、抗外界环境能力差,患儿病情难以控制、预后极差[7]。ARDS 的主要病理机制是肺泡上皮、内皮细胞受损,引起终末微血管-肺泡屏障功能不全,体液渗入肺泡中造成肺水肿,引起肺通气、换气障碍,此过程与中性粒细胞过渡活化、炎症反应过渡激活、凝血纤溶系统失衡有关[8]。cf-DNA、PAI-1 分别是中性粒细胞激活、凝血系统失衡的重要标志物,二者可能与早产儿ARDS 的发生密切相关。
当机体受病原微生物侵袭时,中性粒细胞被激活释放出一种以DNA 为基本框架且附着大量颗粒蛋白、肽类物质的网状纤维,即为NETs[9]。cf-DNA、NE是NETs 的主要成分,二者可较好地反映机体NETs水平[10]。NETs 的形成可以捕获、消灭入侵的病原微生物,但过量产生的NETs 不仅直接损伤组织细胞,还可对炎症介质和蛋白质进行招募,进而放大炎症级联反应,导致组织上皮细胞和内皮细胞凋亡[10-11]。此外,有研究发现,急性肺损伤发生时,NETs 可激活并诱导M0 亚型巨噬细胞向M1 型转换,进而导致TNF-α 过度分泌加重炎症反应,同时TNF-α 亦可促进NETs 形成,进一步加重肺组织损伤[12]。有研究发现,急性肺损伤大鼠肺泡灌洗液中NETs 形成明显增加、肺组织炎症反应明显;使用DNA 降解酶干预后NETs 显著下降,且肺组织损伤减轻[13]。提示清除NETs 有助于肺组织损伤恢复。本研究结果显示,预后不良组cf-DNA、NE、TNF-α 水平高于预后良好组。提示患儿体内中性粒细胞高反应性、NETs 生成明显,且随着NETs 生成增多,患儿肺组织损害程度越明显,病情亦越重,预后越差。本研究结果显示,早产ARDS 患儿cf-DNA 水平与NE、TNF-α 水平呈正相关。进一步说明NETs 水平越高,其对肺组织的炎症损伤越重。本研究结果显示,cf-DNA 是早产ARDS 患儿预后不良的独立危险因子。提示其与患儿预后具有较好的量化关系,也间接提示NETs 是预测早产ARDS 患儿预后不良的有效标志物之一。笔者推测,早产ARDS 患儿肺组织上皮细胞、内皮细胞损伤明显,外界病原微生物入侵后,刺激中性粒细胞活化,进而释放NETs 发挥灭菌作用,但在此过程中NE、TNF-α 等炎症因子亦大量生成,进而加重肺组织细胞上皮-内皮屏障的破坏,加速肺水肿、促进ARDS 的进展,导致患儿病情加重、预后不良[10-13]。
PAI-1 属于丝氨酸蛋白酶超家族成员之一,其可抑制链激酶和尿激酶的纤溶作用,抑制体内纤溶活性、增强凝血活性,进而促进纤维蛋白的形成[14-15]。ARDS 最为显著的组织学改变为肺血管内皮细胞、上皮细胞损伤,进而导致上皮-内皮细胞屏障破坏、通透性增加,富含蛋白质的渗出液进入肺泡造成气体交换障碍[16]。早产ARDS 患儿缺氧严重,并可继发感染、酸中毒,导致血管内皮细胞和内外源凝血途径被异常激活,患儿处于高凝状态,纤维蛋白大量产生[17]。但是,ARDS 患儿血管内皮细胞破坏明显,其产生的纤溶酶降低,加之炎症反应激活巨噬细胞释放大量PAI-1,导致体内凝血-纤溶系统平衡破坏,体内大量的纤维蛋白不能被及时溶解、消除,进而大量沉积于肺微循环血管、肺泡内,引发血液循环障碍、肺组织血气交换障碍,加重患儿病情[18-19]。此外,有研究证实,PAI-1 还可通过NF-κB 信号通路诱导小鼠肺组织炎症反应,进而加重小鼠肺纤维化程度[20]。本研究结果显示,预后不良组PAI-1 水平高于预后良好组,且可对患儿不良预后进行独立预测。提示PAI-1 可反映早产ARDS患儿病情及预测患儿预后,原因在于早产ARDS 患儿体内处于高凝状态,纤维蛋白大量形成,PAI-1 的异常释放抑制链激酶和尿激酶的纤维蛋白溶解作用,导致机体纤溶活性降低、凝血活性增高,最终导致大量纤维蛋白沉积于肺泡中而形成透明膜,加重患儿病情、引发患儿预后不良[21-25]。
本研究结果显示,cf-DNA 和PAI-1 对早产预测效能ARDS 患儿不良预后具有较好的预测效能,且二者联合进一步提升预测效能,进一步证实二者可指导临床及早评估早产ARDS 患儿病情,预测不良预后,并可据此及时制订有效干预措施。
综上所述,cf-DNA、PAI-1 水平升高是早产儿ARDS 患儿预后不良的危险因素,二者联合检测对患儿的预后具有较高的预测效能,二者有望成为评估患儿病情及预后的可靠指标。
利益冲突声明:本文所有作者均声明不存在利益冲突。
