东海乌参活性肽的制备及其抑制细胞迁移活性的研究
2024-05-13刘泽洋苏来金高畅畅朱琰麟
刘泽洋,苏来金,高畅畅,朱琰麟,陈 荫
(1.浙江海洋大学食品与药学学院,浙江舟山 316002;2.温州大学生命与环境科学学院,浙江温州 325000)
生物活性肽(bioactivity peptides)是一类源于动植物和微生物蛋白质的具有某些生物活性的化合物,是由氨基酸残基通过不同的排列方式而组成的结构简单的线性二肽到结构复杂的环形多肽的统称。袁坤山等[1]研究发现海洋生物活性多肽多嵌入蛋白质序列中,通过酶解、发酵和消化等不同的加工过程释放出来。苏来金等[2]采用响应面法优化海地瓜胶原蛋白水提工艺,并发现活性肽的来源、提取方式、氨基酸序列以及分子量大小,赋予其生物活性的多样性。
海参属棘皮动物门Echinodermata,海参纲Holothuroidea,形似黄瓜的无脊椎动物,分布范围广,是一类具有重要商业价值的海洋水产食品。叶加兰等[3]研究发现海参胶原肽结构独特,具有合成高分子不具备的生物降解性、生物相容性和低抗原性。赵芹等[4]研究发现海参多糖、海参皂苷、胶原蛋白等多种生物活性物质,具有提高机体免疫力、抗肿瘤、促进造血功能、抗凝血和降血脂等多种生理功效。赵丽等[5]研究发现海参肽具有良好的溶解性、极佳的稳定性、抗氧化性、抑制炎症、抗疲劳、抗菌、保护血管内皮细胞及促进伤口愈合等多种生物活性。朱燕芳等[6]研究表明东海乌参与其他高值海参营养成分较为相似,是一种高蛋白低脂肪的海产品,其天冬氨酸、谷氨酸、甘氨酸、丙氨酸、脯氨酸含量均超过1%,钙、铁含量也非常高。高远等[7]研究表明,岩藻糖化硫酸软骨素的硫酸软骨素与体壁胶原蛋白纤维共价相关。海参的胶原纤维是异型的,由多种类型的胶原组成。考虑到海参体壁的复杂分子组成,不同的酶解工艺可以造成酶解过程中分子的变化,得到不同性质的海参多肽和不同得率的海参多糖。对海参酶解产物的研究将有助于海参水解产物中活性多糖和多肽的生产和质量控制。
从浙江海域东海乌参活性多糖提取的副产物中,提取分离纯化多肽,并对其生物活性进行评价,为东海乌参来源多糖和多肽联合开发利用提供理论依据,使东海乌参变废为宝,促进高产量低附加值的东海乌参资源的高值化利用。
1 材料与方法
1.1 材料与试剂
试验选取的乌参Acaudina leucoprocta 采自浙江沿岸海域。
木瓜蛋白酶上海聚源生物有限公司;Bio-gei p-4 美国Bio-Rad;Q SepharoseFast Flow 上海源叶生物科技有限公司;高糖DMEM 培养基,特级胎牛血清(FBS)北京索莱宝科技有限公司;抗体β-actin,β-catenin,pho-β-catenin,C-myc,Cyclin-D1,HRP 辣根过氧化物酶(二抗)武汉爱博泰克生物科技有限公司;
实验中Folin-酚试剂、乙醇、氢氧化钾、冰醋酸、氯仿、氯化钠、正丁醇、氢氧化钠、硫酸铜、牛血清白蛋白(BSA)、四甲基偶氮(MTT)均为国药集团化学试剂有限公司分析纯试剂。
1.2 仪器与设备
YF-103 型中药粉碎机瑞安市永历制药机械有限公司;TGL-16M 型高速离心机上海卢湘仪器有限公司;HL-2 型恒流泵上海沪西分析仪器厂有限公司;DBS-100 型部分自动收集器上海沪西分析仪器厂有限公司;Easy-nLC 1200 型毛细管高效液相色谱仪Thermo Fisher Scientific (美国);TI-FL 型倒置光学显微镜日本尼康有限公司;SeriesⅡWater Jacker 型二氧化碳细胞培养箱Thermo Fisher(美国)。
1.3 实验方法
1.3.1 乌参多糖偶联多肽的提取
东海乌参主要利用的活性成分为多糖和多肽。工业化生产过程中主要将东海乌参去除内脏,清理体壁泥沙后粉碎均质后进行蛋白酶进行酶解,采用膜分离技术将多肽和多糖分离。多糖由于分子量大,被截留在膜上。研究表明,海参多糖特别是海参糖胺聚糖是以糖蛋白的形式存在的,为进一步将多糖偶联蛋白或者多肽进一步释放,将膜截留部分加入1% KOH 溶液,56 ℃木瓜蛋白酶酶解2 h 后,进一步将多糖偶联多肽释放,浓缩提取液至原体积的1/10,加入4 倍体积无水乙醇,4 ℃醇沉过夜后离心。酶解步骤参照阙凡迪等[8]的方法,沉淀为东海乌参多糖,而醇沉上清液中主要含有释放的多肽。将上清液浓缩至原体积1/20,并使用100 Da 透析袋透析除盐48 h,浓缩冷冻干燥称重,得多糖偶联多肽粗品。
1.3.2 乌参活性肽的分离纯化
冷冻干燥得到的乌参多肽粗品,以0.1 mol·L-1NaCl 为流动相,使用Bio gel p4 凝胶色谱柱(2 cm×120 cm)根据分子量进行纯化,按峰收集,自动流水透析(100 Da,48 h)后冻干得到初步纯化的乌参多肽。
对凝胶渗透柱层析分离得到的各个组分进一步采用Q SepharoseFast Flow(QFF)强阴离子柱层析对乌参多肽根据离子强度进行分离,依次采用不同浓度的NaCl 溶液进行梯度洗脱,透析浓缩后,冻干备用,得到纯化多肽。
1.3.3 乌参活性肽组分活性初筛
1.3.3.1 MTT 法检测乌参活性肽对HCT116 细胞增殖抑制作用
将各纯化样品溶液按每孔25、50、100、200 μg·mL-1的浓度进行给药,孵育箱中分别培养24 h,48 h 后加入MTT 溶液,继续培养4 h 后再加入150 μL DMSO 溶液,振摇15min 后,酶标仪570 nm 处检测吸光度OD 值。MTT 测定参照周超熙等[9]的方法。
1.3.3.2 细胞划痕法检测乌参活性肽样品对HCT116 细胞的迁移抑制能力
用移液枪头对6 孔板中的细胞进行竖直划痕,用PBS 清洗6 孔板2 次,每孔加入1 800 μL 的完全培养基和200 μg·mL-1的样品溶液,并在培养0、8、16、24 h 后对标记部位进行拍照记录。细胞划痕法参照安晓静等[10]的方法:
1.3.4 东海乌参活性多肽的序列鉴定
1.3.4.1 GT2-0 还原烷基化
将样品溶解于ddH2O,并加入二硫苏糖醇溶液,56 ℃水浴还原1 h。再加入碘乙酰胺溶液避光反应40 min,进行还原烷基化。使用自填脱盐柱脱盐,收集脱盐后的样品,于45 ℃真空离心浓缩仪中挥干溶剂。
1.3.4.2 LC-MS/MS 检测
毛细管色谱条件:分析柱:150 μm i.d.×150 mm,PepMap RPLC C18,1.9 μm,100 Å 流动相A:0.1%甲酸;流动相B:0.1%甲酸,80% ACN;流速:600 nL·min-1;每个组分分析时间:66 min。
质谱条件:一级质谱参数:Resolution:70 000;AGCtarget:3e6;MaximumIT:100 ms;Scanrange:300 to 1 800 m/z;二级质谱参数:Resolution:17 500;AGCtarget:1e5;MaximumIT:50 ms;TopN:20;NCE/stepped-NCE:28。
1.3.5 东海乌参活性肽GT2-0 对HCT116 细胞抗肿瘤活性研究
为了探究乌参活性肽GT2-0 对HCT116 细胞的增殖活性和细胞迁移抑制作用的影响,首先按1.3.4.1的方法进行MTT 实验。然后按1.3.4.2 中的方法对HCT116 细胞进行划痕实验。划痕后通过给药预先配置好的浓度为25、50、100、200 μg·mL-1的GT2-0,间隔0、8、16 和24 h 后倒置荧光显微镜下观察拍照细胞划痕面积的愈合情况。
1.3.5.1 Transwell 法检测乌参活性肽GT2-0 对HCT116 细胞迁移抑制活性
取生长状态良好的HCT116 细胞,调节细胞密度至8×103培养基总体积为180 μL 的无血清细胞悬液接种至Transwell 上室小孔,放入恒温培养箱培养至细胞稍贴壁后[11],上室加入20 μL 预先配置的GT2-0 样品溶液,GT2-0 最终浓度为25、50、100、200 μg·mL-1。给药后的Transwell 板放入培养箱中继续培养24 h。
培养结束后,使用结晶紫进行染色,用荧光倒置显微镜拍照并观察细胞迁移情况,与不加GT2-0 的空白组比较,通过GT2-0 给药组结晶紫染色情况,来评价GT2-0 对HCT116 的抑制迁移活性。
1.3.5.2 HCT116 细胞集落形成实验
取生长状态良好的细胞,将细胞接种与6 孔板中,CO2恒温孵育箱培养细胞12 h,带细胞完全贴壁后[12],每孔加入4 个浓度的GT2-0,使其终浓度为25、50、100、200 μg·mL-1,每两天更培养基并给药1 次直到细胞集落形成。
集落形成后,取出6 孔板,PBS 清洗2 次,每次1 mL,甲醇固定20~30 min,PBS 再次清洗,加入预先配置好的结晶紫染液,每孔2 mL,染色30 min 后,PBS 洗去染料,进行拍照。加入1%醋酸溶液,摇床振动15 min后,570 nm 测吸光度。
1.3.6 乌参活性肽GT2-0 对HCT116 细胞基因转录组的影响
1.3.6.1 RNA 纯度检测通过NanoDrop2000 对RNA 纯度和浓度进行检测,通过琼脂糖凝胶电泳对RNA 完整性进行检测。琼脂糖凝胶浓度:1%琼脂糖胶;电压:5 V·cm-1;时间:28 min。
1.3.6.2 RNA 文库的构建及上机测序
用寡核苷酸作引物以片段mRNA 为模板合成cDNA 第一条链,之后将RNA 降解并以dNTPs 为原料合成第二条cDNA[13]。对得到双链cDNA 进行纯化和末端修复等操作后进行PCR 扩增并通过AMPure XP beads 纯化得到文库,并用Agilent 2100 bioanalyzer 对文库进行检测确保质量,最后进行Illumina 测序。
1.3.6.3 差异表达基因组聚类分析
采用距离计算算法:样本间为spearman 相关系数,基因间为pearson 相关系数,采用的聚类方法为hcluster(complete 算法)。将样品组(GT2-0)和空白组(KB)显著差异表达的RNA 基因进行聚类分析。
1.3.6.4 差异表达基因KEGG 富集分析
通过KEGG 分析GT2-0 给药和空白组中基因转录组信号通路的差异性变化,探究GT2-0 作用HCT116 发挥抗肿瘤效果的作用机制。
1.3.7 蛋白质免疫印迹法(western blot)检测Wnt/β-catenin 通路
发生癌变的细胞主要特征表现在细胞的异常增殖和细胞周期的失控,据大量国内外文献报道[14-21],在大部分的结肠癌初期,癌细胞利用Wnt 通路对于肠道干细胞复制和代谢的调控,促使Wnt 通路异常激活,随着癌变细胞的不断增生,细胞其他的致癌基因和抑癌基因也会发生突变,从而导致肿瘤形成。MORIN,et al[22]研究表明β-catenin 作为与细胞迁移相关蛋白之一,也是β-catenin 是Wnt 通路中的关键蛋白。本课题选取Wnt/β-catenin 通路通过Western blot 实验来验证肿瘤细胞迁移抑制相关蛋白表达。
HCT116 细胞培养贴壁后,给药组加入浓度分别为25、50、100、200 μg·mL-1GT2-0 溶液。恒温培养24 h后,进行样本的制备,然后进行DS 丙烯酰胺凝胶电泳(SDS-PAGE),再转膜,抗体孵育,最后进行化学发光显影[23-25],用Alpha View SA 进行定量分析结合SPSS 分析其显著性差异。
2 结果与分析
2.1 乌参活性肽的分离纯化
海参是重要的海洋食品和药物资源,含有海参多糖、海参皂苷、海参胶原蛋白肽、海参脑苷酯、神经节苷酯等多种生物活性物质,对人体的生理功能具有重要的调节作用。其中海参多糖和海参多肽是海参活性物质中实现产业化的成分。本文以工业化生产中酶解膜过滤截留部分为原料,这部分原料以多糖为主,占比达到85%以上,而蛋白多肽占比约为10%。通过碱处理的β 消除作用和二次酶解,进一步将与海参糖胺聚糖偶联的多肽释放。
利用多肽可以部分溶解在醇溶液的特性,通过乙醇沉淀将二次酶解后的多肽与多糖分开。将东海乌参活多肽粗品通过聚丙烯酰胺Bio-gel P-4 凝胶柱进行分离纯化。根据分子量的不同,先后得到4 个组分,层析色谱图见图1,结合峰型先后命名为GT1、GT2、GT3、GT4。

图1 东海乌参多肽的凝胶色谱图Fig.1 Gel-permeation chromatogram of sea cucumber peptides
将得到的4 个组分进一步根据离子强度进行QFF 阴离子柱层析分离,梯度洗脱见图2,得到5 个组分,并将该5 个经过不同浓度NaCl 溶液洗脱后得到的组分分别命名为GT1-0.5、GT2-0、GT2-0.5、GT3-0、GT4-0。
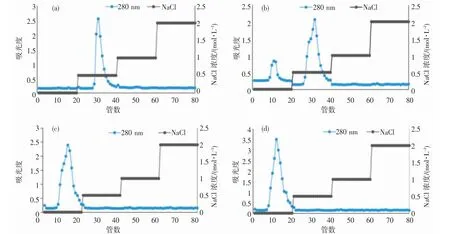
图2 QFF 柱层析上的梯度洗脱图Fig.2 Segment elution figure on QFF
2.2 乌参活性肽组分活性初筛
海参对抗癌有明显疗效,对恶性肿瘤的生长、转移具有显著抑制作用。海参中的多糖、皂苷、多肽等营养成分发现,这些营养成分具有防癌抗癌的功效,赵绿翠等[26]研究也表明其主要的机理大致有以下3 种:(1)增强细胞免疫活性;(2)抑制肿瘤细胞迁移;(3)诱导细胞凋亡。
采用MTT 法检测乌参活性肽对HCT116 细胞增殖抑制作用。如图3 所示,与空白组比较,浓度为200 μg·mL-1的5个样品组GT1-0.5、GT2-0、GT2-0.5、GT3-0、GT4-0,在给药HCT116 细胞24 h 后,细胞的增殖率分别为86.4%、80.55%、84.5%、76.5%、74.5%,表明东海乌参多肽均有弱的抑制肿瘤细胞生长的活性。

图3 GT 对HCT116 的增殖率Fig.3 The proliferation of GT to HCT116 for 24 h
通过查阅刘宝龙等[27]研究报道的有关miR-375 对结肠癌HCT116 细胞活力、细胞周期及凋亡的影响,可推测海参活性成分不仅仅可以通过细胞毒活性如海参皂苷发挥抗肿瘤活性,还可以通过抑制肿瘤细胞迁移发挥抗肿瘤作用。采用细胞划痕法检测东海乌参多肽样品对HCT116 细胞的迁移抑制能力。在浓度为200 μg·mL-1的GT1-0.5、GT2-0、GT2-0.5、GT3-0、GT4-05 个组分给药划痕后的HCT116 细胞,分别拍照并计算给药24 h 后,HCT116 细胞划痕的伤口愈合面积,并由此来衡量细胞在药物作用下的迁移能力(图4)。

图4 各组细胞划痕面积Fig.4 Scratch area of six groups
将对HCT116 细胞划痕愈合率换算成药物对HCT116细胞的迁移抑制能力,如图5 所示,实验结果表明,200 μg·mL-1GT2-0 组给药划痕后的HCT116 细胞24 h,细胞划痕的伤口愈合程度最低,对细胞的迁移抑制能力最强。因此,后续选择GT2-0 组分进行进一步抗肿瘤活性研究。

图5 不同样品组的伤口愈合率Fig.5 Wound healing rate of six sample groups
2.3 乌参活性肽GT2-0 的序列鉴定
质谱采集的raw 文件,经过软件Byonic 数据库检索,得到鉴定结果见表1,本次实验仅概述其中含量前10 个组分的二级质谱分析。

表1 GT2-0 氨基酸组成部分数据Tab.1 Partial sequences of GT2-0
经液质联用检测分析得出,GT2-0 组分主要的氨基酸序列为PSSPVSPPGYQSPR,GSTGPAGPQGPAGDR,GAPGERGDPGVAG,QQFSIGSTTVTYTFT,GQGMDRGPSGP,LPGVGPKMAHIVMD,STGPAGPQGPAGDR,QGLPGPQGPPGESIP,PGASGPLG,IGQTGPVG。从测序结果可知,东海乌参糖胺聚糖交联蛋白经过酶解主要得到分子量在650~1 500 范围内的8 肽-15 肽,以13 肽和15 肽居多,而氨基酸组成中以甘氨酸和脯氨酸居多,其次丝氨酸、苏氨酸、丙氨酸和谷氨酰胺等,氨基酸组成符合胶原蛋白氨基酸组成的主要特征,表明东海乌参中和海参糖胺聚糖偶联的蛋白属于胶原蛋白,与赵芹等[4]研究报道相符。
2.4 乌参活性肽GT2-0 的抗肿瘤活性研究
2.4.1 乌参活性肽GT2-0 对HCT116 的增殖抑制作用
GT2-0 分别给药HCT116 细胞24、48 h 后,探讨不同浓度的GT2-0 对细胞增殖率的影响,将细胞增殖率转换成细胞抑制率,结果见图6,GT2-0 对细胞的增殖抑制活性表现为随浓度增加和给药时间的延长其抑制效果更明显,为了避免因GT2-0 长时间给药对细胞活性的抑制作用,所以后续的细胞划痕实验选择25、50、100、200 μg·mL-14 个浓度的GT2-0,给药时间为24 h。
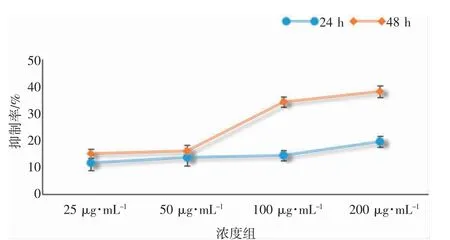
图6 GT2-0 对HCT116 作用24、48 h 的抑制率Fig.6 The inhibition rate of GT2-0 on HCT116 for 24,48 h
2.4.2 细胞划痕法检验乌参活性肽GT2-0 对HCT116 的迁移抑制作用
分析比较不同药物浓度和不同给药时间对HCT116 细胞迁移的影响,结果见图7,control 组,划痕0~24 h 内,前8 h 内划痕愈合率为25%左右,随后愈合率虽然随时间而增加,但增长速度变缓。GT2-0 给药8 h,control 组和低浓度组(25 μg·mL-1)浓度组,划痕愈合率相差不大,而中高浓度组(50~200 μg·mL-1)划痕愈合率降低,与control 组无显著性差异。给药16 h,与control 组比较,低浓度组和高浓度组的划痕愈合率降低,且中高浓度组具有显著性。给药24 h,与control 组比较,低浓度组和中高浓度组的划痕愈合率随浓度依赖降低,且在中高浓度组降低具有显著性差异。综上所述,HCT116 细胞的划痕愈合率随着GT2-0 浓度的增加(50~200 μg·mL-1浓度范围内)以及给药时间延长(16~24 h 范围内)而显著降低,这也证明了GT2-0对HCT116 细胞具有迁移抑制效果。

图7 空白组以及0、8、16、24 h 时不同浓度GT2-0 组分细胞的伤口愈合率Fig.7 Wound healing rate of GT2-0 cells in blank group and at 0,8,16 and 24 h
2.4.3 Transwell 法检测乌参活性肽GT2-0 对HCT116 细胞的迁移抑制作用
Transwell 实验可以从结晶紫染色后颜色的深浅程度来评价细胞迁移的能力,结晶紫颜色与细胞迁移能力呈负相关,即颜色越深则表明迁移能力越弱。如图8 所示,可以明显看出空白组中结晶紫颜色更深,说明空白组中HCT116 细胞迁移数量多,而加入乌参活性肽GT2-0 作用后颜色变浅,则说明细胞明显迁移数量变少,且随着GT2-0 浓度的升高,结晶紫染色越浅,说明GT2-0 对HCT116 细胞迁移的抑制能力具有浓度依赖性。可见Transwell 实验也证实了GT2-0 对HCT116 细胞迁移能力的抑制作用。
2.4.4 HCT116 细胞集落形成实验
陶弋婧等[28]研究发现HCT116 肿瘤细胞在适宜的环境中可以实现增殖和细胞迁移,细胞集落实验可以检验药物对活细胞增殖能力的影响,如图9 所示,为HCT116 细胞结晶紫染色后的图片,将吸光度换算成集落形成率,以control 组为对照,如图10 所示,结果表明,高浓度的GT2-0 能显著降低集落形成率,在25~100 μg·mL-1的浓度范围内具有浓度依赖性,200 μg·mL-1浓度GT2-0 对细胞集落形成与100 μg·mL-1相比,细胞集落形成率虽然有所提高,但无显著性(P<0.05)。实验结果表明,GT2-0 对HCT116 细胞的增殖具有抑制作用。

图9 不同浓度GT2-0 给药HCT116 的剂量形成图片Fig.9 Colony formation pictures of HCT116 treated with different concentrations of GT2-0

图10 不同浓度的GT2-0 对HCT116 细胞的菌落形成率Fig.10 Colony formation rate of HCT116 treated with different concentrations of GT2-0
2.4.5 乌参活性肽GT2-0 对HCT116 细胞基因转录组的影响
2.4.5.1 差异表达
借鉴梁曾恩妮等[29]研究方法,采用DESeq 对基因表达进行差异分析,筛选差异表达基因条件为:表达差异倍数|log2FoldChange|>1,显著性<0.05。不同分组之间的差异表达基因统计结果见表2。

表2 空白组与GT2-0 给药组基因的差异性表达Tab 2 The difference of Gene expression between KB and GT2-0
2.4.5.2 GO 功能注释分析
参考关丽娜等[30]实验分析方法对差异表达的基因的GO 富集进行结果分析,并且对每个GO 分类挑选出p-value 最小即富集最显著的前10 个GO term 条目进行展示,结果见图11。结果表明,KB 组与GT2-0给药组相比较,在生物学过程(BP)中,表皮生长因子以及ERBB 信号通路的都呈正向调节趋势,说明GT2-0 可以抑制HCT116 增殖和迁移,与之前的MTT 实验和划痕实验结果一致。
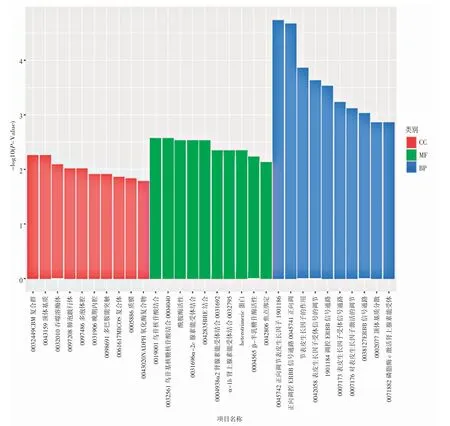
图11 KB VS GT200 差异表达基因的GO 注释图Fig.11 GO Annotation of Differential Genes in HCT116
2.4.5.3 KEGG 富集分析
将空白组(KB)与GT2-0 给药组中所有基因为参照对比差异性表达基因进行KEGG 富集分析。挑选FDR 值最小的即富集最显著的前20 条KEGG pathway 进行展示,结果见图12。结果表明,与KB 组比较,GT2-0 给药后的HCT116 细胞,其机制与cGMP-PKG、NF-κB、T 细胞受体以及B 细胞受体等信号通路相关。

图12 KEGG 富集通路Fig.12 KEGG pathway enrichment
2.4.6 Western blot 检测对HCT116 细胞迁移抑制蛋白表达
通过基因转录组分析可知,与空白组比较,乌参活性肽GT2-0 给药组细胞中的蛋白表达与ERBB,NF-κB 等通路相关,而这些通路与细胞增殖活性和细胞迁移运动相关,通过查阅罗欢等[31]研究也发现βcatenin 作为与细胞迁移相关蛋白之一,也是β-catenin 是Wnt 通路中的关键蛋白。本课题选取Wnt/βcatenin 通路通过Western blot 实验来验证肿瘤细胞迁移抑制相关蛋白表达。
2.4.6.1 乌参活性肽GT2-0 对HCT116 结肠癌细胞中总β-catenin 蛋白的表达
实验结果如图13 所示,GT2-0 以25、50、100、200 μg·mL-1给药细胞24 h 后,通过Western blot 检测细胞迁移通路Wnt/β-cetenin 相关蛋白β-catenin、p-β-catenin、C-myc、Cyclin-D1 表达情况,结果表明细胞内总的β-catenin 下调,磷酸化的β-catenin 显著上调,下游蛋白C-myc、Cyclin-D1 表达均呈浓度依赖下调趋势。说明GT2-0 通过引起总β-catenin 蛋白磷酸化,使得细胞内总的β-catenin 减少,β-catenin 入核降低抑制下游的靶基因C-myc、Cyclin-D1 抑制细胞迁移,从而发挥抗肿瘤效果。

图13 蛋白质印迹法检测细胞迁移通路相关蛋白的表达Fig.13 The expression of proteins related to cell migration pathway was detected by western blot
3 总结与讨论
该研究从东海乌参酶解醇沉上清液中,提取活性肽,经过Bio gel P-4 凝胶柱层析,得到4 个组分后再进行QFF 强阴离子柱层析分离纯化,得到纯化后的5 个组分。通过HCT116 细胞划痕活性初筛,结果表明,GT2-0 最具有HCT116 细胞迁移抑制活性,因此,对GT2-0 组分分别进行结构分析和抗肿瘤实验。LCMS 得出GT2-0 主要的氨基酸序列为PSSPVSPPGYQSPR,GSTGPAGPQGPAGDR,GAPGERGDPGVAG,QQFSIGSTTVTYTFT,GQGMDRGPSGP,LPGVGPKMAHIVMD,STGPAGPQGPAGDR,QGLPGPQGPPGESIP,PGASGPLG,IGQTGPVG。抗肿瘤活性试验表明了GT2-0 对人结肠癌HCT116 细胞具有增殖抑制以及迁移抑制活性,随后空白组和GT2-0 给药HCT116 细胞组比较分析其基因显著性差异表达,并进行KEGG 通路富集,结果表明与空白组相比,GT2-0 参与细胞表皮生长因子,ERBB,NF-κB 等信号通路,发挥抗肿瘤的作用。实验中,仅选取与细胞迁移相关的Wnt/β-catenin 通路进行Western Blot 实验,结果表明,与空白组比较,GT2-0 可以显著降低细胞内总β-catennin 蛋白表达,增加磷酸化β-catennin 蛋白表达,C-myc 蛋白以及Cyclin-D1 蛋白表达显著降低。
综上所述,该研究通过对东海乌参活性肽进行分离提取纯化,结构解析和抗肿瘤活性分析,表明该活性肽存在良好的抗结肠癌肿瘤活性,为将来东海乌参的进一步开发利用提供了理论依据。
