创伤性膝骨关节炎患者血清CX3CL1、Apelin-13与炎症指标的相关性及预后价值
2024-05-13吕新凯李光磊段强民王宝鹏孙全省
吕新凯,李光磊,段强民,王宝鹏,张 平,孙全省,张 冰
山东省淄博市临淄区人民医院骨科一病区,山东淄博 255400
骨关节炎(OA)多发于负重关节,是一种退行性的关节病,主要特征为关节软骨退化[1]。创伤性膝骨关节炎(PTOA)是继发关节损伤后的并发症,约占OA的12%,常见于踝关节和膝关节,有研究发现,PTOA患者比其他类型的OA患者年轻约10.4岁[2]。随着社会生活节奏的加快,交通意外及运动损伤逐渐增多,PTOA的发病率也在逐年升高,所以加强对PTOA发生与发展过程的研究对于PTOA的临床诊断及治疗具有重要意义。有研究发现,炎症介质的产生在OA的发病进程中能发挥关键作用,OA的影像分级与血清中多种炎症标志物有关[3]。
CX3CL1是一种具有促炎反应功能及趋化功能的跨膜糖蛋白。CX3CL1以可溶或者膜结合两种形式存在,具有趋化性和黏附的两重属性[4]。CX3CL1可以进行单核细胞募集和活化T淋巴细胞,从而释放促炎抑制参与多种疾病的炎症反应过程[5]。脂肪细胞因子(Apelin)属于人G蛋白受体的内源性配体,Apelin-13是Apelin家族成员中的一员,Apelin在人成骨细胞中也有表达,有研究显示,Apelin基因敲除的小鼠,骨矿化及骨形成的程度均加深,Apelin可能与关节软骨的代谢过程相关,且骨损害越严重的糖尿病患者血清Apelin-13的表达水平越低[6-7]。通过文献查阅CX3CL1与Apelin-13可能均与PTOA的发生相关,目前关于血清CX3CL1与Apelin-13在PTOA的表达水平的报道尚不多见,本文对PTOA患者血清CX3CL1与Apelin-13的表达水平进行探讨,并分析二者与炎症指标的相关性及患者预后的价值,以期为探索PTOA的治疗方法及发病机制提供帮助。
1 资料与方法
1.1一般资料 选取2020年1月至2022年2月在本院确诊的65例PTOA患者作为试验组,其中男35例,女30例,平均年龄(55.46±6.68)岁;另选取同期于本院健康体检的55例体检健康者作为对照组,其中男28例,女27例,平均年龄(54.62±6.75)岁。试验组纳入标准:(1)符合《骨关节炎诊断及治疗指南》中PTOA诊断标准[8],影像学检验证实存在膝骨关节炎。(2)患者均有膝关节创伤史,膝关节肿胀、疼痛、腿部屈伸是存在阻碍,膝关节活动时有摩擦音。(3)膝关节边缘存在不同程度的骨刺,软骨下关节面硬化。试验组排除标准:(1)类风湿性关节炎、痛风、膝盖损伤、糖尿病、化脓性关节炎及非创伤性关节炎者;(2)有传染性疾病者。对照组纳入标准:(1)年龄>18岁;(2)意识清晰,依从性良好,身体健康。本研究经过本院的伦理委员会批准,所有受检者均详细知晓本研究内容并签署知情同意书。
1.2方法
1.2.1主要试剂及仪器 CX3CL1酶联免疫吸附试验(ELISA)试剂盒购自上海酶联生物科技公司,Apelin-13 ELISA试剂盒购自上海科艾博生物公司,白细胞介素-6(IL-6)、瘦素、肿瘤坏死因子-α(TNF-α)ELISA试剂盒(货号:SP10234、SP10126、SP10205)购自武汉塞培生物科技有限公司、降钙素原(PCT)试剂盒(货号:231465)购自上海凯创生物技术有限公司、超敏C反应蛋白(hsCRP)试剂盒(货号:06522059)购自上海西门子医学诊断产品有限公司,DW-86L828J,超低温冰箱购自弘林科学仪器公司,PHOMO型酶标仪购自贝登医疗有限公司,OLMPUS AU2700全自动生化分析仪及化学发光分析仪购自万孚生物公司,QD-S300免疫荧光分析仪购自南京诺唯赞医疗科技有限公司,牛顿光学(Newtonoptic)CytoEasy全自动高通量细胞计数仪分析仪购自昊扩科器公司。
1.2.2标本采集及实验方法 所有受试者均需要禁食10 h,于次日清晨采集空腹静脉血4 mL,取1.5 mL血液样本,采用牛顿光学细胞计数仪检测白细胞计数(WBC),将3.5 mL转移至高速离心机内,2 500 r/min离心10 min,离心半径为10 cm,吸取试管中最上层的血清置于超低温冰箱待用。
使用ELISA试剂盒检测血清中IL-6、瘦素、TNF-α、CX3CL1与Apelin-13的表达水平,试验步骤严格按照试剂盒说明书进行,采用免疫化学发光法检测PCT表达水平,采用免疫散射比浊法测定hsCRP表达水平。
1.2.3随访及预后评定 对所有患者出院后进行为期1年的随访,随访方式主要为门诊复查,并对最后一次随访时的膝关节功能进行记录,随访截止时间为2023年2月28日。依据膝关节功能评分标准[9],将PTOA患者分为预后不良组39例(<70分),预后良好组26例(70~100分)。
2 结 果
2.1PTOA患者一般资料、炎症指标与血清CX3CL1和Apelin-13的表达水平情况 两组在性别及年龄方面比较,差异无统计学意义(P>0.05)。与对照组相比,试验组中的炎症指标IL-6、瘦素、PCT、hsCRP、TNF-α、WBC均呈上升趋势,其中IL-6、瘦素、PCT、hsCRP、TNF-α的表达水平显著升高,差异具有统计学意义(P<0.05),试验组中血清CX3CL1的表达水平显著升高,Apelin-13的表达水平显著下降,差异具有统计学意义(P<0.05)。见表1。

表1 PTOA患者一般资料、炎症指标与血清CX3CL1和Apelin-13的表达水平情况 [n(%)或
2.2血清CX3CL1和Apelin-13与炎症指标相关性分析 Pearson法相关性分析显示,CX3CL1与IL-6、瘦素、TNF-α呈正相关(r=0.528、0.526、0.602,P<0.001)。Apelin-13与IL-6呈负相关(r=-0.541,P<0.001)。见表2。
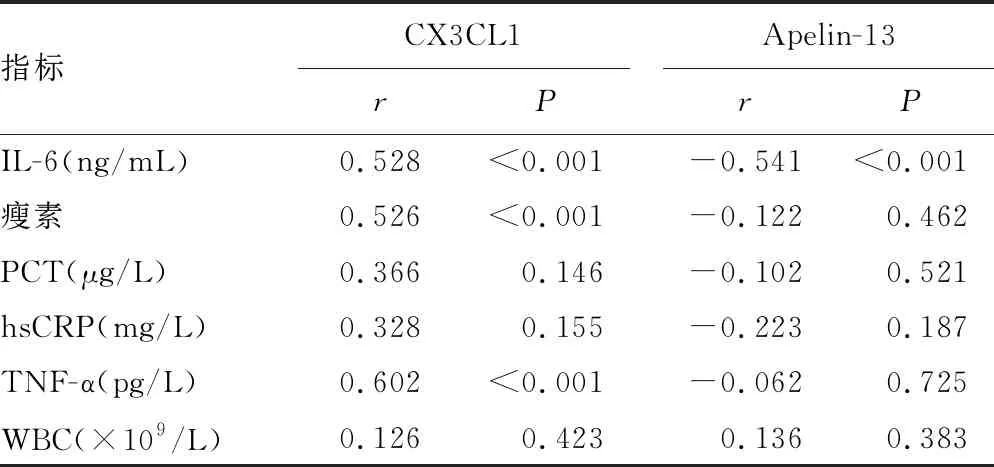
表2 血清CX3CL1和Apelin-13与一般炎症指标相关性分析
2.3不同预后炎症指标与血清CX3CL1和Apelin-13的表达情况 对患者进行为期1年的随访,结果显示,预后不良发生率为60.00%。与预后良好组相比,预后不良组的IL-6、瘦素、PCT、hsCRP、TNF-α及CX3CL1的水平显著升高,差异有统计学意义(P<0.05),Apelin-13的表达水平显著降低,差异有统计学意义(P<0.05)。见表3。
表3 不同预后炎症指标与血清CX3CL1和Apelin-13的表达情况
2.4血清CX3CL1与Apelin-13预测PTOA预后不良的诊断价值分析 ROC曲线结果显示,血清CX3CL1和Apelin-13水平预测预后不良的AUC分别为0.759(95%CI:0.637~0.857)、0.806(95%CI:0.689~0.893);截断值分别为135.04 pg/mL、19.66 ng/L;CX3CL1灵敏度为87.2%,特异度为80.8%;Apelin-13灵敏度为92.3%,特异度为84.6%;血清CX3CL1和Apelin-13联合预测的AUC为0.893(95%CI:0.791~0.956),灵敏度为97.4%,特异度为76.9%。与血清CX3CL1和Apelin-13单独指标相比,CX3CL1联合Apelin-13检测预后不良的AUC较高(Z联合-CX3CL1=2.010,P=0.044;Z联合-Apelin-13=2.091,P=0.036),见表4。
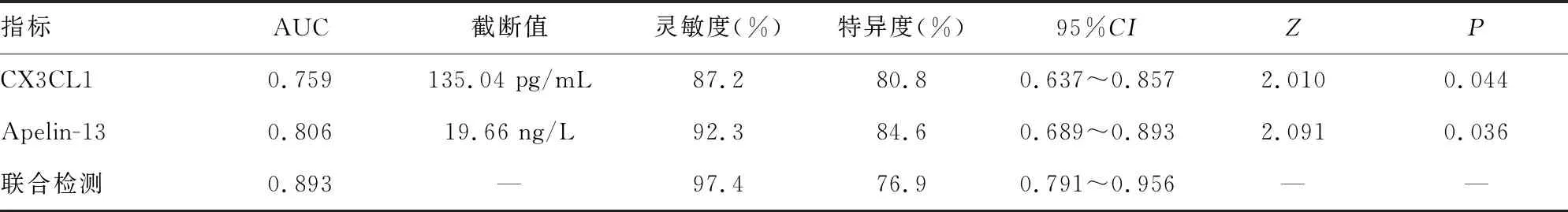
表4 血清CX3CL1与Apelin-13预测PTOA预后不良的诊断价值分析
2.5多元Logistic回归分析PTOA预后不良的影响因素 以PTOA预后不良为因变量,以表3中有差异的因素及血清CX3CL1与Apelin-13进行多因素Logistic回归分析,结果显示IL-6、瘦素、TNF-α、CX3CL1与Apelin-13是PTOA预后不良的影响因素(P<0.05)。见表5。

表5 PTOA预后不良的多元Logistic回归分析
3 讨 论
PTOA的主要病理变化表现为创伤引起患者关节软骨退化变性及继发性的骨质增生,主要临床表现为活动障碍,关节疼痛,疾病进一步发展可导致患者残疾,对患者的日常生活及心理造成严重伤害[10-11]。PTOA的致病机制可以分为三个阶段,第一阶段是即时阶段,与膝关节损伤期间和之后的病理机械负荷有关,第二阶段直接发生在即时阶段之后,并持续到受伤后的几周之内。这一阶段的特征是急性炎症期,这一时期会发生细胞外基质碎裂,细胞死亡和在某些情况下的关节积血。这个阶段可以在几个月后自行消退,也可以持续并进展到第三阶段,其慢性炎症状态伴滑膜炎,最终导致PTOA的发生与发展[12]。越来越多的研究表明炎症在PTOA的发展中发挥着关键作用,炎症可能会因为患者关节积血而进一步加重患者病情[13-15]。为了更好的治疗患者,开发抗炎疗法是PTOA患者临床治疗及预后的新方向,本研究就PTOA患者血清中CX3CL1与Apelin-13的表达水平进行探索,以期能为PTOA的预后及病理生理机制分析提供帮助。
CX3CL1是一种独特的趋化因子,表现为跨膜蛋白,经过蛋白水解处理可以产生可溶性趋化因子。CX3CL1包含373个氨基酸长度,具有N端趋化因子结构域(含有77个氨基酸受体结合的结构域)。CX3CL1分子在细胞膜受到各种脱落酶的切割,例如,金属蛋白酶结构域的蛋白10(ADAM10)、肿瘤坏死因子-α转换酶(TACE),其能够在炎症反应期间诱导TNF-α并将其加工成活性形式[16]。CX3CL1在神经元中产生,最初被翻译为跨膜蛋白,可以通过蛋白水解产生可溶性趋化因子,CX3CL1通过其唯一的受体CX3CR1释放信号,CX3CR1位于中枢神经系统(CNS)内的小胶质细胞上,尽管CX3CL1的膜结合形式与可溶性形式都与CX3CR1相互作用,但它们具有不同的信号转导能力,有研究表明,CX3CL1在CNS内的主要功能是减少促炎反应,是神经的保护因素[17]。有研究显示,CX3CR1在冠心病患者外周血T细胞中大量表达,表明在患者的冠状动脉斑块内发生了炎症反应,存在于外周血T细胞中的CX3CR1被激活,进一步激活了体内T细胞,引发炎症反应的级联反应,加深了炎症反应的程度[18]。本研究中PTOA患者血清CX3CR1的表达水平较对照组上升了约1.4倍,表明CX3CR1参与了PTOA发生发展期间的炎症反应,可能是通过激活免疫反应中的T细胞引发炎症级联反应来加剧病情的发展。Pearson法相关性分析显示CX3CL1与IL-6、瘦素、TNF-α呈显著正相关,这表示CX3CL1可能是促进了炎症因子的分泌,进一步加重了炎症反应,后续还需扩大实验范围进一步研究CX3CL1在PTOA的作用机制。
Apelin是位于染色体Xq25-26.1上的多肽,由APLN基因产生,可以与G蛋白偶联受体(APJ)发生结合,进而参与多种生理过程。依据终产物氨基酸的长度不同可以划分出3种类型,包括Apelin-13、Apelin-17、Apelin-36,长度越短的多肽活性越强[19]。研究显示,Apelin-13作为一种内源性肽,可以合成神经营养因子及抑制炎症反应,具有很强的神经保护作用,给予Apelin-13注射的大鼠体内TNF-α及IL-1β的水平被抑制[20]。相关研究显示,在2型糖尿病骨质疏松患者血清中Apelin-13表达水平下降,其可以激活骨细胞内的信号分子,促进骨细胞的增殖,骨质损伤越严重则Apelin-13表达水平越低[7]。在本研究中,PTOA患者血清apelin-13表达水平显著下降,可能是因为PTOA患者体内炎性因子过多导致细胞受损,进而导致了Apelin-13的表达水平下降。与之相反,Apelin在膝骨关节炎(KOA)患者中表达水平升高,其与KOA患者膝关节局灶脂质代谢相关[21]。原因可能是Apelin-13与Apelin参与炎症反应发挥的作用存在差异,具体原因还需要进一步探索。Apelin-13与IL-6呈负相关,表明Apelin-13对炎症有抑制作用,这与Apelin-13在AD的作用相同,下一步将扩大样本量验证Apelin-13在PTOA中的表达水平并探索其在PTOA发病机制中的作用。
多元Logistic回归分析结果显示,CX3CL1与Apelin-13是PTOA预后不良的影响因素,说明在PTOA的发生与发展中,CX3CL1与Apelin-13可能发挥重要作用。ROC曲线下面积表明,血清CX3CL1和Apelin-13水平预测预后不良的AUC分别为0.759、0.806,均具有较好的预测价值,但二者联合检测的AUC更高,说明CX3CL1和Apelin-13联合检测PTOA预后不良的诊断价值更高,可能为PTOA的预后治疗提供参考。
综上所述,PTOA患者血清CX3CL1的表达水平显著升高,Apelin-13的表达水平显著下降,二者是PTOA患者预后不良的影响因素,联合检测CX3CL1与Apelin-13对PTOA患者预后提供帮助,CX3CL1与Apelin-13有望成为PTOA预后的潜在分子生物标志物。本研究的不足之处是未对CX3CL1,Apelin-13表达水平与PTOA发病阶段进行深入研究,后期将扩大样本量进一步分析CX3CL1与Apelin-13与PTOA的发病阶段是否具有相关性,以及二者在PTOA疾病发展中的作用机制,为PTOA的预后及病理机制研究提供参考。
