TFAP2A对肾小球硬化相关基因ADCK4转录调控机制的研究
2024-05-13张小田任献国
张小田 任献国

基金項目:江苏省自然科学基金项目(M2020022)
作者单位:南京医科大学附属逸夫医院儿科(邮编211112)
作者简介:张小田(1986),女,主治医师,主要从事儿童肾脏疾病方面研究。E-mail:zxt870818@163.com
△通信作者 E-mail:renxianguo@126.com
摘要:目的 探索细胞中TFAP2A对局灶节段性肾小球硬化(FSGS)相关基因含aarF结构域的激酶4(ADCK4)的转录调控机制及TFAP2A与ADCK4是否存在特定的结合区域。方法 生物信息学分析肾小球硬化基因火山图,ADCK4及TFAP2A表达水平的关系。JASPAR数据库预测ADCK4基因转录起始位点-464 bp/+206 bp区域包含TFAP2A转录因子结合位点;TFAP2A siRNA浓度分别为5、10、15 μmol/L,TFAP2A过表达质粒质量浓度分别为50、100、300 ?g/L,通过双萤光素酶报告基因实验验证TFAP2A对ADCK4基因启动子水平的调控作用。TFAP2A siRNA及TFAP2A过表达质粒转染细胞,实时荧光定量PCR检测TFAP2A、ADCK4 mRNA表达,蛋白免疫印迹实验检测TFAP2A、ADCK4蛋白表达。染色质免疫沉淀试验验证TFAP2A与ADCK4启动子的特定区域结合。结果 生物信息学分析显示FSGS肾组织中RNA-Seq RNA表达上调的基因273个,表达下调的基因219个;ADCK4与TFAP2A表达水平呈正相关(P<0.01)。双萤光素酶报告基因实验证明TFAP2A siRNA浓度为10、15 μmol/L的ADCK4启动子相对萤光素酶活性增强,TFAP2A过表达质粒质量浓度为100、300 ?g/L的ADCK4启动子萤光素酶活性降低(P<0.05)。与对照组相比,实验组ADCK4 mRNA和蛋白表达水平升高;过表达实验中,与对照组比较,实验组ADCK4 mRNA和蛋白表达水平降低(P<0.05)。染色质免疫沉淀试验发现TFAP2A能与ADCK4启动子的特定区域结合。结论 转录因子TFAP2A负向调控ADCK4基因表达,增加了调控足细胞重要基因的转录因子成员。
关键词:肾小球硬化症,局灶节段性;转录因子AP-2;启动区,遗传;转录调控;含aarF结构域的激酶4
中图分类号:R726.92 文献标志码:A DOI:10.11958/20231028
Transcriptional regulation of TFAP2A on glomerulosclerosis-related gene ADCK4
ZHANG Xiaotian, REN Xianguo△
Department of Pediatrics, Sir Run Run Hospital, Nanjing Medical University, Nanjing 211112, China
△Corresponding Author E-mail: renxianguo@126.com
Abstract: Objective To exploring the mechanism of transcriptional regulation of TFAP2A on glomerulosclerosis-related gene aarF structural domain-containing kinase 4 (ADCK4) in cells and the specific binding region between TFAP2A and ADCK4. Methods Bioinformatics was used to analyze volcano map of glomerulosclerosis genes, and the relationship between ADCK4 and TFAP2A expression levels. JASPAR database was used to predict that ADCK4 gene transcription start site -464 bp/+206 bp region containing TFAP2A transcription factor binding site. TFAP2A siRNA concentrations were 5, 10 and 15 μmol/L, and the mass concentrations of TFAP2A overexpression plasmid were 50, 100 and 300 ?g/L, respectively. The regulatory effect of TFAP2A on the promoter level of the ADCK4 gene was verified by dual-luciferase reporter gene assay. TFAP2A siRNA and TFAP2A overexpression plasmid were used to transfect cells. Real-time fluorescence quantitative PCR was used to detect TFAP2A and ADCK4 mRNA expression. Protein immunoblotting assay was used to detect TFAP2A and ADCK4 protein expression. Chromatin immunoprecipitation assay was used to confirm TFAP2A binding to a specific region of the ADCK4 promoter. Results Bioinformatics analysis showed that 273 genes were up-regulated and 219 genes were down-regulated. The expression levels of ADCK4 and TFAP2A were positively correlated (P<0.01). Dual luciferase reporter gene assay demonstrated that the relative luciferase activity of ADCK4 promoter was enhanced with TFAP2A siRNA concentrations of 10 and 15 μmol/L, and that the luciferase activity of ADCK4 promoter was reduced when TFAP2A overexpression plasmid mass concentrations of 100 and 300 ?g/L (P < 0.05). ADCK4 mRNA and protein expression levels were increased in the TFAP2A siRNA group compared with the control siRNA group. ADCK4 mRNA and protein expression levels were decreased in the TFAP2A overexpression plasmid group compared with the pENTER plasmid group (P<0.05). Chromatin immunoprecipitation assay revealed that TFAP2A can bind to specific regions of ADCK4 promoter. Conclusion Negative regulation of ADCK4 gene expression by the transcription factor TFAP2A increases the number of transcription factor members that regulate genes important for podocytes.
Key words: glomerulosclerosis, focal segmental; transcription factor AP-2; promoter region, genetic; transcriptional regulation; aarF structural domain-containing kinase 4
局灶节段性肾小球硬化(FSGS)在肾小球疾病中所占比例逐年上升,在儿童肾小球疾病病理中FSGS占20%[1]。病理类型为FSGS的患者中激素耐药的比例达36%[2]。FSGS终末期肾病的发生率约为50%[3],FSGS是腎功能衰竭的主要原因[4]。目前FSGS的发病机制尚未完全明确,30%的激素耐药肾病综合征患儿是由单基因病引起[5]。目前认为多种足细胞骨架蛋白损伤均可能导致FSGS,例如含aarF结构域的激酶4(ADCK4)、肌动蛋白α4(ACTN4)、瞬态受体电位阳离子通道C亚家族成员6(TRPC6)及倒转形成蛋白2(INF2)等,其中ADCK4定位在线粒体和足细胞足突上,与辅酶Q6(COQ6)发生内源性相互作用[6]。目前严重肾病综合征和快速进展患者的治疗方法仍有限[7]。对原发性FSGS发病机制的研究仍鲜见,其中基因编辑及转录调控机制研究甚少。激活蛋白2(AP-2)转录因子于1987年首次从HeLa细胞中纯化出来[8],AP-2转录因子蛋白家族包括TFAP2A、TFAP2B、TFAP2C、TFAP2D和TFAP2E。已有研究表明TFAP2A是肾脏发育过程中肾单位分化的新型分子[9],其在远曲小管分化中起到关键作用[10],抑制TFAP2A活性可调节肾单位节段发育[11],促进细胞凋亡[12]。然而,TFAP2A对FSGS的影响及作用机制研究鲜见。本研究通过探究TFAP2A能否调控ADCK4表达,TFAP2A与ADCK4启动子是否存在特异性结合区域,为FSGS的防治提供理论依据。
1 材料与方法
1.1 实验材料 人胚肾293T细胞系(HEK-293T)、萤光素酶报告基因质粒pGL3-Basic、pTFAP2A质粒及pENTER对照质粒为本实验室保存;载有ADCK4启动子-464 bp/+206 bp的pGL3-Basic购自上海捷瑞工程有限公司;实时荧光定量PCR(qRT-PCR)试剂盒(美国Bimake);胎牛血清(美国Gibco);LipofectamineTM3000转染试剂(美国Invitrogen);双萤光素酶报告基因检测试剂盒(美国Promega);总蛋白提取试剂盒(南京凯基生物技术股份有限公司);GAPDH抗体(美国Proteintech);Total RNA Kit Ⅰ(美国ABI);转染试剂p3000(美国Invitrogen);TFAP2A siRNA及其对照control siRNA(上海吉玛制药技术有限公司)。GAPDH、TFAP2A及ADCK4均为人源基因。兔TFAP2A抗体(美国Abcam),兔ADCK4抗体(美国Affinity公司)。辣根过氧化物酶标记的山羊抗兔IgG(上海碧云天生物技术有限公司)。PVDF膜(美国Schleicher and Schuell Bioscience)。OMEGA plasmid mini kit Ⅰ(美国Omega公司小量质粒提取试剂盒)。PCR热循环仪(美国PE,PE-2400型);荧光定量PCR仪(美国Applied Biosystems,PRISM7500);伯乐凝胶成像仪(伯乐ChemiDocXRS,美国)。
1.2 方法
1.2.1 生物信息学分析 利用生物信息学(Gene Expression Omnibus,GEO)数据库,在GSE108113高通量数据集中分析FSGS高表达及低表达基因火山图,Gene Expression Profiling Interactive Analysis(GEPIA)数据库中分析肾透明细胞癌中ADCK4及TFAP2A表达水平的关系。使用JASPAR数据库(http://jaspar2018.genereg.net/)预测ADCK4基因转录起始位点上游-464 bp/+206 bp区域包含TFAP2A转录因子结合位点。
1.2.2 细胞培养及实验分组 从-70 ℃冰箱中取出冻存的HEK-293T细胞,放入37 ℃、5%CO2培养箱内培养,按照1∶3比例传代。实验分为对照组和实验组,siRNA实验对照组用control siRNA,实验组用TFAP2A siRNA转染细胞,检测萤光素酶活性、mRNA及蛋白质表达情况;过表达对照组用pENTER,过表达实验组用TFAP2A过表达质粒,检测萤光素酶活性、mRNA及蛋白质表达情况。siRNA序列见表1。
1.2.3 真核细胞瞬时转染及双萤光素酶报告基因实验 将HEK-293T细胞接种于96孔板中,按LipofectamineTM3000使用说明书进行质粒转染。TFAP2A siRNA(浓度分别为5、10、15 μmol/L)、对照control siRNA及pGL3-464 bp/+206 bp质粒转染至HKE-293T细胞中。过表达实验TFAP2A过表达质粒(质量浓度分别为50、100、300 ?g/L),对照空载过表达质粒pENTER及pGL3-464 bp/+206 bp质粒转染至HEK-293T细胞中,转染24 h后多功能酶标仪进行双萤光素酶报告基因实验验证TFAP2A对ADCK4基因启动子的调控作用。
1.2.4 qRT-PCR检测细胞中TFAP2A和ADCK4 mRNA的表达 按Total RNA kitⅠ试剂盒说明书提取12孔板中处理过的HEK-293T细胞总RNA,并逆转录成cDNA。逆转录条件:37 ℃ 15 min,85 ℃ 5 s,所得产物4 ℃保存。按照美国Applied Biosystems公司PRISM7500荧光定量PCR说明书配好反应体系(20 ?L):2×SYBR Green qRCR Master Mix 10 ?L,cDNA 2 ?L,上、下游引物各1 ?L,ROX Reference Dye 0.4 ?L,ddH2O 5.6 ?L。扩增反应条件:95 ℃预变性10 min;95 ℃ 15 s,60 ℃ 30 min,72 ℃ 30 s,共40个循环。以GAPDH为内参,采用2-ΔΔCt法计算mRNA相对表达量。引物序列见表2。
1.2.5 蛋白免疫印迹实验(Western blot)检测TFAP2A和ADCK4蛋白的表达 将1×105个细胞接种至6孔板,贴壁后分别用siRNA或过表达处理细胞48 h后收集细胞,样本经10%SDS-聚丙烯酰胺凝胶电泳(100 V)恒压分离,然后按照凝胶面积以0.65 mA/cm2横流电转移1.5 h将蛋白自凝胶转印至PVDF膜,PVDF膜经5%脱脂奶粉封闭2 h,分别加ADCK4(1∶2 000)、TFAP2A(1∶5 000)和GAPDH抗体(1∶2 000),免疫杂交过夜(12~16 h);TBST漂洗后加入适量辣根过氧化物酶标记的山羊抗兔IgG(1∶2 000)后封膜,37 ℃搖床2 h;TBST漂洗,伯乐凝胶成像仪曝光,以GAPDH为内参,实验重复3次。
1.2.6 染色质免疫沉淀(ChIP)扩增含有TFAP2A结合位点的ADCK4启动子序列 使用EZ-Magna ChIPTM试剂盒(17-10086)进行ChIP检测,待细胞生长至1×107个,加37%甲醛固定,超声打断细胞DNA至DNA片段在200~1 000 bp,用2%琼脂糖凝胶对10 ?L DNA产物进行电泳,紫外灯下可见大部分DNA片段位于200~1 000 bp,DNA-Protein交联,解交联DNA-Protein合物,进行DNA纯化。PCR反应体系:DNA 2.0 ?L、ddH2O 12.6 ?L、10×PCR Buffer 2.0 ?L、MgCl2(50 mmol/L)0.6 ?L、2.5 mmol/L dNTP 1.6 ?L、Control Primers/ADCK4 ChIP primers 0.8 ?L、Taq(5 U/?L)0.4 ?L、Total Volume 20 ?L,震荡混合均匀短暂离心。PCR反应条件:94 ℃预变性3 min;94 ℃变性20 s,59 ℃退火30 s,72 ℃延伸30 s,循环32次;72 ℃延伸2 min。用2%琼脂糖凝胶电泳对PCR产物进行电泳。用紫外线对电泳后的琼脂糖凝胶进行拍照。与全染色体为模板的对照(Input)相比,TFAP2A抗体特异性结合DNA,产物条带亮度略淡,阴性对照则无特异性DNA条带。引物序列见表2。
1.3 统计学方法 采用GraphPad prism 6.0软件进行数据分析。计量资料以[[x] ±s
]表示,2组间比较采用t检验;多组间比较采用单因素方差分析,组间多重比较行LSD-t检验。线性相关分析采用Pearson法。P<0.05为差异有统计学意义。
2 结果
2.1 生物信息学分析肾小球硬化基因表达火山图及TFAP2A与ADCK4的关系 GEO数据库中,GSE108113高通量数据集为FSGS肾组织中RNA-Seq RNA相对表达量的检测结果,表达上调的基因273个,表达下调的基因219个;GEPIA数据库分析证明肾透明细胞癌中TFAP2A与ADCK4表达水平呈正相关(r=0.600,P<0.01),见图1。
2.2 JASPAR数据库预测TFAP2A转录因子结合位点 JASPAR数据库预测ADCK4基因转录起始位点上游-464 bp/+206 bp区域包含2个TFAP2A转录因子结合位点,第1个结合位点位于-428 bp~-418 bp,第2个结合位点位于-171 bp~-163 bp,见图2。
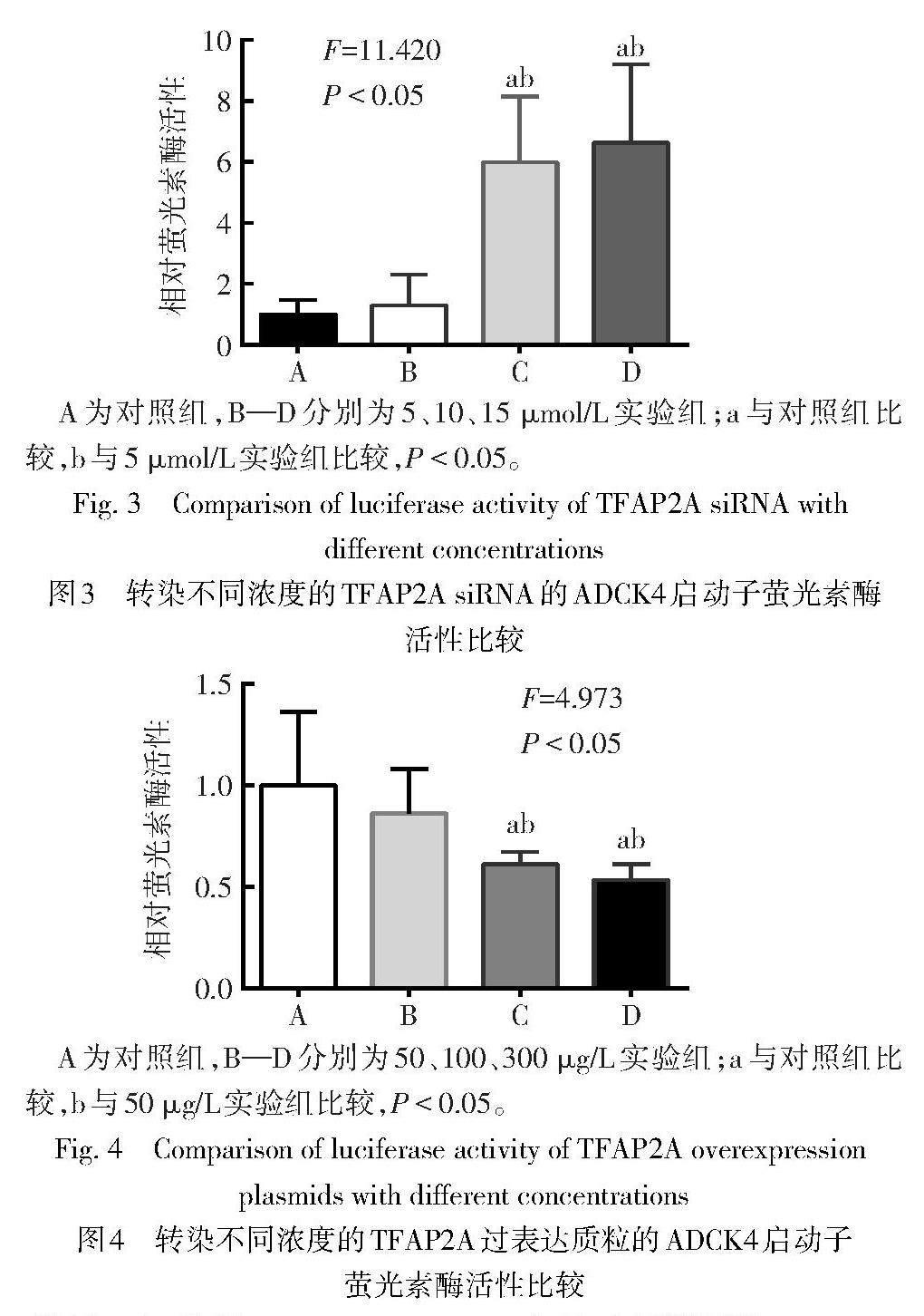
2.3 TFAP2A下调ADCK4启动子活性 双萤光素酶报告基因实验结果显示,与阴性对照相比,含ADCK4基因5'侧翼序列的-464 bp/+206 bp区域萤光素酶报告基因表达载体萤光素酶活性明显升高(t=14.650,P<0.01)。siRNA实验结果显示,10、15 ?mol/L实验组的ADCK4启动子相对萤光素酶活性增强(F=11.420,P<0.05),5 ?mol/L实验组的ADCK4启动子相对萤光素酶活性无明显改变(P>0.05),见图3。过表达实验结果显示,100、300 ?g/L实验组的TFAP2A过表达质粒ADCK4启动子萤光素酶活性降低(F=4.973,P<0.05),50 ?g/L实验组的TFAP2A过表达质粒ADCK4启动子萤光素酶活性无明显改变(P>0.05),见图4。
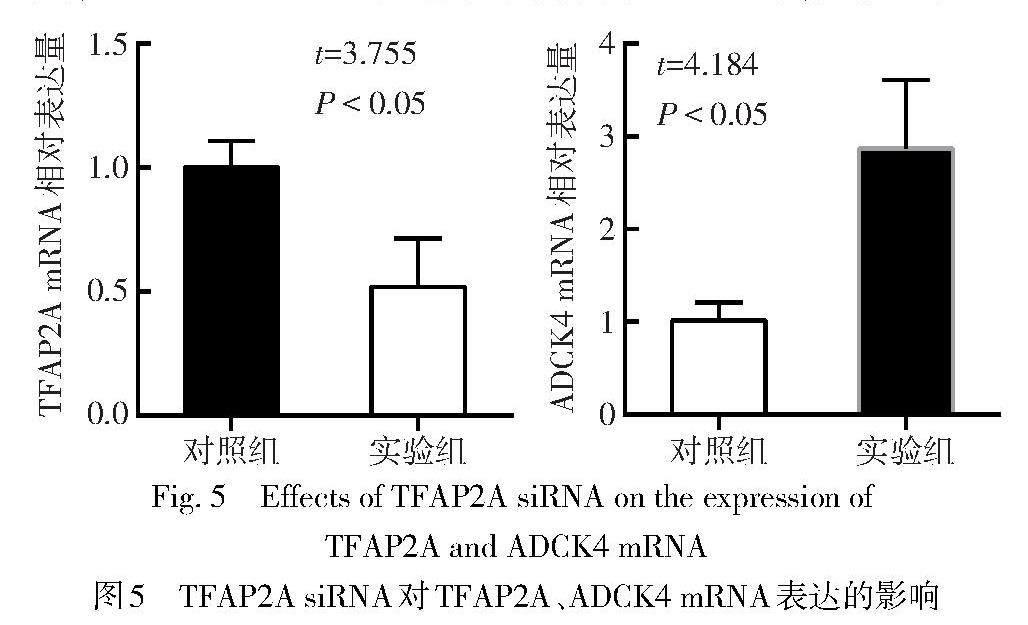
2.4 TFAP2A下调ADCK4 mRNA表达 与对照组相比,实验组TFAP2A mRNA表达水平降低,ADCK4 mRNA表达水平升高(P<0.05),见图5。过表达实验中,与对照组比较,实验组TFAP2A mRNA表达水平升高,ADCK4 mRNA表达水平降低(P<0.05),见图6。
2.5 TFAP2A下调ADCK4蛋白表达 与对照组相比,实验组TFAP2A蛋白表达水平降低,ADCK4蛋白表达水平升高(P<0.05);过表达实验中,与对照组比较,实验组TFAP2A蛋白表达水平升高,ADCK4蛋白表达水平降低(P<0.05),见图7、表3。
2.6 TFAP2A与ADCK4启动子区域直接结合 ChIP实验结果显示,用TFAP2A抗体下拉TFAP2A蛋白与细胞核内基因相结合的片段,IgG抗体下拉细胞中蛋白与基因片段时,未发现非特异性IgG的结合。结果证明TFAP2A可在体内与ADCK4启动子基因特异性结合,见图8。
3 讨论
FSGS的发病机制主要集中在原发性、遗传性和继发性,后者包括适应不良、病毒相关和药物诱发的FSGS[7],针对原发性FSGS具体发病机制的研究尚少见。原发性FSGS患者肾移植后的复发率仍达30%~80%[13],但基因治疗后极少复发,且可减少免疫抑制剂的用量及不良反应的发生[14]。有研究表明,AQP1启动子变异可影响腹膜中水通道的表达,且对肾功能衰竭患者腹膜透析治疗过程中水的运输产生影响[15]。系统性红斑狼疮中自身抗体和干扰素α(IFN-α)可促进环磷腺苷效应元件结合蛋白α(CREMα)的核易位及其与中性粒细胞中谷胱甘肽过氧化物酶4(Gpx4)启动子的结合,从而抑制Gpx4表达,诱发铁死亡[16]。因此,关于FSGS的启动子及转录调控研究可为疾病治疗提供理论基础。
本課题组前期研究已确定ADCK4核心启动子区[17],通过构建ADCK4启动子萤光素酶基因报告重组质粒,瞬时转染、萤光素酶活性检测,证实构建的ADCK4启动子具有启动子活性,提示ADCK4基因的5'侧翼序列的-464 bp/+206 bp区域是一个有功能的启动子。mRNA转录调控通过不同的启动子活性和5'UTR序列赋予物种特异性的转录和翻译调节功能[18]。本研究通过JASPAR软件预测ADCK4启动子区含有TFAP2A转录因子结合位点,并在启动子、mRNA和蛋白水平验证转录因子TFAP2A对ADCK4具有负向调控作用;ChIP实验确定TFAP2A与ADCK4启动子区域特异结合。启动子区的确定及启动子的转录调控机制是疾病基因治疗的基础,已有文献报道采用成簇规则间隔短回文重复序列/相关蛋白9(CRISPR/Cas9)技术纠正启动子区的基因变异来治疗有关疾病,局部注射由小向导RNA(sgRNA)指引的CRISPR相关蛋白9融合腺嘌呤剪辑编辑器CjABE的腺病毒,可抑制带有TRET启动子突变的神经胶质瘤的生长[19]。CRISPR介导的启动子或增强子激活可挽救由单倍体不足引起的肥胖[20]。本研究证明转录因子TFAP2A可以调控足细胞相关基因ADCK4的表达,增加了调控足细胞重要基因的转录因子成员。
ADCK4启动子范围的确定有利于解释二代测序基因上游非编码启动子区发生突变的临床意义,为生物信息学分析数据集提供了有功能意义的新数据,对于开发新型靶向基因治疗方法具有重要意义。但TFAP2A调控ADCK4表达对铁死亡、细胞凋亡及细胞焦亡的影响及其机制尚待进一步深入研究。
参考文献
[1] SUN L,ZHANG X,WANG Z. ADCK4 gene polymorphism aggravates renal damage caused by focal segmental glomerulosclerosis with COL4A3 mutation[J]. Biosci Rep,2021,41(1):BSR20203248. doi:10.1042/BSR20203248.
[2] NAKAGAWA N,KIMURA T,SAKATE R,et al. Demographics and treatment of patients with primary nephrotic syndrome in Japan using a national registry of clinical personal records[J]. Sci Rep,2023,13(1):14771. doi:10.1038/s41598-023-41909-5.
[3] HODSON E M,SINHA A,COOPER T E. Interventions for focal segmental glomerulosclerosis in adults[J]. Cochrane Database Syst Rev,2022,2(2):CD003233. doi:10.1002/14651858.CD003233.pub3.
[4] DE VRIESE A S,WETZELS J F,GLASSOCK R J,et al. Therapeutic trials in adult FSGS:lessons learned and the road forward[J]. Nat Rev Nephrol,2021,17(9):619-630. doi:10.1038/s41581-021-00427-1.
[5] FANG Z,ZHANG C,JIN Y,et al. Adult-onset focal segmental glomerulosclerosis with steroid-dependent nephrotic syndrome caused by a novel TBC1D8B variant:a case report and literature review[J]. Am J Kidney Dis,2023,81(2):240-244. doi:10.1053/j.ajkd.2022.06.012.
[6] ZHAI S B,ZHANG L,SUN B C,et al. Early-onset COQ8B(ADCK4) glomerulopathy in a child with isolated proteinuria:a case report and literature review[J]. BMC Nephrol,2020,21(1):406. doi:10.1186/s12882-020-02038-7.
[7] MORRIS A D,FLOYD L,WOYWODT A,et al. Rituximab in the treatment of primary FSGS:time for its use in routine clinical practice?[J]. Clin Kidney J,2023,16(8):1199-1205. doi:10.1093/ckj/sfad122.
[8] MITCHELL P J,WANG C,TJIAN R. Positive and negative regulation of transcription in vitro:enhancer-binding protein AP-2 is inhibited by SV40 T antigen[J]. Cell,1987,50(6):847-861. doi:10.1016/0092-8674(87)90512-5.
[9] CHAMBERS B E,GERLACH G F,CLARK E G,et al. Tfap2a is a novel gatekeeper of nephron differentiation during kidney development[J]. Development,2019,146(13):dev172387. doi:10.1242/dev.172387.
[10] CHAMBERS B E,CLARK E G,GATZ A E,et al. Kctd15 regulates nephron segment development by repressing Tfap2a activity[J]. Development,2020,147(23):dev191973. doi:10.1242/dev.191973.
[11] MIAO Z,BALZER M S,MA Z,et al. Single cell regulatory landscape of the mouse kidney highlights cellular differentiation programs and disease targets[J]. Nat Commun,2021,12(1):2277. doi:10.1038/s41467-021-22266-1.
[12] MUTO Y,WILSON P C,LEDRU N,et al. Single cell transcriptional and chromatin accessibility profiling redefine cellular heterogeneity in the adult human kidney[J]. Nat Commun,2021,12(1):2190. doi:10.1038/s41467-021-22368-w.
[13] UFFING A,PEREZ-SAEZ M J,MAZZALI M,et al. Recurrence of FSGS after kidney transplantation in adults[J]. Clin J Am Soc Nephrol,2020,15(2):247-256. doi:10.2215/CJN.08970719.
[14] DOCTOR G T,GALE D P,CHAN M M. Genomics in the kidney clinic[J]. Clin Med(Lond),2023,23(3):246-249. doi:10.7861/clinmed.2023-RM2.
[15] MORELLE J,MARECHAL C,YU Z,et al. AQP1 promoter variant,water transport,and outcomes in peritoneal dialysis[J]. N Engl J Med,2021,385(17):1570-1580. doi:10.1056/NEJMoa2034279.
[16] LI P,JIANG M,LI K,et al. Glutathione peroxidase 4-regulated neutrophil ferroptosis induces systemic autoimmunity[J]. Nat Immunol,2021,22(9):1107-1117. doi:10.1038/s41590-021-00993-3.
[17] CHEN X,LIU S,CHEN J,et al. Transcription factor Kruppel-like factor 5 positively regulates the expression of AarF domain containing kinase 4[J]. Mol Biol Rep,2020,47(11):8419-8427. doi:10.1007/s11033-020-05882-w.
[18] HUA P,BADAT M,HANSSEN L L P,et al. Defining genome architecture at base-pair resolution[J]. Nature,2021,595(7865):125-129. doi:10.1038/s41586-021-03639-4.
[19] LI X,QIAN X,WANG B,et al. Programmable base editing of mutated TERT promoter inhibits brain tumour growth[J]. Nat Cell Biol,2020,22(3):282-288. doi:10.1038/s41556-020-0471-6.
[20] MATHARU N,RATTANASOPHA S,TAMURA S,et al. CRISPR-mediated activation of a promoter or enhancer rescues obesity caused by haploinsufficiency[J]. Science,2019,363(6424):eaau0629. doi:10.1126/science.aau0629.
(2023-09-19收稿 2024-01-11修回)
(本文編辑 陈丽洁)
