AIM2炎症小体在急性痛风性关节炎中的表达及意义
2024-05-13初吉燕田竞付笛语郭琳孙蕊李萍
初吉燕 田竞 付笛语 郭琳 孙蕊 李萍

基金项目:辽宁省自然科学基金项目(2019-MS-350);联勤保障部队重点项目(19LBJ1003B)
作者单位:1中国人民解放军北部战区总医院风湿免疫科(邮编110001);2大连医科大学研究生院;3中国人民解放军北部战区总医院骨科
作者简介:初吉燕(1997),女,硕士在读,主要从事风湿免疫病学方面研究。E-mail:3490809936@qq.com
△通信作者 E-mail:graceli008@sohu.com
摘要:目的 探讨黑素瘤缺乏因子2(AIM2)、胱天蛋白酶-1(Caspase-1)和焦孔素D(GSDMD)在急性痛风性关节炎(AGA)中的表达及意义。方法 选取30例AGA患者(AGA组)和30例男性健康体检者(HC组),血细胞分析仪检测血清白细胞计数(WBC)、血红蛋白(Hb)、血小板计数(PLT),自动生化分析仪检测空腹血糖(FBG)、血尿酸(UA)、三酰甘油(TG)、總胆固醇(TC)、丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、血清肌酐(Scr)、尿素氮(BUN)、肌酐清除率(Ccr)、红细胞沉降率(ESR)和C-反应蛋白(CRP)水平。荧光定量法检测2组样本血清双链DNA(dsDNA)水平;Western blot法检测2组外周血单个核细胞(PBMCs)中AIM2、Caspase-1、GSDMD、白细胞介素(IL)-1β和IL-18蛋白表达水平;酶联免疫吸附试验检测血清IL-1β和IL-18表达水平。结果 与HC组比较,AGA组WBC、PLT、ESR、CRP、UA、TC、TG、Scr、Ccr水平增加,血清中dsDNA、IL-1β、IL-18相对表达水平增加,PBMCs中AIM2、Caspase-1、GSDMD、IL-1β、IL-18蛋白相对表达水平均增加(P<0.05)。PBMCs中,AIM2蛋白的表达水平与Caspase-1、GSDMD、IL-1β和IL-18蛋白表达水平均呈正相关(r或rs分别为0.965、0.986、0.928及0.737,均P<0.01)。结论 AIM2炎症小体介导的细胞焦亡通路相关分子(AIM2/Caspase-1/GSDMD)在AGA中表达增高,其可能参与AGA的免疫炎症反应。
关键词:关节炎,痛风性;细胞焦亡;胱天蛋白酶-1;黑素瘤缺乏因子2;焦孔素D
中图分类号:R684.3 文献标志码:A DOI:10.11958/20231205
Expression and significance of AIM2 inflammasome in patients with acute gouty arthritis
CHU Jiyan1, 2, TIAN Jing3, FU Diyu1, 2, GUO Lin1, SUN Rui1, LI Ping1△
1 Department of Rheumatology, the General Hospital of Northern Theater Command of the Chinese Peoples Liberation Army, Shenyang 110001, China; 2 Graduate School, Dalian Medical University; 3 Department of Orthopedics, the General
Hospital of Northern Theater Command of the Chinese Peoples Liberation Army
△Corresponding Author E-mail: graceli008@sohu.com
Abstract: Objective To investigate the expression and role of melanoma 2 (AIM2), Caspase-1 and gasdermin D (GSDMD) in the pathogenesis of acute gouty arthritis (AGA). Methods Clinical data, biochemical indices and blood samples were collected from 30 patients with AGA (the AGA group) and 30 healthy volunteers (the HC group). Blood cell analyzer was used to detect serum white blood cell count (WBC), hemoglobin (Hb) and platelet count (PLT). Automatic biochemical analyzer was used to detect fasting blood glucose (FBG), blood uric acid (UA), triacylglycerol (TG), total cholesterol (TC), alaine transaminase (ALT), aspartate transaminase (AST), serum creatinine (Scr), blood urea nitrogen (BUN), creatinine clearance rate (Ccr), erythrocyte sedimentation rate (ESR) and C-reactive protein (CRP) levels. Fluorescence quantitative assay was used to measure serum level of double-stranded DNA (dsDNA). Western blot was performed to detect the relative protein expression levels of AIM2, Caspase-1, GSDMD, interleukin-1β (IL-1β) and IL-18 in peripheral blood mononuclear cells (PBMCs). Enzyme-linked immunosorbent assay (ELISA) was used to measure serum levels of IL-1β and IL-18. Results Compared with the HC group, the AGA group showed increased levels of blood biochemical indicators, including WBC, PLT, ESR, CRP, UA, TC, TG, Scr and Ccr (P<0.05). The serum levels of dsDNA, IL-1β and IL-18 were also increased in the AGA group. Furthermore, the relative protein expression levels of AIM2, Caspase-1, GSDMD, IL-1β and IL-18 in PBMCs were all increased (P<0.05). In PBMCs, the protein expression level of AIM2 was positively correlated with that of Caspase-1, GSDMD, IL-1β and IL-18 (r or rs values were 0.965, 0.986, 0.928 and 0.737, respectively, all P<0.01). Conclusion The expression of AIM2 inflammasome-mediated pyroptosis pathway related molecules (AIM2/Caspase-1/GSDMD) is increased in AGA, which may be involved in the immune inflammatory response of AGA.
Key words: arthritis, gouty; pyroptosis; caspase-1; melanoma deficiency factor 2; pyroporosin D
痛风已成为全球高发疾病,并呈现年轻化趋势[1-2]。急性痛风性关节炎(acute gout arthritis,AGA)是一种自身炎症性疾病,其特征是高尿酸血症和单尿酸钠(monosodium urate,MSU)晶体在关节和组织中沉积,发作时关节局部会出现严重的红肿热痛。如果长期不治疗,痛风可能会引发心血管疾病和肾功能受损[2-3]。目前对AGA的治疗缺乏安全有效的药物,因此有必要深入研究AGA的发病机制。细胞焦亡是一种新型的炎性细胞死亡形式,其核心是由模式识别受体(pattern recognition receptor,PRR)、銜接蛋白和胱天蛋白酶-1(Caspase-1)组成的炎症小体。痛风作为一种自身炎症性疾病,该病患者的机体可通过内源性损伤相关分子模式(damage associated molecular patterns,DAMPs)和外源性病原相关分子模式(pathogen-associated molecular patterns,PAMPs)来识别MSU,从而激活固有免疫细胞内的炎症小体,参与免疫应答[4]。目前,临床上已发现了10余种炎症小体。其中,黑素瘤缺乏因子2(AIM2)炎症小体属于PHYIN蛋白家族,它在单核细胞、巨噬细胞、中性粒细胞和树突状细胞中表达,并参与炎症反应、调节细胞焦亡。AIM2是细胞内唯一能识别胞浆双链DNA(double-stranded DNA,dsDNA)的炎症小体[4]。研究发现,AIM2参与系统性红斑狼疮(SLE)[5]、类风湿关节炎(RA)[6]和干燥综合征[7]等多种自身免疫性疾病的发病过程。然而,关于AIM2炎症小体在AGA方面的作用鲜见报道。本研究通过检测AGA患者和健康对照者的外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)中AIM2炎症小体介导的细胞焦亡相关分子以及血清炎性因子白细胞介素(interleukin,IL)-1β、IL-18的表达,探究AIM2炎症小体介导的细胞焦亡途径在AGA发病中的作用,为痛风治疗提供参考。
1 资料与方法
1.1 一般资料 选取2022年1月—6月于中国人民解放军北部战区总医院就诊的AGA患者(AGA组)30例,均为男性,平均年龄(34.83±11.19)岁,平均体质量指数(BMI)为(28.17±2.93)kg/m2。AGA诊断根据1977年美国风湿病学会制定的痛风分类标准、2015年美国风湿病学会和欧洲抗风湿病联盟共同制定的痛风分类标准。纳入标准:年龄18~70岁;入院前1个月内未使用过治疗痛风性关节炎的药物;精神状态良好,能够理解研究内容并接受相应处理。排除标准:伴感染性关节炎、创伤性关节炎、结缔组织病或其他晶体相关性疾病者;继发性痛风者;存在心脑血管疾病者;存在出血系统病变或肿瘤者。另选30例男性健康查体者为对照(HC)组,年龄34.50(28.75,46.50)岁。2组年龄差异无统计学意义(Z=1.191,P>0.05)。本研究已经获得北部战区总医院伦理委员会的批准[伦审Y(2021)148]号。
1.2 主要仪器与试剂 Quant-iT? PicoGreen? dsDNA Assay Kit购自美国Invitrogen公司;人外周血淋巴细胞分离液购自北京索莱宝科技有限公司;蛋白提取试剂盒购自中国爱必信(上海)生物科技有限公司;IL-1β和IL-18酶联免疫吸附试验(ELISA)检测试剂盒购自中国江苏酶免实业有限公司;Anti-AIM2抗体购自中国爱必信(上海)生物科技有限公司;Anti-Caspase-1、Anti-IL-1β、Anti-IL-18抗体均购自美国Cell Signaling Technology公司;Anti-GSDMD抗体购自中国博奥森公司;Anti-GAPDH抗体、HRP标记的山羊抗兔IgG购自中国武汉赛维尔生物科技有限公司;一步法PAGE凝胶快速制备试剂盒购自中国上海雅酶生物医药科技有限公司;BioTek Synergy2多功能酶标仪购自美国BioTek公司;Rayto RT-6100酶标分析仪购自美国Rayto公司;NanoDrop 2000分光光度计、电泳仪购自美国BIO-RAD公司;GE AI 680超灵敏多功能成像仪购自美国Cytiva公司。
1.3 研究方法
1.3.1 血常规和生化指标检测 收集受试者外周静脉血8 mL,血细胞分析仪检测血清白细胞计数(WBC)、血红蛋白(Hb)、血小板计数(PLT),自动生化分析仪检测空腹血糖(FBG)、血尿酸(UA)、三酰甘油(TG)、总胆固醇(TC)、丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、血清肌酐(Scr)、尿素氮(BUN)、肌酐清除率(Ccr)、红细胞沉降率(ESR)和C-反应蛋白(CRP)水平。
1.3.2 荧光定量法检测血清dsDNA水平 96孔板内每孔加入90 ?L TE缓冲液后加入10 ?L血清,每孔再加入100 ?L用TE缓冲液稀释200倍后的PicoGreen稀释液,常温避光孵育10 min,BioTek Synergy2多功能酶标仪于激发光480 nm、发射光520 nm波长条件下检测并计算dsDNA浓度。
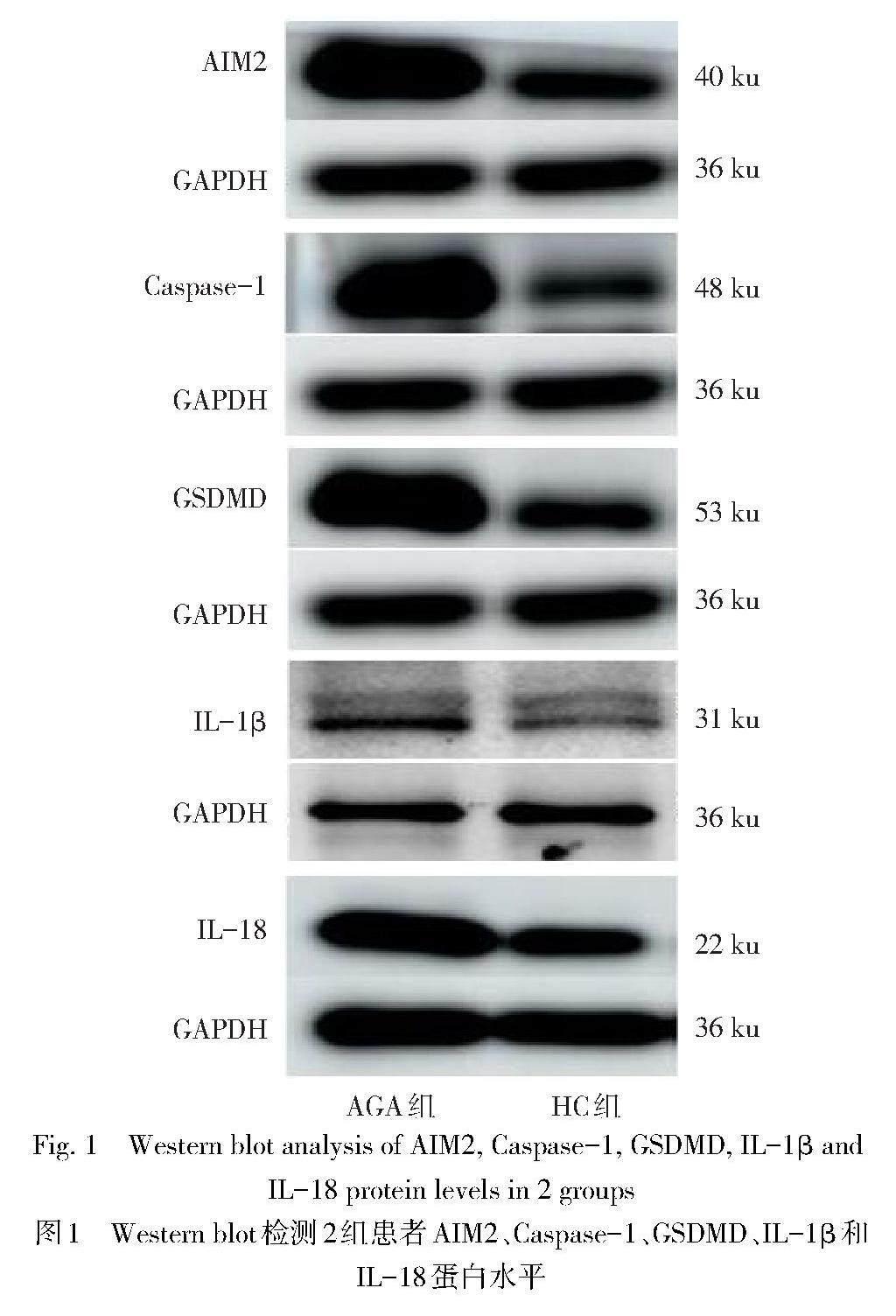
1.3.3 Western blot法检测AIM2、Caspase-1、GSDMD、IL-1β和IL-18蛋白相对表达水平 取外周静脉血并加入肝素抗凝,于离心机1 500 r/min离心10 min,用尖头吸管吸取白膜状细胞层,加入聚蔗糖—泛影葡胺分层液,离心弃上清并重复操作2次,加入RPMI-1640培养液,4 ℃保存备用。加入Western/IP裂解液裂解不同组别的PBMCs,BCA定量法进行蛋白浓度测定,并以最低蛋白浓度进行调整,根据蛋白分子质量大小选择6%、10%的SDS-PAGE凝胶进行电泳。分离蛋白质后转移到0.45 ?m PVDF膜上,5%脱脂奶粉室温摇床封闭2 h,用1×TBST洗膜,5 min/次×3次,于4 ℃摇床分别过夜孵育AIM2(1∶500)、Caspase-1(1∶1 000)、GSDMD(1∶500)、IL-1β(1∶1 000)、IL-18(1∶1 000)和GAPDH(1∶2 000)抗体;1×TBST充分洗涤后,用HRP标记的山羊抗兔IgG抗体室温摇床孵育2 h,通过ECL化学发光试剂盒显影,GE AI 680超灵敏多功能成像仪获取条带图像,Image J软件分析条带灰度值并计算相对表达水平。
1.3.4 ELISA检测血清炎性因子水平 参照ELISA试剂盒说明书,Rayto RT-6100酶标分析仪在450 nm波长处测量受试者外周血血清的光密度(OD)值,计算IL-1β和IL-18水平。
1.4 统计学方法 采用SPSS 23.0和GraphPad Prism 9.0软件进行数据分析。符合正态分布的计量数据用[x] ±s表示,2组间比较用t检验,非正态分布的以M(P25,P75)表示,组间比较用秩和检验。相关分析用Pearson或Spearman相关。P<0.05为差异有统计学意义。
2 结果
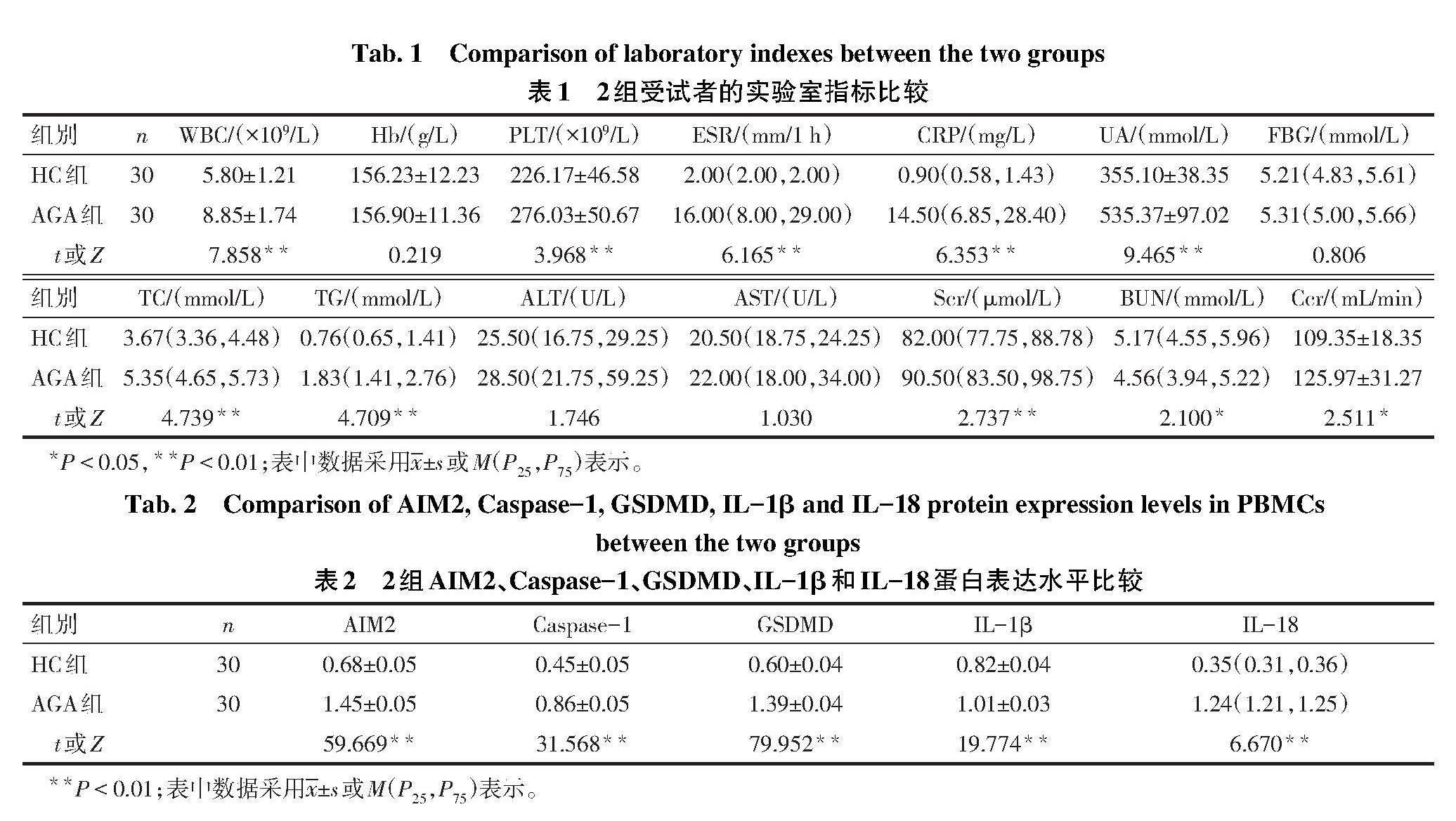
2.1 2组血常规和生化指标比较 2组Hb、FBG、ALT和AST比较差异无统计学意义。与HC组比较,AGA组WBC、PLT、ESR、CRP、UA、TC、TG、Scr和Ccr水平增加(P<0.05),见表1。
2.2 2组受试者血清中dsDNA水平比较 AGA组血清dsDNA水平[56.12(50.70,61.83)mg/L]高于HC组[44.09(40.61,48.28)mg/L],差异有统计学意义(Z=4.487,P<0.01)。
2.3 2组PBMCs中相关蛋白表达水平比较 与HC组比较,AGA组PBMCs中AIM2、Caspase-1、GSDMD、IL-1β、IL-18的蛋白相对表达水平均增加(P<0.01),见图1、表2。
2.4 2组血清中IL-1β、IL-18表达水平比较 AGA组血清IL-1β、IL-18水平高于HC组(P<0.01),见表3。
2.5 AIM2炎症小体成分之间的相关性分析 在PBMCs中,AIM2蛋白的表达水平与Caspase-1、GSDMD、IL-1β和IL-18蛋白表达水平均呈正相关(r或rs分别为0.965、0.986、0.928及0.737,均P<0.01)。
3 讨论
AGA的发病是一个复杂的“代谢-免疫-炎症”网络调节过程,其中不同的炎症因子相互作用,导致疾病的发生和发展[8]。在正常生理情况下,关节腔内没有或只有少量中性粒细胞,AGA时大量中性粒细胞被招募到晶体沉积部位。这些中性粒细胞不仅会吞噬MSU晶体,还会释放IL-1β和IL-18等炎症介质,从而引发局部急性炎症反应。此外,活化的IL-1β还会吸引中性粒细胞释放大量由DNA、组蛋白和中性粒细胞颗粒等成分组成的中性粒细胞外诱捕网(neutrophil extracellular traps,NETs)。中小剂量的NETs以核内或线粒体内DNA为骨架,并负载水解酶形成网状结构。这些NETs包裹及消灭MSU晶体,抑制炎症反应,从而缓解痛风发作,但如果NETs过度形成或未能及时清除,释放的DAMPs会刺激固有免疫系统的活化,引发炎症反应[9]。在痛风患者的关节滑液中,可以观察到染色的dsDNA[10]。本研究结果显示,AGA组患者血清中dsDNA水平显著升高。因此,识别和清除dsDNA片段可能成為AGA研究的新靶点。
当AIM2炎症小体受到dsDNA刺激时,激活Caspase-1会生成和释放IL-1β和IL-18,并通过剪切GSDMD诱导细胞焦亡[4,11]。在固有免疫中,轻中度的细胞焦亡可清除机体内的危险因子,发挥保护作用。然而,高水平的细胞焦亡会导致细胞过度死亡,从而引起机体损伤[12]。既往研究发现,干燥综合征患者的导管组织中和非肿瘤性导管唾液腺上皮细胞系的DNase1表达和活性受损,导致dsDNA降解缺陷,引发上皮细胞AIM2的持续性激活[7]。SLE患者外周血中的dsDNA水平和PBMCs中AIM2 mRNA表达水平明显增高,并且其水平与肾脏受累和疾病活动度相关[13]。在小鼠SLE模型中,抑制AIM2的表达可以显著减轻SLE症状[5]。在RA患者的外周血PBMCs和中性粒细胞中,AIM2炎症小体的表达上调,并与其下游的靶基因ASC、Caspase-1及病情严重程度相关[6]。本研究发现,在AGA患者的PBMCs中,AIM2蛋白的表达水平明显增加,提示在AGA的发生发展过程中机体可能会产生大量dsDNA,从而激活AIM2的表达。
Caspase-1是经典细胞焦亡途径中炎症小体复合物的重要组分。当它被激活后,不仅会裂解pro-IL-1β和pro-IL-18,生成成熟的促炎因子IL-1β和IL-18,还会裂解GSDMD[14]。既往研究表明,在AGA患者的PBMCs和AGA大鼠模型的关节滑膜中,Caspase-1蛋白的表达水平均明显增加[14]。本研究结果亦显示,AGA患者的PBMCs中Caspase-1蛋白水平升高,并且该水平与AIM2蛋白水平呈正相关,提示Caspase-1的表达可能与AIM2炎症小体的激活有关,共同参与了AGA的发生过程。
GSDMD是细胞焦亡的最终效应执行者。在Caspase-1的作用下,GSDMD-N从GSDMD-C的抑制状态中释放出来,在细胞膜上形成直径为10~20 nm的孔道,导致细胞内物质外流,水逆渗透压内流,最终导致细胞膜破裂和细胞焦亡发生[11,15]。本研究结果显示,AGA患者GSDMD蛋白的表达水平显著增加。既往研究也有类似的结果,但是其中一些报道认为GSDMD表达水平增加是由NLR家族的另一个成员NLRP3炎症小体介导[8,16-17]。本研究发现,GSDMD蛋白的表达水平与AIM2和Caspase-1蛋白的表达水平均呈正相关,提示GSDMD可能参与了AIM2炎症小体介导的细胞焦亡。
IL-1β和IL-18是IL-1家族中常见的促炎因子。IL-1β主要由活化的巨噬细胞分泌,通过与IL-1β受体结合触发下游促炎细胞因子和趋化因子的级联信号,从而招募中性粒细胞和其他细胞到晶体沉积处,引发和加重局部炎症反应。IL-18存在于健康人体血液的单核细胞以及胃肠道的上皮细胞中,其分泌主要与Caspase-1有关,在炎症和免疫调节中发挥重要作用。既往研究发现,痛风患者的血清和鼠模型滑膜中尿酸水平与IL-1β及IL-18的水平呈正相关,而IL-1β阻断剂可以显著改善痛风症状[18-20]。本研究亦发现,AGA患者的PBMCs血清中IL-1β及IL-18浓度显著提高,并且PBMCs中AIM2蛋白的表达水平与IL-1β和IL-18表达呈正相关。
綜上,AIM2炎症小体介导的细胞焦亡在AGA发生、发展中发挥重要作用,可能为AGA治疗药物的新靶点。然而,由于本研究样本量少、单中心以及可能存在选择偏倚等因素,AIM2炎症小体介导的细胞焦亡通路在AGA中的具体作用仍需要进一步探索。
参考文献
[1] DEHLIN M,JACOBSSON L,RODDY E. Global epidemiology of gout:prevalence,incidence,treatment patterns and risk factors[J]. Nat Rev Rheumatol,2020,16(7):380-390. doi:10.1038/s41584-020-0441-1.
[2] LIU R,HAN C,WU D,et al. Prevalence of Hyperuricemia and Gout in Mainland China from 2000 to 2014: a systematic review and meta-analysis[J]. Biomed Res Int,2015,2015:762820. doi:10.1155/2015/762820.
[3] DALBETH N,GOSLING A L,GAFFO A,et al. Gout[J]. Lancet,2021,397(10287):1843-1855. doi:10.1016/S0140-6736(21)00569-9.
[4] SHARMA B R,KARKI R,KANNEGANTI T D. Role of AIM2 inflammasome in inflammatory diseases,cancer and infection[J]. Eur J Immunol,2019,49(11):1998-2011. doi:10.1002/eji.201848070.
[5] CHOUBEY D,PANCHANATHAN R. Absent in Melanoma 2 proteins in SLE[J]. Clin Immunol,2017,176:42-48. doi:10.1016/j.clim.2016.12.011.
[6] M?NDEZ-FRAUSTO G,MEDINA-ROSALES M N,URESTI-RIVERA E E,et al. Expression and activity of AIM2-inflammasome in rheumatoid arthritis patients[J]. Immunobiology,2020,225(2):151880. doi:10.1016/j.imbio.2019.11.015.
[7] VAKRAKOU A G,SVOLAKI I P,EVANGELOU K,et al. Cell-autonomous epithelial activation of AIM2 (absent in melanoma-2)inflammasome by cytoplasmic DNA accumulations in primary Sj?gren's syndrome[J]. J Autoimmun,2020,108:102381. doi:10.1016/j.jaut.2019.102381.
[8] 张静雯,王利,赵敏,等. 核苷酸结合寡聚化结构域样受体蛋白3介导细胞焦亡在痛风性关节炎中的作用机制研究[J]. 陕西医学杂志,2022,51(5):561-565. ZHANG J W,WANG L,ZHAO M,et al. Mechanism of nucleotide-binding oligomerization domain-like receptor protein 3 mediating pyroptosis in acute gouty arthritis[J]. Shaanxi Medical Journal,2022,51(5):561-565. doi:10.3969/j.issn.1000-7377.2022.05.011.
[9] 张水印,李华南,顾兵,等. 痛风性关节炎的自行消散及中性粒细胞胞外诱捕网的作用[J]. 江西科技师范大学学报,2019,6:79-83. ZHANG S Y,LI H N,GU B,et al. Spontaneous resolution of gouty arthritis and the role of neutrophil extracellular traps[J]. Journal of Jiangxi Science & Technology Normal University,2019,6:79-83. doi:10.3969/j.issn.1007-3558.2019.06.017.
[10] MITROULIS I,KAMBAS K,RITIS K. Neutrophils,IL-1β,and gout:is there a link?[J]. Semin Immunopathol,2013,35(4):501-512. doi:10.1007/s00281-013-0361-0.
[11] BROZ P,PELEGRIN P,SHAO F. The gasdermins,a protein family executing cell death and inflammation[J]. Nat Rev Immunol,2020,20(3):143-157. doi:10.1038/s41577-019-0228-2.
[12] LU F,LAN Z,XIN Z,et al. Emerging insights into molecular mechanisms underlying pyroptosis and functions of inflammasomes in diseases[J]. J Cell Physiol,2020,235(4):3207-3221. doi:10.1002/jcp.29268.
[13] 朱桂启,刘美霞,马新美,等. 干扰素诱导基因AIM2与系统性红斑狼疮的相关性研究[J]. 风湿病与关节炎,2015,4(6):10-12,19. ZHU G Q,LIU M X,MA X M,et al. The Relationship between interferon-induced gene AIM2 and systemic lupus erythematosus[J]. Rheumatism and Arthritis,2015,4(6):10-12,19. doi:10.3969/j.issn.2095-4174.2015.06.002.
[14] TIAN J,WANG B,XIE B,et al. Pyroptosis inhibition alleviates potassium oxonate- and monosodium urate-induced gouty arthritis in mice[J]. Mod Rheumatol,2022,32(1):221-230. doi:10.1080/14397595.2021.1899569.
[15] WANG K,SUN Q,ZHONG X,et al. Structural mechanism for GSDMD targeting by autoprocessed caspases in pyroptosis[J]. Cell,2020,180(5):941-955.e20. doi:10.1016/j.cell.2020.02.002.
[16] MARTINON F,P?TRILLI V,MAYOR A,et al. Gout-associated uric acid crystals activate the NALP3 inflammasome[J]. Nature,2006,440(7081):237-241. doi:10.1038/nature04516.
[17] 王敬博,仲米存,杨坤,等. 基于NLRP3通路研究青梅复方对急性痛风性关节炎的干预作用及机制[J]. 中国实验方剂学杂志,2022,28(18):70-76. WANG J B,ZHONG M C,YANG K,et al. Intervention effect and mechanism of Qingmei Compound on acute gouty arthritis based on NLRP3 pathway[J]. Chinese Journal of Experimental Traditional Medical Formulae,2022,28(18):70-76. doi:10.13422/j.cnki.syfjx.20221842.
[18] 鲍布和,张琪,李海林,等. 血常规比值参数在类风湿关节炎中的诊断价值[J]. 天津医药,2023,51(11):1271-1275. BAO B H,ZHANG Q,LI H L,et al. Diagnostic value of blood cell count-derived ratio parameters in rheumatoid arthritis[J]. Tianjin Med J,2023,51(11):1271-1275. doi:10.11958/20230481.
[19] WEI H,HU C,XIE J,et al. Doliroside A attenuates monosodium urate crystals-induced inflammation by targeting NLRP3 inflammasome[J]. Eur J Pharmacol,2014,740:321-328. doi:10.1016/j.ejphar.2014.07.023.
[20] 李宏軍,钱亮,邓新超,等. 舒筋活血胶囊通过JAK2/STAT3通路缓解大鼠膝骨关节炎的机制研究[J]. 天津医药,2023,51(9):961-967. LI H J,QIAN L,DENG X C,et al. Mechanism of Shujin Huoxue Capsule in relieving knee osteoarthritis in rats through JAK2/STAT3 pathway[J]. Tianjin Med J,2023,51(9):961-967. doi:10.11958/20221924.
(2023-08-10收稿 2023-10-30修回)
(本文编辑 陆荣展)
