白术多糖通过花生四烯酸代谢通路缓解环磷酰胺诱导的小鼠肾损伤
2024-05-12李冰心龚淑影许丹宁李婉雁付新亮江丹莉洪龙胜余梓榆白帅飞田允波
李冰心,龚淑影,许丹宁,李婉雁,曹 楠,付新亮,江丹莉,洪龙胜,余梓榆,白帅飞,田允波
(仲恺农业工程学院动物科技学院,广东广州 510225)
白术多糖(Polysaccharide ofAtractylodes macrocephalaKoidz,PAMK)是中药白术最主要的有效生物活性成分之一。研究表明,白术多糖具有抗炎、抗氧化、降血糖与免疫调节等多种生物活性[1-3]。在免疫方面,PAMK 通过改善肝脂代谢和增加抗氧化酶活性,有效地保护肝脏免受高能量低蛋白饮食引起的损伤,进一步减轻肝脏负担,从而显著提升免疫系统的功能[4],并通过介导信号通路减轻肝脏炎症损伤和氧化应激[5]。此外,PAMK 还可以通过提高白细胞数量、修复骨髓、脾脏及胸腺的组织结构、提高白细胞功能等途径减轻环磷酰胺对小鼠白细胞的抑制和破坏作用,并对正常小鼠的淋巴细胞功能具有明显的提升作用[6]。
肾脏是哺乳动物重要的排泄器官,在维持体内平衡中起着至关重要的作用。环磷酰胺(Cyclophosphamide,CTX)是一种常用的抗癌药物,但它也会产生许多副作用,包括尿毒性或肾毒性[7]。CTX 的代谢转化导致两种代谢物的形成:磷酰胺芥末和丙烯醛,磷酰胺芥被认为具有抗肿瘤活性,而丙烯醛作为一种生物半衰期短的高活性代谢物,可能是CTX 诱导肾损伤的原因[8-9]。丙烯醛可以产生高活性氧(ROS),干扰组织抗氧化防御系统,对哺乳动物细胞具有致突变性[10-12],为了避免这些氧化毒性副作用,当前常用抗氧化剂对丙烯醛进行解毒,比如芍药苷已被用于缓解CTX 引起的肾损害[13]。Gunes 等[14]发现香芹酚能够作为一种抗氧化剂,保护生物分子,如膜脂,免受自由基诱导的损伤,并且能够减少CTX 注射后大鼠的氧化应激的反应。然而,PAMK对CTX 诱导的小鼠肾损伤的影响尚未见报道。
本研究拟通过注射CTX 建立小鼠肾损伤模型,以探究PAMK 对CTX 诱导的小鼠肾损伤的影响,并通过转录组测序掌握PAMK 缓解CTX 诱导的小鼠肾损伤的作用机制,为后续研究PAMK 缓解CTX诱导的机体损伤提供参考。
1 材料与方法
1.1 材料与仪器
PAMK 纯度95%,中国西安杨凌慈源生物技术公司;注射用环磷酰胺国药准字H14023686 山西普德药业股份有限公司;SPF 级C57BL/6 雄性小鼠 42~43 日龄,100 只,购自广东省医学实验动物中心;超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、总抗氧化能力(T-AOC)、丙二醛(MDA)、过氧化氢酶(CAT)试剂盒 南京建成生物工程研究所;预混型定量用反转录试剂盒 日本TAKARA 公司;Trizol 试剂 美国Thermo Fisher 公司;SYBR Green Master Mix PCR 中国康润生物技术公司。
Epoch 超微量微孔板分光光度计 美国伯腾仪器有限公司;7500 REAL TIME PCR SYSTEM 实时荧光定量PCR 仪、VERITI 梯度PCR 仪 美国ABI 公司;Micro 21R 高速冷冻离心机 美国Thermo Fisher 公司;Bioanalyzer 2100 2100 生物分析系统 美国Agilent 公司;NovaSeq 6000 基因DNA 测序仪 美国Illumina 公司。
1.2 实验方法
1.2.1 试验设计与样品采集 100 只42~43 日龄雄性C57BL/6 小鼠被随机分为四组,分别为对照组(Control)、环磷酰胺组(CTX)、白术多糖组(PAMK)、白术多糖+环磷酰胺组(PAMK+CTX),25 只/组,每组5 个重复,每个重复5 只。实验期间,PAMK 组和PAMK+CTX 组灌胃200 mg/kg PAMK 1 次/d;Control 组和CTX 组给予等量的生理盐水。实验第25~27 d,CTX 组和PAMK+CTX 组腹腔注射100 mg/kg CTX 1 次/d;Control 组和PAMK 组注射等量生理盐水。实验第35 d,每组随机选取5 只小鼠采集肾脏组织,取部分肾脏组织立即冻入液氮,-80 ℃保存备用;剩余组织样品于10%中性缓冲福尔马林中固定保存。本试验所有小鼠均接受人道处理,试验经仲恺农业工程学院实验动物伦理委员会批准,批准协议号为:2023030501。
1.2.2 肾脏组织学及超微形态学观察 肾脏组织在10%中性缓冲福尔马林溶液中固定48 h,包埋石蜡,切成5~6 μm 厚的切片。常规组织学检查,石蜡切片苏木精-伊红染色法(HE 染色),HE 染色切片在光学显微镜下观察并用Case Viewer 软件进行图像采集。
1.2.3 肾脏抗氧化指标检测 取0.2 g 肾脏组织加入1.8 mL 磷酸盐缓冲液(PBS),经组织破碎仪破碎制成10%组织匀浆,3000 r/min 离心10 min,取上清待测(n=5)。按照试剂盒的说明,检测组织中超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、总抗氧化能力(T-AOC)、丙二醛(MDA)、过氧化氢酶(CAT)含量。
1.2.4 RNA 提取及文库构建 用Trizol 试剂提取肾脏组织总RNA,利用NanoDrop ND-1000 分析总RNA 质 量和 纯度(浓度>50 ng/μL、RIN 值>7.0、OD260/280>1.8),并通过Bioanalyzer 2100 仪器检测RNA 完整性。每个样本分别取5 μg RNA 用于转录组文库构建,运用Epicenter Ribo-Zero Gold 试剂盒去除样本中的核糖体RNA(rRNA),剩余RNA 纯化后进行反转录以构建cDNA 文库。通过联川生物技术有限公司的Illumina Novaseq™ 6000 平台对构建的小鼠肾组织cDNA 文库进行双端测序,测序模式为PE150。测序完成后,使用Cutadapt 软件删除包含连接物污染、低质量碱基和未定义碱基读数的原始数据(raw reads)。利用FastQC 软件(http://www.bioinformatics babraham.ac.uk/projects/fastqc/)获得高质量的clean reads,并且将该数据与小鼠(Mus musculus)基因组序列进行序列比对。利用Tophat2检测测序数据的饱和度,同时对比对上的reads 进行统计分析,以评估clean reads 在内含子(intron)、外显子(exon)和基因间隔区(intergenic)的分布情况。
1.2.5 差异表达基因GO 功能及KEGG 通路富集分析 采用DESeq2 软件对两组间基因差异表达进行分析,以P<0.05 且|log2(Fold change)|≥1 为阈值,筛选差异表达基因。利用Goseq R 软件包和Kobas 在线工具(http://kobas.cbi.pku.edu.cn/genelist/)分别对差异表达基因进行GO 功能和KEGG 功能富集通路分析。GO 功能富集包括生物过程、细胞成分和分子功能。以P<0.05 作为筛选显著富集的GO 条目或KEGG 信号通路的标准。利用在线网站Venny 2.1.0(https://bioinfogp.cnb.csic.es/tools/venny/index.html)对两组KEGG 富集的通路进行交集分析。
1.2.6 转录组测序基因实时荧光定量PCR 检测 根据RNA-Seq 结果挑选花生四烯酸通路相关基因CYB2B9、CYP2C65、NF-κB、PTGS1、ALOX5、ALOX12、BCL6、MFSD2A进行实时荧光定量PCR。使用Trizol 试剂,严格按照说明书提取相同批次的RNA,按照TaKaRa 逆转录试剂盒说明书将RNA 逆转录为cDNA。根据GenBank 中各基因序列,利用Oligo 7 软件设计引物,引物信息见表1。引物均由上海生工生物工程有限公司合成。在实时定量PCR 采用SYBR Green 嵌合荧光法,反应体系包括SYBR Green Master Mix 10 μL,上游引物0.5 μL,下游引物0.5 μL,cDNA 1 μL,RNase free ddH2O 8 μL。反应程序为:95 ℃预变性2 min;95 °C 变性15 s,60 ℃退火30 s,72 ℃延伸30 s,40 个循环。采用2-ΔΔCt法计算相对表达量。

表1 引物信息Table 1 Information of the primers
1.3 数据处理
利用GraphPad Prism 8.0 软件进行统计、作图。根据one-way ANOVA 比较平均值,并通过Tukey 检验进行组间多重比较,数值以“平均值±标准误”表示。P<0.05 表示差异显著。
2 结果与分析
2.1 PAMK 对CTX 诱导的小鼠肾脏组织结构的影响
各组小鼠的肾组织切片如图1 所示,Control 组和PAMK 组小鼠肾脏结构更为完整,肾小管包括近曲小管及远曲小管各部位上皮细胞无变性,排列有序,肾小囊明显,肾小体、肾小球等结构均正常,管腔形态大小正常,未见异状。CTX 组出现了明显的病理现象,如肾小球萎缩、肾小管上皮细胞脱落、周围有少许出血点和炎性细胞浸润;与CTX 组相比,PAMK+CTX 组肾组织病变明显好转。

图1 小鼠肾脏组织病理学变化(H&E 染色,100×,400×)Fig.1 Histopathological changes of mouse kidney (H&E staining,100×,400×)
2.2 PAMK 对CTX 诱导的小鼠肾脏抗氧化指标的影响
肾脏组织中MDA 含量、GSH-Px、SOD、CAT活性和总抗氧化能力检测结果如图2 所示,与Control 组相比,注射CTX 后的小鼠肾组织的SOD、GSH-Px 活性显著降低(P<0.05);MDA 含量显著升高(P<0.05);相较于CTX 组,CTX+PAMK 组小鼠肾组织的GSH-Px、SOD、CAT 活性和总抗氧化能力显著升高(P<0.05);MDA 含量显著下降(P<0.05)。与Control 组相比,PAMK 组小鼠肾组织中的总抗氧化能力显著升高(P<0.05),GSH-Px、SOD、CAT 活性无显著差异。
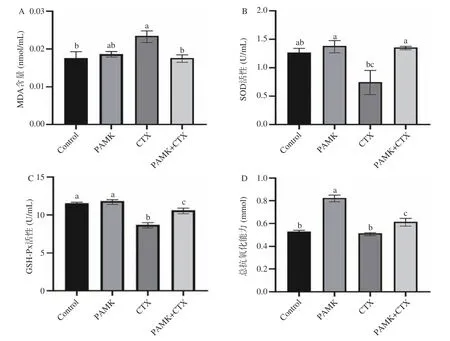
图2 PAMK 对小鼠机体中氧化应激指标的影响Fig.2 Effects of PAMK on oxidative stress indexes in mice
2.3 转录组测序数据分析
本研究构建的9 个cDNA 文库中获得了37125316~43483558 条清洁读数(clean reads),有效比对率在94.36%以上,所有样本的Q20%值均>99.90%,Q30%值均>97.81%,GC 含量(RNA 序列中,含有鸟嘌呤(Guanine,简称G)和胞嘧啶(Cytosine,简称C)这两种碱基的比例在47.50%~50.00%,说明测序质量的错误率低,数据可靠性高,可用于后续分析。通过对各样本的mRNA 区域分布进行统计分析,结果显示,发现各样本中外显子(exon)、内含子(intron)和基因间隔区域(intergenic)所占比例相似,其中由外显子转录而来的mRNAs 片段比例最高,占95%以上(图3)。
图3 小鼠肾脏组织中mRNAs 分布统计Fig.3 Distribution statistics of mRNAs in bursae of Fabricius of mouse
2.4 差异表达基因分析
通过DESeq2 软件对转录组测序数据进行分析,结果发现,Control 组vs CTX 组共获得493 个差异表达基因,其中236 个基因上调,257 个基因下调(图4A~图4B);CTX 组vs PAMK+CTX 组共获得333个差异表达基因,其中184 个基因上调,149 个基因下调(图4C~图4D)。


图4 差异表达基因火山图和热图Fig.4 Volcano map and heatmap of differentially expressed genes
2.5 差异表达基因GO 功能与KEGG 通路富集分析
GO 功能富集分析发现,差异表达基因多富集在与炎症和免疫反应相关的GO 条目,其中Control组vs CTX 组主要富集在环氧合酶P450 途径、花生四烯酸环氧合酶活性、转录调控区DNA 结合的负调控等途径(图5A);CTX 组vs PAMK+CTX 组主要富集在花生四烯酸环氧合酶活性、细胞色素P450 途径、丝氨酸型肽酶活性等途径(图5C)。KEGG 通路富集分析结果显示,Control 组vs CTX 组差异表达基因主要富集在花生四烯酸代谢(T 细胞受体、NFκB 等信号通路(图5B);CTX 组vs PAMK+CTX 组主要富集在花生四烯酸代谢、亚油酸代谢、TRP 通道的炎症介质调节等信号通路(图5D)。表2 和图6 结果显示,Control 组vs CTX 组、CTX vs PAMK+CTX组的KEGG 富集通路中有交集的通路有7 个。其中花生四烯酸代谢通路在Control 组vs CTX 组和CTX 组 vs PAMK+CTX 组中的富集最显著。
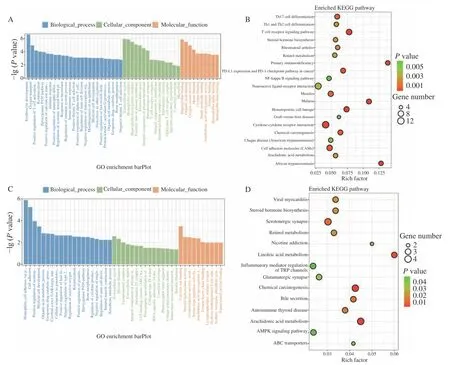
图5 差异表达基因GO 功能(A、C)和KEGG 通路(B、D)富集分析Fig.5 GO function (A,B) and KEGG pathway (B,D) enrichment analysis of differentially expressed genes
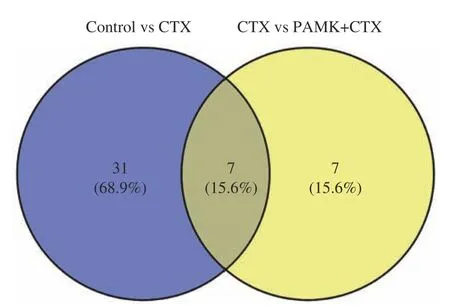
图6 Control vs CTX 和CTX vs PAMK+CTX KEGG 富集通路交集维恩图Fig.6 Gene intersection Venn diagram of Control vs CTX and CTX vs PAMK+CTX KEGG enrichment pathway

表2 Control vs CTX 和CTX vs PAMK+CTX KEGG交集通路Table 2 Intersection pathways of Control vs CTX,CTX vs PAMK+CTX KEGG
2.6 实时荧光定量PCR 检测
用实时荧光定量检测Control 组vs CTX 组和CTX 组vs PAMK+CTX 组关键基因CYP2C65、CYP2B9、PTGS1、ALOX5、ALOX12、NF-κB和抗氧化基因BCL6、MFSD2A。由图7 可知,与Control组相比,CTX 组Cyp2b9、PTGS1、NF-κB和Mfsd2amRNA 表达量显著升高(P<0.05),BCL6mRNA 表达量显著降低(P<0.05),Cyp2c65、ALOX5和ALOX12mRNA 表达量无显著差异(P>0.05);与CTX 组相比,PAMK+CTX 组Cyp2c65、BCL6mRNA 表达量显著升高(P<0.05),Cyp2b9、PTGS1和Mfsd2amRNA表达量显著降低(P<0.05);ALOX5、ALOX12和NFκBmRNA 表达量无明显差异。

图7 PAMK 对CTX 处理下小鼠肾脏组织相关基因的mRNA 相对表达量的影响Fig.7 Effect of PAMK on the relative expression of mRNA for genes in mouse kidney tissue treated with CTX
3 讨论与结论
肾脏能清除有毒物质,如果肾脏功能不正常,会影响机体有害物质的排泄,使毒素的积累不能立即清除,从而可能导致各种疾病。目前肾脏疾病的防治已成为众多学者关注的焦点[15]。通过观察小鼠肾组织病理切片,HE 染色结果显示CTX 组肾小球萎缩,肾小管腔变形,周围有少许出血点并有炎性细胞浸润,导致肾组织出现明显的病理损伤。与CTX 组相比,经白术多糖治疗后,肾脏损伤程度明显改善,主要表现为肾小管结构清晰,周围炎性细胞明显减少,表明PAMK 治疗逆转了CTX 致肾脏组织炎症损伤。
本试验发现CTX 处理后,MDA 含量增加、SOD、GSH-Px、CAT 活性降低。经过PAMK 治疗后,MDA 的积累减少,小鼠机体内SOD、GSH-Px、CAT 活性和总抗氧化能力显著提高。CTX 的使用与机体发生氧化应激密切相关,有研究表明CTX 会引起动物体内MDA 升高,抑制GSH-Px、CAT 和SOD 的活性,削弱机体的抗氧化能力,破坏氧化系统和抗氧化系统的平衡,导致机体发生氧化应激现象[16]。氧化应激反应是一种高响应性的防御机制,如果长期处于氧化应激状态,可能会导致多种疾病的发生[17]。SAKR 等[18]发现了注射环磷酰胺可引起大鼠肾血管的扩张和充血,肾小管上皮细胞的空泡化以及肾小球的萎缩,并推测引起这些病理变化的原因可能是环磷酰胺诱导的氧化应激造成的。说明了CTX 处理的小鼠产生了氧化应激反应。近些年来,中药白术中的主要活性物质白术多糖被证明有抗氧化、抗炎及免疫调节等作用,如陈浩祥等[19]的研究发现,对岭南黄鸡饲喂白术多糖可显著提高血清中SOD 与GSH-Px 的活性,降低机体MDA 含量,从而缓解CTX 引起的机体氧化应激与肝细胞凋亡情况。上述结果表明了PAMK 能增强CTX 处理下的抗氧化能力,减少脂质过氧化程度,缓解由CTX 引起的氧化应激。
为了探究PMAK 对CTX 诱导的肾脏损伤的基因调控机制,本研究进行了转录组测序分析。研究结果显示,存在大量与抗氧化相关的DEGs,其中BCL6、Mfsd2a在本实验的转录组测序数据中有显著性差异。BCL6的表达水平相对于CTX 组显著上调,这种上调的程度与CTX 诱导的小鼠氧化应激的减轻呈正相关,同时PAMK 具有抗氧化的功能,BCL6的上调可能与PAMK 抗氧化应激反应的激活相关,从而减轻了CTX 诱导的氧化应激损伤。并且,有研究发现BCL6通过负调控NLRP3转录来减轻血管紧张素 II 或脂多糖诱导的人肾小管上皮细胞炎症,BCL6在自发性高血压大鼠中的过表达降低了SHR 的血压、NLRP3的表达和肾皮质炎症[20]。另外,有研究表明,主要Mfsd2a的下调可能通过抑制Caveola 介导的细胞内转运,维持血脑屏障的完整性和抗氧化功能,从而保护中枢神经系统的正常功从而维持了血脑屏障的完整性和抗氧化功能[21]。本实验的转录组测序结果与该研究一致,进一步支持了Mfsd2a下调有助于PAMK 缓解CTX 诱导的小鼠氧化应激反应。综上,表明PAMK 通过调节抗氧化途径来发挥其保护作用,从而减轻小鼠肾脏氧化损伤。
为了进一步探究PAMK 缓解CTX 诱导的肾损伤的机制,本研究进一步将两组DEGs 进行富集分析发现,两组交集通路中最显著的是花生四烯酸代谢通路,其中花生四烯酸代谢通路已经有研究发现与炎症发生与缓解密切相关。花生四烯酸(AA)作为细胞膜脂质的主要成分,是细胞膜脂含量的主要组成部分,主要由三种酶代谢:环氧合酶、脂氧合酶和细胞色素P450(CYP450)酶[22]。基于这三种代谢途径,AA 可以转化为各种代谢产物,引发不同的炎症反应。在肾脏中,前列腺素、血栓素、白三烯和羟基二碳四烯酸(HETEs)是AA 产生的主要代谢物。前列腺素和白三烯水平升高导致肾脏炎症损伤[23-25]。花生四烯酸可以通过花生四烯酸5-氧化酶的催化转化为5-羟基花生四烯酸,然后5-羟基花生四烯酸可以进一步转化为白三烯,白三烯是一类强炎症介质,能够引起血管扩张、增加血管通透性和促进炎症细胞的吸附和迁移[26]。PTGS1(也称为COX-1)是一种环氧合酶酶类,它参与花生四烯酸的代谢,催化花生四烯酸转化为前列腺素H2 的反应,PTGS1可能导致前列腺素和血栓素的过量产生,引发炎症反应和相关病理变化[27]。实时荧光定量结果显示,PTGSI、ALOX5和ALOX12CTX 组中mRNA 的表达量均呈现增高的趋势。表明了CTX 可能通过氧合酶和脂氧合酶途径诱导小鼠肾脏炎症损伤。此外,NF-κB是调控机体炎症反应的关键性转录因子,有研究发现缺血再灌注所致急性肾损伤大鼠的肾组织NF-κB 信号通路相关基因NF-κB表达量显著上升[28]。提示CTX 可能激活肾脏内的NF-κB通路导致小鼠肾脏损伤,上述结果证实,在PAMK+CTX 组中PTGS1、AOLX5、ALOX12、NF-κB的mRNA 表达量均有下降的趋势,PAMK 在CTX 诱导的肾损伤中发挥了关键的肾脏保护作用。
此外,AA 还可以通过细胞色素P450 单加氧酶产生的19-HETE 和20-HETE 调节肾离子运输;由CYP450 酶产生的环氧二十碳三烯酸(EETs)也在炎症过程中肾脏损伤中起着重要作用,CYP450 途径产生的EETs 能够促进肾小管细胞的增殖和分化,促进肾损伤后的修复。研究发现,EETs 还具有抗炎和抗氧化作用,可以减轻肾损伤引起的炎症和氧化应激反应,有助于保护肾脏免受进一步的损伤用[29-31]。并且,显著富集通路中的DEGs,大多参与CYP450 通路,通过对肾脏的转录组分析,共同调控基因可能是PAMK 的调控靶点,两组相关的关键基因Cyp2c65、Cyp2b9mRNA表达量呈相反的趋势与测序结果一致。Cyp2b9是细胞色素P450 家族的一员,众所周知,它通过产生超氧化物自由基而产生氧化应激[32]。Lu 等[33]研究结果表明,肝脏在HFD(高脂饮食)的作用与Cyp2b家族相关。此外,研究发现LPS 诱导肝脏和十二指肠中Cyp2c、Cyp2j总含量的强烈抑制;同样处理条件下,在十二指肠,Cyp2c65和Cyp2j6的表达显著减少[34]。这与上述实验结果一致,CTX 组Cyp2c65表达量显著减少,PAMK+CTX组表达量显著上升,说明了PAMK 可以通过Cyp2c65、Cyp2b9调控花生四烯酸代谢通路影响代谢性产物,缓解CTX 诱导的小鼠肾损伤。P450 酶具有许多生理相关功能,包括调节心脏血管张力[35-36],肾脏离子转运介导[37],血管抗炎特性[38],以及控制胰腺肽激素的分泌[39]。CYP2J 成员已被证明在AA 和亚油酸以及各种外源性药物的代谢中具有活性[40-41]。有研究发现CYP2J 酶可能参与脂肪酸代谢,并可能影响许多心血管和肾脏代谢过程[42-43]。同时PAMK 具有调节脂代谢酶的活性,提高抗氧化能力,PAMK 对CTX 所致的炎症和氧化应激有正向的调节作用[44]。另外,细胞色素P450 途径产生的EETs 加快对肾脏损伤细胞的增殖分化,促进血管新生,恢复肾脏基本功能,及时将代谢废物和有害物质排出体外[45]。以上结果表明,在CTX 诱导的小鼠肾损伤过程中,PAMK可能通过影响花生四烯酸环氧合酶的活性缓解小鼠肾脏损伤。
综上所述,本研究结果表明PAMK 可能通过调节花生四烯酸代谢通路,缓解小鼠肾脏的氧化应激反应,从而降低CTX 引起的肾脏损伤。这一发现揭示了PAMK 在维持肾脏形态和结构完整性方面的重要作用,这些结果为进一步探索PAMK 的调控机制以及开发相关治疗方法提供参考依据。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).
