人参与蒲公英根配伍对大鼠“上火”症状的调节作用
2024-05-12王佳男王慧敏章宝栗崔福顺朴春香李官浩李红梅崔明勋
王佳男,王慧敏,章宝栗,崔福顺,朴春香,李官浩,李红梅,崔明勋
(延边大学农学院,吉林延吉 133002)
人参(Panax ginsengC.A.Meyer)是伞形目五加科属下的多年生草本植物,至今已有4000 年的历史,被誉为“百草之王”[1]。研究表明,人参中已经分离鉴定40 余种人参皂苷单体,含有蛋白质、多肽、胆碱、果胶、多种糖类及维生素等有效成分,人参具有改善血压、加速肿瘤细胞凋亡、提高机体免疫力,增强老年人的智力、记忆力等功能[2-3]。服用人参益处繁多,但仍有部分人群食用人参会出现“上火”的临床症状。一般表现为牙喉疼痛、口舌生疮、便秘、血压升高等症状[4-5]。中医配伍理论可将存在副作用的中药材通过与其他中药合理地搭配在一起,使用药更加安全、有效[6-7]。蒲公英(Taraxacum mongolicumHand.-Mazz.)别名为婆婆丁,味苦、甘,性寒,是一种多年生草本药食同源植物[8]。蒲公英全草富含蒲公英甾醇、黄酮、绿原酸、果胶等化合物,同时含有多种维生素与丰富的蛋白质及碳水化合物[9]。蒲公英根中富含蒲公英醇、胆碱、有机酸、葡萄糖等物质,可抑制真菌生长,具有抗肿瘤、清热解毒、消肿散结、利尿通淋的功效,有很好的保健食用价值[10]。
人参和蒲公英根有较为突出的应用价值,近年来,国内外学者对人参和蒲公英根的化学成分及药理作用等研究较为深入。赵婷等[11]从腺苷酸活化蛋白激酶(adenosine monophosphate activated protein kinase,AMPK)能量代谢调节的角度,探讨红参引起上火的机制,结果表明,红参上火的大鼠模型能量代谢增强,与红参活化AMPK,上调下游能量代谢相关因子表达,加快三羧酸循环有关。Xu 等[12]通过动物实验,结果表明,人参组和红参组小鼠眼分泌物较多,而唾液分泌较少,这两组的Na+-K+-ATP 酶活性也显著升高,并认为这种酶的活性可能是服用人参“上火”的主要指标。经研究表明,蒲公英作用机理为清除自由基和抑制酪氨酸酶活性,同时其具有较好的体内外抗氧化活性[13-14],因此可以减少自身机体的损伤。临床应用上还有蒲公英-生麦芽-丝瓜络配伍主治急性乳腺炎,具有清热解毒、抑制泌乳、疏通乳络等作用;蒲公英-茵陈-柴胡配伍主治急性胆囊炎,具有利胆祛湿、清热解毒、理气通附等作用;蒲公英-苦参-白鲜皮配伍主治急性、亚急性湿疹,具有消风止痒、清热解毒、燥湿通络等作用[15]。虽然人参与蒲公英益处繁多且具有良好的生理功效,但依据中医配伍理论将其配伍研究甚少,缺乏科学验证。
人参参与机体物质的代谢,对机体体内血液运输系统有正面的药理作用;可改善机体内肠道菌群环境,调节人体免疫系统,提高人体免疫力;对脑及神经系统的健全有促进作用[3]。蒲公英其药理作用广泛,如提高机体免疫力,降血糖、抗菌、增强免疫力、抗肿瘤、护肝、延缓衰老等一系列作用,在食品药品及保健品等领域有着广泛的应用[8]。蒲公英根中生物活性含量最高,且蒲公英根价格低廉,资源丰富,但目前尚未有对人参与蒲公英根配伍是否有改善“上火”作用的相关报道,因此,本实验为改善食用人参后出现的“上火”症状,将中医配伍理论应用于食品,通过蒲公英根与人参进行配伍,提高人参的普适性,研究人参与蒲公英根配伍对“上火”症状的影响,对人参和蒲公英根的深度开发和综合利用具有积极作用。
1 材料与方法
1.1 材料与仪器
人参 延边大阳参业有限公司;蒲公英根 延边野林森茸药品有限公司;5-羟色胺(5-Hydroxytryptamine,5-HT)酶联免疫试剂盒(批号:JL 13043)、促甲状腺激素(Thyroid Stimulating Hormone,TSH)酶联免疫试剂盒(批号:JL11830)、17-羟皮质类固醇(17-HydroxyCorticoSteroid,17-OHCS)酶联免疫试剂盒(批号:JL11045)、皮质酮(corticosterone,CORT)酶联免疫试剂盒(批号:JL12455)、白细胞介素-2(Interleukin-2,IL-2)酶联免疫试剂盒(批号:JL13429)、白细胞介素-6(Interleukin-6,IL-6)酶联免疫试剂盒(批号:JL20896)、肿瘤坏死因子-α(Tumor Necrosis Factor-α,TNF-α)酶联免疫试剂盒(批号:JL13202)上海江莱生物科技有限公司;去甲肾上腺素(Norepinephrine,NE)酶联免疫试剂盒(批号:RA20557)上海酶联生物科技有限公司;SPF 级SD 大鼠,雄性60 只,6 周龄,体质量205±10 g 均由延边大学实验动物中心提供,实验动物使用许可证号:[SYXK(吉)2020-0009],于温度20~22 ℃,湿度60%~65%的环境下饲养,光照10~12 h/d。
MRBP 无创血压仪 美国IITC 公司;SP-Max 3500FL 酶标仪 美国Bio Tek Instruments,Inc 公司;S-42 叠加式恒温振荡器 苏州捷美电子有限公司;R202-2 旋转蒸发器 常州诺基仪器有限公司;SHZ-DⅢ循环真空泵 郑州市仪特仪器有限公司。
1.2 实验方法
1.2.1 水煎剂的制备 人参组水煎剂制备:去除人参根部,将其粉碎,称取粉碎的人参600 g,按1:10 比例加入蒸馏水混合搅拌均匀浸泡一夜。将人参浸泡液在95 ℃下浸提2 h 后冷却、过滤,然后进行二次浸提、过滤,将两次提取液混合后,因每人每天摄入人参剂量为3 g/60 kg,因此不同倍数的大鼠灌胃剂量为2、4 g/kg。用旋转蒸发器在70 ℃下浓缩成浓度为133、267 g/L 人参提取液,浓缩完毕后,冷冻备用;配伍组水煎剂制备:按1:4 比例称取粉碎人参与蒲公英根,加10 倍蒸馏水浸泡一夜,将人参浸泡液在95 ℃下浸提两次,用旋转蒸发器在70 ℃下浓缩成提取液。浓缩完毕后,冷冻备用。
1.2.2 动物分组 40 只SD 大鼠适应性饲养7 d 后,按体质量随机分为正常组、2 g/kg 人参提取液组、4 g/kg 人参提取液组、2 g/kg 配伍组、4 g/kg 配伍组,每组各8 只。各组每天同一时间段进行灌胃,正常对照组每日每次予以蒸馏水,1 次/1 d,连续灌胃19 d。实验饲料为延边大学饲料库加工,饲料配比为:玉米面(40%)、白面(15.4%)、豆粕(20%)、芝麻饼(5%)、麦麸(5%)、鱼粉(6%)、酵母粉(2%)、骨粉(2%)、豆油(1%)、盐(1%)、鸡蛋(2%)、多维(0.4%)、生长素(0.2%),且实验过程均按照正常饲养动物规定进行,且符合延边大学动物福利伦理要求。
1.2.3 指标检测 在实验过程中观察大鼠体毛变化及活动状态。每2 d 称量各组大鼠体质量;每5 d 对各组大鼠的剩余摄食量和饮水量进行称量并统计计算;每3 d 测量各组大鼠体温(肛温)。
每6 d 测量各组大鼠血压,连接好机器后,将大鼠放入支架,移开端板,使其爬进丙烯酸管的尾部侧开口,待大鼠进入固定器,安装末端板。然后将大鼠尾巴穿过尾袖传感器,使尾根部在其传感器处,将限制器放在系统的加热部分盖上盖子,让大鼠适应3~5 min,并确保腔室温度达到34 ℃时启动实时运行,在触摸屏上查看脉冲泳道显示,观察是否有脉冲检测显示,并进行记录[16-17]。
灌胃第19 d,所有实验大鼠禁食后取血。血液样本在室温下保持30 min 后,以3000 r/min 离心10 min,取上清液后用ELISA 法检测神经系统、内分泌系统、免疫系统的生化指标。
1.2.4 血清中5-HT、TSH、17-OHCS、CORT 测定将各试剂移至室温0.5 h,量取浓缩洗涤液稀释混匀备用;设置标准品孔、空白孔和样本孔,加入不同浓度的溶液,混匀,贴上封板膜,置37 ℃温育60 min;丢弃液体,将洗涤液填满每个孔,静置1 min 后扔掉洗涤液;每孔加入酶标亲和素50 μL(空白对照孔除外),混匀,贴上封板膜,置37 ℃温育30 min;每孔加入底物A 和B,37 ℃避光刺激15 min;以450 nm波长测定各孔的OD 值。
1.2.5 血清中NE、IL-2、IL-6、TNF-α测定 在室温下平衡60 min 后,从铝箔袋中取出所需板条,用子密封袋密封剩余板条,并将其放回4 ℃;设置标准品孔、空白孔和样本孔,加入不同浓度的溶液,混匀,贴上封板膜,置37 ℃温育60 min;清除液体,每孔加满洗涤液,放置1 min,丢弃液体,重复洗板5 次。每孔加入底物A 和B 各50 μL,37 ℃避光刺激15 min;每孔加入终止液50 μL,15 min 内,以450 nm 波长处测定各孔的OD 值。
1.3 数据处理
采用Excel 2019 和SPSS 19.0 对实验结果进行统计分析和处理,以(±s)表示所得数据,P<0.05 则表示组间有显著性差异,P<0.01 则表示组间差异极显著,由Excel 2019 及GraphPad Prism 8.0 进行绘制图表。
2 结果与分析
2.1 人参与蒲公英根配伍调节体内“上火”作用
2.1.1 人参与蒲公英根配伍对“上火”模型大鼠体征的影响 由图1 可知各组大鼠摄食量、饮水量的变化情况,灌胃19 d,各组大鼠的摄食量、饮水量差异均无统计学意义,说明服用人参与蒲公英根对大鼠摄食量及饮水量无副作用。各组大鼠体质量均呈稳定增长趋势,实验结果表明,服用人参及蒲公英根不会对体质量产生较大影响(表1)。第18 d,与正常组比较,各“上火”人参组大鼠活动均明显增加,捉拿时四肢挣扎剧烈,不易抓取,且出现不同程度毛发蓬松的现象,符合“上火”动物模型的体征表象[18-19],其中4 g/kg 人参提取液组大鼠毛发蓬松,烦躁多动的现象更明显。
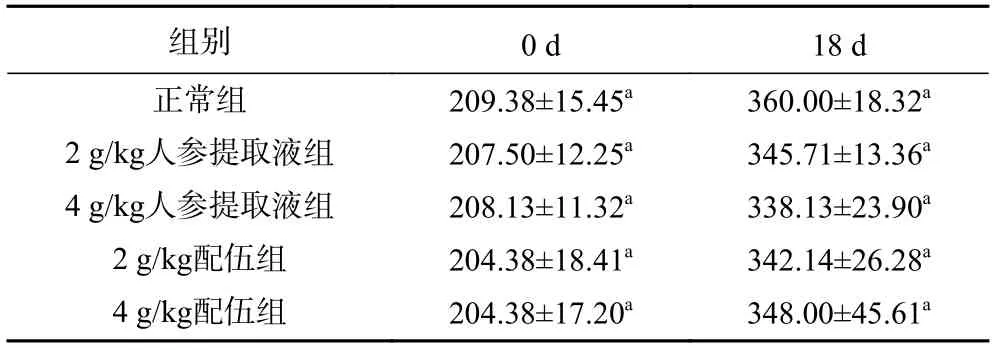
表1 人参与蒲公英根配伍对“上火”模型大鼠体质量的影响(n=8,g)Table 1 Effect of ginsing in the compatibility of dandelion root on the body mass of "Shanghuo" model rats (n=8,g)
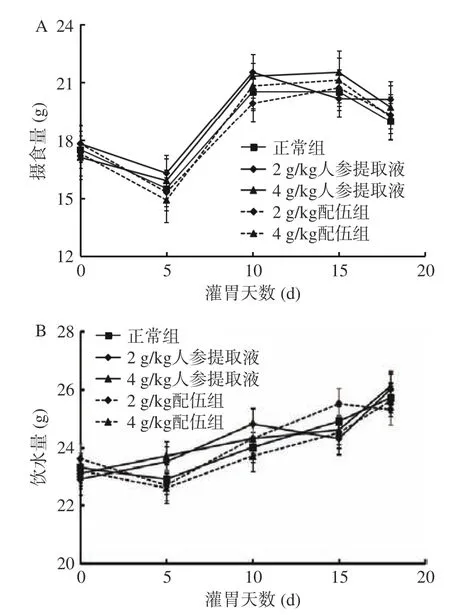
图1 人参与蒲公英根配伍对“上火”模型大鼠摄食量(A)与饮水量(B)的影响Fig.1 Effect of ginsing in the compatibility of dandelion root on the food intake (A) and water consumption (B) of rats with"Shanghuo" model
2.1.2 人参与蒲公英根配伍对“上火”模型大鼠体温的影响 人参与蒲公英根配伍对“上火”模型大鼠体温的影响如图2 所示。与正常组比较,2 g/kg 人参提取液组与4 g/kg 人参提取液组大鼠体温均随灌胃时间的延长而缓慢增长。与人参各组相比较,2 g/kg 配伍组与4 g/kg 配伍组体温下降,且存在显著性差异(P<0.05)。2、4 g/kg 配伍组与正常组大鼠体温变化基本一致,说明2、4 g/kg 配伍组均可有效调节“上火”所引起的体温升高现象。
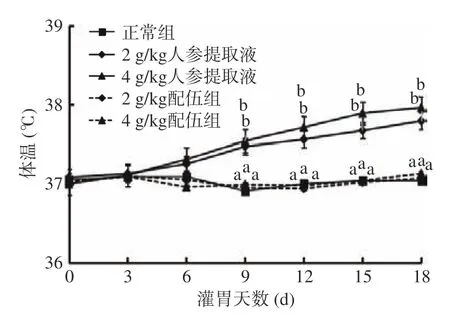
图2 人参与蒲公英根配伍对“上火”模型大鼠体温的影响Fig.2 Effect of ginsing in dandelion root compatibility on body temperature of rats with "Shanghuo" model
2.1.3 人参与蒲公英根配伍对“上火”模型大鼠血压的影响 人参与蒲公英根配伍对“上火”模型大鼠血压的影响由图3 所示。由图3 可知,与正常组比较,2、4 g/kg 人参提取液组大鼠血压均升高且呈高血压状态,差异有统计学意义(P<0.05);与人参各组比较,2、4 g/kg 配伍组大鼠血压降低,且与正常组一致,都在正常收缩压范围内(大鼠正常血压水平范围:90~140 mmHg[20-21]),收缩压差异有统计学意义(P<0.05)。
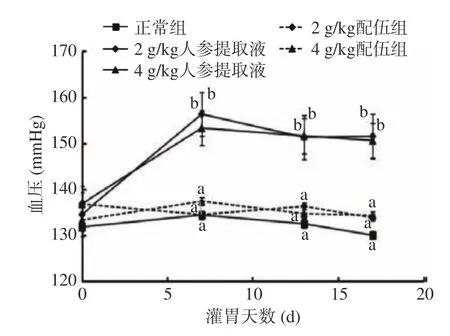
图3 人参与蒲公英根配伍对“上火”模型大鼠血压的影响Fig.3 Effect of ginsing in dandelion root compatibility on blood pressure of rats with "Shanghuo" model
2.1.4 人参与蒲公英根配伍对“上火”模型大鼠神经系统的影响 5-HT 作为一种单胺类神经递质,又是一种血管活性物质,在脑内分布极为广泛,在中枢神经系统和周围组织中发挥着多种生理作用[22]。当脑内5-HT 含量降低时,会出现一系列抑郁症、情绪不安、睡眠障碍、认知障碍、强迫行为和攻击行为等[23]。由图4 可知,各组大鼠5-HT 含量变化,与正常组比较,2、4 g/kg 人参提取液组“上火”大鼠5-HT含量均降低,具有显著性差异(P<0.05),因此会出现各人参组大鼠活动增加且抓取时挣扎剧烈的现象。与4 g/kg 人参提取液组比较,4 g/kg 配伍组5-HT含量回升且有极显著差异(P<0.01),可有效调节5-HT含量趋于恢复正常组的正常水平。因此本实验说明人参组可使5-HT 含量下降;4 g/kg 配伍组可以调节机体5-HT 含量,缓解“上火”引起的情绪焦虑、抑郁等情况。
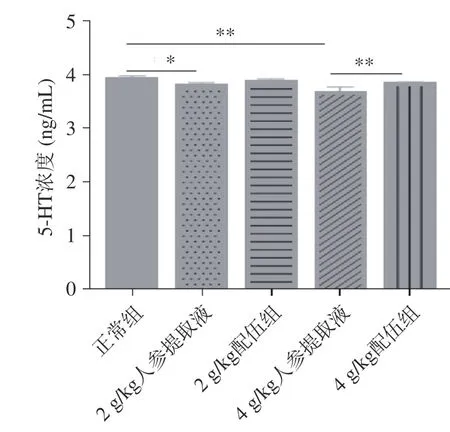
图4 人参与蒲公英根配伍对“上火”模型大鼠血清5-HT 的影响Fig.4 Effect of ginsing in dandelion root compatibility on serum 5-HT of rats with "Shanghuo"model
NE 是中性粒细胞合成、储存和释放的最重要的蛋白酶之一。它具有极强的破坏性,能够破坏组织,并且分解几乎所有的细胞外基质蛋白和许多重要的血浆蛋白[24-25]。由图5 可知各组大鼠NE 含量变化,与正常组比较,2、4 g/kg 人参提取液组NE 含量均显著升高,有显著性差异(P<0.01);与人参各组比较,2、4 g/kg 配伍组NE 含量均降低且有显著性差异(P<0.01),其中4 g/kg 配伍组大鼠NE 含量显著降低(P<0.01)且含量高于正常组。含量比较为,4 g/kg配伍组>正常组>2 g/kg 配伍组。因此4 g/kg 配伍组可有效缓解抑郁情绪,可在正常组的水平上增加NE 含量以预防抑郁情绪的产生。
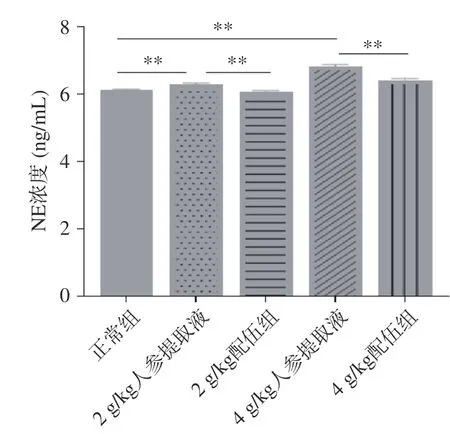
图5 人参与蒲公英根配伍对“上火”模型大鼠血清NE 的影响Fig.5 Effect of ginsing in dandelion root compatibility on serum NE of rats with "Shanghuo" model
2.1.5 人参与蒲公英根配伍对“上火”模型大鼠内分泌系统的影响 TSH 是由腺垂体分泌的一种糖蛋白,是直接调节甲状腺功能的关键激素,是反映下丘脑-垂体-甲状腺轴功能的敏感指标[26-28]。由图6 可知,各组大鼠TSH 含量变化,实验结果显示,与正常组比较,2、4 g/kg 人参提取液组大鼠TSH 含量均显著升高且具有显著性差异(P<0.05);与人参各组比较,2 g/kg 配伍组大鼠TSH含量差异无统计学意义,而4 g/kg 配伍组TSH 含量明显下降且具有显著性差异(P<0.01),4 g/kg 配伍组TSH 含量略高于正常组。
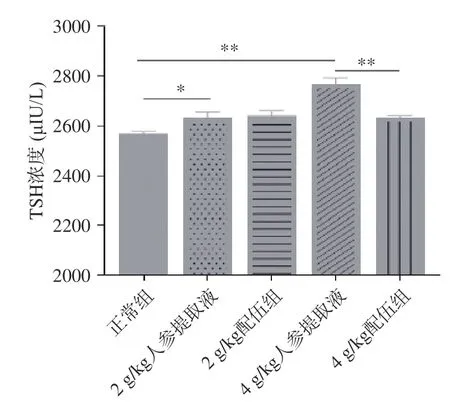
图6 人参与蒲公英根配伍对“上火”模型大鼠血清TSH 的影响Fig.6 Effect of ginsing in dandelion root compatibility on serum TSH of rats with "Shanghuo" model
17-OHCS 是指肾上腺皮质分泌的皮质醇、皮质素和它们的代谢产物,可反映交感神经-肾上腺皮质功能[29-30]。当肾上腺皮质功能亢进时,外周17-OHCS 的排出量增加。由图7 可知各组大鼠17-OHCS 含量变化,与正常组比较,2、4 g/kg 人参提取液组大鼠17-OHCS 含量均显著升高(P<0.01);与人参各组比较,2 g/kg 配伍组与4 g/kg 配伍组大鼠17-OHCS 含量均下降具有极显著性差异(P<0.01),其中2 g/kg 配伍组与4 g/kg 配伍组17-OHCS 含量水平略高于正常组。与正常组比较,本实验检测的各“上火”人参组血清TSH 和17-OHCS 的含量都显著上升。因此本实验结果表明,在确认人参温热特性的同时,人参“上火”模型存在交感神经-肾上腺功能的增强,而2、4 g/kg 配伍组配伍可较好的保留服用人参的温热效果,还可缓解因“上火”引起的TSH、17-OHCS 含量升高的症状。
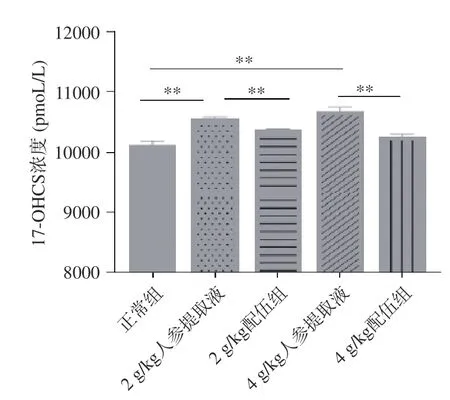
图7 人参与蒲公英根配伍对“上火”模型大鼠血清17-OHCS 的影响Fig.7 Effect of ginsing in dandelion root compatibility on serum 17-OHCS of rats with "Shanghuo" model
CORT 是肾上腺皮质分泌的一种糖皮质激素,其分泌受下丘脑促肾上腺皮质激素释放激素和垂体促肾上腺皮质激素的调控[31-32]。由图8 可知,各组大鼠CORT 含量变化,结果显示,与正常组比较,2、4 g/kg 人参提取液组大鼠血清中CORT 含量均明显升高且具有显著性差异(P<0.01);与人参各组比较,2 g/kg 配伍组与4 g/kg 配伍组大鼠血清中CORT 含量均极显著性降低(P<0.01),且2 g/kg 配伍组与4 g/kg 配伍组CORT 含量均略高于正常组。因此,2 g/kg 配伍组与4 g/kg 配伍组可较好调节因服用人参引起的机体CORT 含量升高的症状。
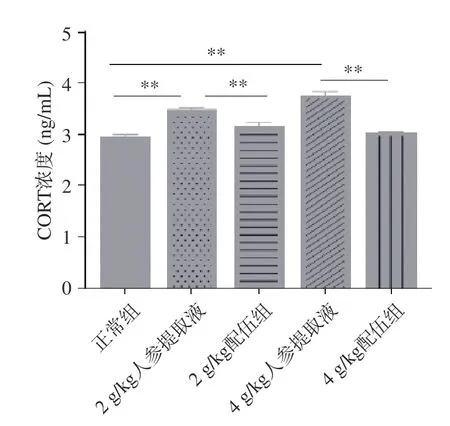
图8 人参与蒲公英根配伍对“上火”模型大鼠血清CORT 的影响Fig.8 Effect of ginsing in dandelion root compatibility on serum CORT of rats with "Shanghuo" model
2.1.6 人参与蒲公英根配伍对“上火”模型大鼠免疫系统的影响 白细胞介素(Interleucine,IL)是指在白细胞或免疫细胞之间相互作用、相互协调以完成造血和免疫调节功能的淋巴因子。IL 在传递信息的同时,激活和调节免疫细胞,介导T 细胞和B 细胞的活化、增殖与分化,在炎症反应中发挥重要作用[33-36]。由图9~图10 可知,与正常组比较,2、4 g/kg 人参提取液组大鼠IL-2、IL-6 含量均升高,且具有显著性差异;与人参各组比较,4 g/kg 配伍组大鼠IL-2、IL-6含量变化差异无统计学意义,而2 g/kg 配伍组IL-2、IL-6 含量下降且差异有统计学意义(P<0.05)。IL-2含量比较为,4 g/kg 配伍组>2 g/kg 配伍组>正常组,IL-6 含量比较为,4 g/kg 配伍组>正常组>2 g/kg 配伍组。综合分析,2 g/kg 配伍组与4 g/kg 配伍组比较,4 g/kg 配伍组可较好的保留因服用人参提高机体免疫的效果。因此说明4 g/kg 配伍组可调节因服用人参引起的“上火”症状,同时还可较好的增强大鼠机体的免疫功能。
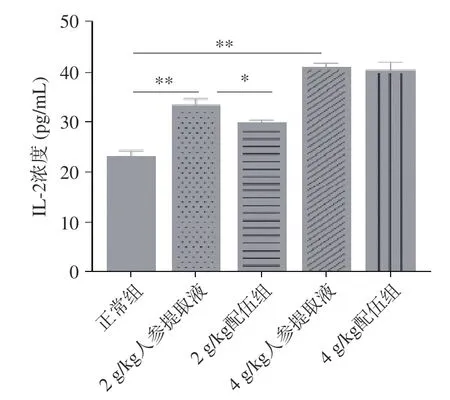
图9 人参与蒲公英根配伍对“上火”模型大鼠血清IL-2 的影响Fig.9 Effect of ginsing in dandelion root compatibility on serum IL-2 of rats with "Shanghuo" model

图10 人参与蒲公英根配伍对“上火”模型大鼠血清IL-6 的影响Fig.10 Effect of ginsing in dandelion root compatibility on serum IL-6 of rats with "Shanghuo" model
TNF-α是由单核-巨噬细胞产生的多显性细胞因子,具有调节免疫应答,促进细胞生长分化等多种生理功能,其生物学活性是通过细胞表面的特异性受体传递信号的,是具有生物学活性的重要炎性介质之一[37-38]。由图11 可知,各组大鼠TNF-α含量变化,与正常组比较,2、4 g/kg 人参提取液组大鼠TNF-α含量均升高且具有显著性差异(P<0.01);与人参各组比较,2 g/kg 配伍组大鼠TNF-α含量无明显变化,4 g/kg 配伍组大鼠TNF-α含量降低且具有显著性差异(P<0.01),且其含量高于正常组,因此本实验结果证明人参能使TNF-α含量增加,并刺激淋巴细胞增殖,而4 g/kg 配伍组可有效改善TNF-α含量的增加,从而抑制炎症反应。
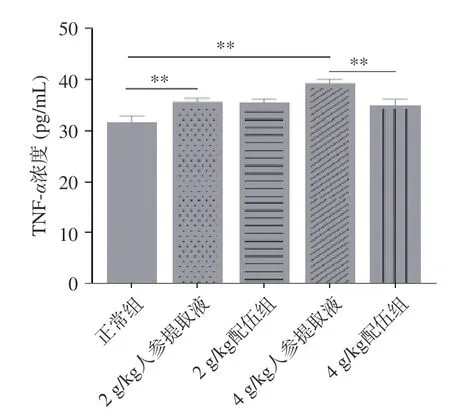
图11 人参与蒲公英根配伍对“上火”模型大鼠血清TNF-α 的影响Fig.11 Effect of ginsing in dandelion root compatibility on serum TNF-α of rats with "Shanghuo" model
3 结论
本实验针对中医养生配伍理论与食品相结合,把人参与蒲公英根进行配伍,结果表明,配伍后可改善动物体温及血压,同时改善神经系统(5-HT 升高,NE 降低)、内分泌系统(TSH、17-OHCS、CORT 降低)、免疫系统(IL-2、IL-6、TNF-α降低)相关指标的分泌。
因此,在人参与蒲公英跟配伍缓解“上火”模型组大鼠的相关生化指标的基础上,后续可通过利用代谢组学等技术将配伍进行深层次研究,体现配伍机制的差异以及不同配伍比例化学成分的变化规律,明确调节“上火”症状的协同作用,提高其应用范围,以期更全面地发挥人参与蒲公英根配伍的优势作用,为复方配伍规律及食品开发提供新方法。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).
