螺旋藻多酚复合纳米微胶囊的制备与稳定性分析
2024-05-12钟秋帆孙玮鸿李方巍曾名湧
钟秋帆,李 崴,孙玮鸿,李方巍,*,曾名湧,*
(1.中国海洋大学三亚海洋研究院,海南三亚 527000;2.中国海洋大学食品科学与工程学院,山东青岛 266000)
螺旋藻是目前科学研究发现的理想的人类食品,被一些学者誉为“营养冠军”[1]、未来食物[2],其提取物已经在抗癌药物研发领域得到认可[3]。此外,螺旋藻还具有协助治疗疾病的功效,备受科研人员的推崇,是目前发现的营养最均衡全面的纯天然食品[4]。螺旋藻不仅可以应用于功能饮料中,还被用于乳制品、意大利面、油衍生物和营养补充剂的生产[5]。螺旋藻中含有多种生物活性物质,如藻蓝蛋白、酚类、多糖、多不饱和脂肪酸(PUFA)、类胡萝卜素、维生素和甾醇。这些化合物大多数对于治疗心血管疾病(CVD)、高胆固醇、高血糖、肥胖、高血压、肿瘤和炎症性疾病中起着重要作用,被认为是一种天然药物[6]。
多酚类物质分子中具有多个酚羟基,属植物的次生代谢产物,主要包括黄酮类、单宁类、酚酸以及花色苷等。许多研究表明,多酚类物质具有良好的抗氧化活性,对辅助治疗疾病有一定的帮助。多酚是天然抗氧化剂,可作为屏障,防止活性氧(ROS)引起的氧化应激。尽管多酚具有多种有益人体的好处,然而,由于多酚对热敏感且容易氧化[7],它们的使用在很大程度上受到限制。多酚在食物制备、循环、胃肠道中的不稳定性或弱稳定性限制了它的作用和潜在的治疗优势[8]。因此,为了最大限度地发挥人类从加工食品中摄入多酚的有益效果,必须深入系统研究多酚在食品加工中的稳定性,以评估其真正的生物活性。目前大多数关于多酚稳定性的研究都集中在微胶囊上。
微胶囊技术是一种新型储存包装技术,将一些性质不稳定的物质通过壳类材料进行包裹,通过隔离达到保护作用。这些性质不稳定的物质可以是固体、液体,也可以是气体。壳类材料主要是安全性能较高的天然或者合成大分子聚合物,如植物胶类、碳水化合物类、纤维素类、蛋白质类以及脂类等,对内容物具有很强的保护作用[9]。其保护作用主要体现在以下三方面:防止强光、高温及强酸强碱对内部物质的辐射与腐蚀,提高其储存时间;类似于药物胶囊,能够使内部活性成分持续、缓慢、长久地释放生物活性,延长其发挥作用的时间;遮盖不良风味或令人不愉悦的感官特性。例如黄酮类化合物味苦,将其包被在胶囊中,可以有效改善其口感[10]。目前为了获得理想的包埋效果,一般采用多种材料组合为壳,以期做到相互补充。
针对这一问题,本文提出将多酚类化合物与多孔淀粉和玉米醇溶蛋白进行复合包埋,以提高其稳定性。制备负载螺旋藻多酚的螺旋藻多酚-多孔淀粉微胶囊(Phe-PS)和螺旋藻多酚-多孔淀粉-玉米醇溶蛋白微胶囊(Phe-PS-Zein),进行结构表征和稳定性分析,以保证螺旋藻多酚在食品生产过程中的有效应用。
1 材料与方法
1.1 材料与仪器
螺旋藻干粉 海南新大泽生物技术有限公司;胃蛋白酶(1:3000)、猪胰蛋白酶(1:250)、1,1-二苯基-2-苦基肼(DPPH)北京索莱宝科技有限公司;玉米醇溶蛋白(Zein)、乙醇、大孔树脂XDA-7、福林酚、蜡质玉米淀粉、乙酸钠、糖化酶(10 万U/g)上海源叶生物科技有限公司;其他试剂均为分析纯 上海麦克林生化科技股份有限公司。
AB135-S 型精密电子天平 瑞士梅特勒公司;DF-101S 型磁力搅拌器 上海力辰仪器科技有限公司;N-1210BV-W 型旋转蒸发仪 上海爱朗仪器有限公司;Neofuge 1600R 型台式冷冻离心机 上海Heal Force;Power Wave XS2 型多功能酶标仪 美国Bio-Tek 公司;TS-211GZ 型恒温摇床 上海仪纯实业有限公司;DW-86L590D 型超低温冰箱 上海科菱威生物科技有限公司;FJ-200-SH 型高速均质机 上海沪析实业有限公司;BILON-2000FD 型真空冷冻干燥机 上海新诺仪器集团有限公司;UV-6100 型紫外可见分光光度计 上海元析仪器有限公司;D8 ADVANCE 型X 射线衍射仪 德国布鲁克公司;Gemini300 型场发射扫描电镜 德国蔡司集团;STA 449 F3/F5 型差示扫描量热仪 德国耐驰公司;Nicolet IS10 型红外光谱仪 美国尼高力仪器公司。
1.2 实验方法
1.2.1 螺旋藻多酚的提取纯化 向5 g 螺旋藻粉中添加100 mL 溶剂(乙醇:水=3:1,V/V),并在避光条件下以1000 r/min 的转速磁力搅拌90 min,提取液在5000×g 下室温离心5 min,然后通过0.45 μm 滤膜过滤,收集上清液,获得的提取液两过XDA-7 大孔树脂吸附柱,除去色素及杂质,然后在40~50 ℃的温度范围内进行旋蒸浓缩,浓缩液冻干即为螺旋藻多酚(polyphenol,Phe),备用[11]。
1.2.2 负载螺旋藻多酚的螺旋藻多酚-多孔淀粉(Phe-PS)微胶囊的制备
1.2.2.1 多孔淀粉的制备 多孔淀粉(porous starch,PS)的制备参考张超[12]的方法,并略有修改。称取15 g 蜡质玉米淀粉,添加乙酸钠缓冲液(50 mmol/L,pH4.5)300 mL 配制成5%淀粉悬浮液。然后将悬浮液置于40 ℃水浴锅中预热,待温度恒定后,加入糖化酶(40 U/mL)3 mL,在250 r/min 条件下搅拌反应2.5 h。然后添加1 mol/L NaOH 溶液调节pH 至9.0终止反应,反应液经室温离心(10000 r/min,20 min)后保留沉淀,并用去离子水对沉淀进行3 次洗涤,最后进行冻干,得到PS。
称取1 g PS,将其溶于100 mL 80 ℃蒸馏水中,并将容器置于60 ℃水浴中磁力搅拌至完全溶解;称取100 mg Phe,将其溶于10 mL 无水乙醇,缓慢滴入热淀粉浆中,用磁力搅拌器继续搅拌至芯材完全溶解,同时加热除去乙醇,8000 r/min 的转速下室温均质1 min,倒入平板中,液面不超过5 mm,放入-80 ℃冰箱预冻24 h,真空冷冻干燥至恒重,研磨,得到负载Phe 的Phe-PS 微胶囊粉末,存放在4 ℃下进行进一步分析。
1.2.2.2 包埋率的测定 复合微胶囊颗粒包埋率检测参考Ahmad 等[13]的方法,并略有修改。取3 mL新鲜制备的样品在4 ℃下10000×g 离心30 min,获得上清液,在765 nm 处测定上述溶液的吸光度。采用标准曲线(y=0.014+1.095x)计算Phe 的含量,微胶囊的包埋率(EE)计算公式如下:
1.2.3 螺旋藻多酚-多孔淀粉-玉米醇溶蛋白(Phe-PSZein)复合微胶囊颗粒制备 PS 储备液的制备:称取1.0 g 多孔淀粉溶于100 mL 超纯水中,在磁力搅拌(1000 r/min)下过夜,使PS 充分水合,4 ℃下储存备用。
Phe-Zein 溶液的制备:准确称取1.0 g Zein 溶于50 mL 80%(v/v)的乙醇溶液中,振荡2 h,配制成浓度为20 mg/mL 的Zein 储备液。在Zein 储备液中加入适当体积的多酚溶液(Zein:Phe=20:1,v/v),避光搅拌(800 r/min)1 h,离心(5000×g,10 min)除去不溶性杂质,现用现配[14]。
多酚微胶囊颗粒制备参考Meng 等[14]的方法,并略有修改。用无菌注射器将Phe-Zein 溶液缓慢滴加至含有PS 的水溶液中(PS:Zein:Phe=1:1:20,v/v/v),在避光条件下800 r/min 搅拌2 h,旋蒸除去多余的乙醇,添加适量的超纯水补偿乙醇的损失,得到Phe-PS-Zein 微胶囊颗粒。
1.2.4 螺旋藻多酚微胶囊的结构表征
1.2.4.1 粒径和多分散性指数的表征 将样品(0.01%,w/v)悬浮在超纯水中,在超声波浴中以40 kHz 的频率超声30 min,使聚合物完全分散。基于动态光散射技术[15],利用激光粒度仪测定复合纳米颗粒的粒径和多分散性分布指数(PDI)。
1.2.4.2 红外光谱分析(FTIR)利用FTIR 表征微胶囊颗粒内的分子间相互作用[16]。采用溴化钾压片法制备样品,样品与溴化钾的质量比约为1:100。首先在玛瑙中将样品和溴化钾研成细粉,再用油压机压成片。为避免溴化钾吸潮,整个实验过程在红外灯下操作。红外参数如下:光谱波长范围为400~4000 cm-1,分辨率为2 cm-1,扫描64 次。
1.2.4.3 X 射线衍射(X-ray diffractometry,XRD)和X 射线光子能谱分析(X-ray photoelectron spectroscopy,XPS)表征 通过XRD 测定样品的晶体结构,根据刘夫国[16]的方法并稍作修改,将粉末样品在含有饱和NaCl 溶液的干燥器中平衡一周。扫描速度为2°/min 时角为5°~35°。将冻干后的样品采用X射线光电子能谱仪分析粒子的表面元素。测试条件:管电流40 mA,管电压40 kV,Cu 靶(1.5406 eV),Co靶(1.79026 eV),在0~1000 eV 内进行全扫描。
1.2.4.4 热重分析(DSC)根据Rawel 等[17]的方法并稍作修改,用于分析微胶囊颗粒的热稳定性。准确称量15.0 mg 的样品放入标准铝盘中,保证良好的传热接触。采用铟来校正仪器,并用空铝盘做基线校准。使用氮气作为保护气,温度扫描范围为25~600 ℃,加热速率为10 ℃/min,测试完成后采用液氮进行物理降温。
1.2.5 螺旋藻多酚微胶囊的稳定性分析
1.2.5.1 螺旋藻多酚微胶囊的储存稳定性 将新制备的螺旋藻多酚微胶囊颗粒和游离的螺旋藻多酚,在4 ℃条件下保存21 d,每隔3 d 测定一次Phe 含量,按下述公式计算储存过程中螺旋藻多酚的保留率。
式中:Mt表示t min 后微胶囊或提取物中多酚含量,mg;M0表示0 min 微胶囊或提取物中多酚含量,mg。
1.2.5.2 O2对螺旋藻多酚微胶囊稳定性的影响 为探究O2对螺旋藻多酚微胶囊的影响,本实验参照安小琦[18]的方法略有改动。取5 份0.1 g 螺旋藻多酚提取物和5 份0.2 g 螺旋藻多酚微胶囊,放置于暗室中,每隔5 d 测量其多酚含量,计算其多酚保留率,每个样品进行三次重复试验,考察O2对螺旋藻多酚微胶囊稳定性的影响。
1.2.5.3 还原剂(NaHSO3)对螺旋藻多酚微胶囊稳定性的影响 参照侯顺超[19]的方法测定还原剂(NaHSO3)对螺旋藻多酚微胶囊稳定性的影响,配制浓度分别为0.25、0.5、0.75、1、1.25 和1.5 mg/mL的NaHSO3溶液,加入一定量的螺旋藻多酚和螺旋藻多酚微胶囊制品,充分溶解后,将其置于室温条件下避光保存1 h,测量其多酚含量,并以1.2.5.1 所述公式计算多酚保留率,每个样品进行三次重复试验,考察还原剂对螺旋藻多酚微胶囊稳定性的影响。
1.2.6 螺旋藻多酚微胶囊的抗氧化性分析
1.2.6.1 DPPH 自由基清除能力分析 参照Ahmad等[20]的方法并略作修改,将4 mL 样品加入4 mL DPPH 乙醇溶液中并充分混合,将混合物溶液置于黑暗中30 min。在517 nm 处测量上述溶液的吸光度(At),并使用以下公式计算样品的自由基清除活性(%):
式中:Ab表示4 mL 样品溶液与4 mL 无水乙醇的吸光度;Ac表示4 mL去离子水和4 mL DPPH 乙醇混合溶液的吸光度;At表示4 mL 样品溶液与4 mL DPPH 乙醇溶液的吸光度。
1.2.6.2 铁离子还原法分析抗氧化能力 参考杨少辉等[21]的研究方法,并略有修改。将0.3 mol/L pH3.6的乙酸缓冲溶液,与20 mmol/L FeCl3(H2O)6,10 mmol/L TPTZ 按照10:1:1(v/v/v)制备成FRAP储备液。将其混匀后于37 ℃条件下孵育60 min,现用现配。取1 mL 的待测样品与15 mL FRAP 储备液混合,反应4 min 后,在593 nm 处测其吸光值。
1.2.7 体外模拟消化特性测定 体外模拟消化参考Minekus 等[22]的方法,并略有修改。本研究制备的螺旋藻多酚微胶囊在口腔中停留的时间短暂,因此本研究中不考虑口腔消化情况。将3 g 微胶囊颗粒加入15 mL 无胃蛋白酶模拟胃液(SGF)中,并置于37 ℃水浴中。将2000 U/mL 胃蛋白酶加入15 mL SGF溶液中,并用5 mol/L HCl 将pH 调节至2.0。随后取15 mL 的胃糜与等体积的人工肠液(SIF)混合,立即用1 mol/L 氢氧化钠溶液将pH 调节至7.0,加入终浓度为100 U/mL 猪胰蛋白酶,6.25 mg/mL 胆汁提取物。混合溶液在37 ℃,150 r/min 的水浴条件下反应2 h。各相反应结束后,取10 mL 样品在4 ℃,10000×g 离心30 min,收集上清中的Phe,上清液经0.45 μm 滤膜过滤后,参考Karakashov 等[23]的方法测定多酚含量。多酚的生物利用度按照公式计算:
1.3 数据处理
每组实验重复3 次,以平均值±标准差表示,用Origin 8.1 软件进行数据作图,用SPSS 22.0 进行显著性分析(P<0.05)。
2 结果与分析
2.1 结构和形貌表征
2.1.1 粒径和多分散性指数 如图1 所示,相较于Phe,Phe-PS 和Phe-PS-Zein 的粒径明显减小,这是因为Phe 在溶液中是以聚集状态存在的,这种聚集导致Phe 的粒径较大,而PS 和(或)Zein 的加入打破了这种聚集状态,对Phe 进行了包埋;另一方面,相较于Phe-PS,Phe-PS-Zein 的PDI 降低,表明Phe-PSZein 的分子量分布更均匀[24]。

图1 Phe,Phe-PS 和Phe-PS-Zein 的粒径分布与多分散性指数Fig.1 Particle size distribution and polydispersity index of Phe,Phe-PS and Phe-PS-Zein
2.1.2 FTIR 表征 Phe,PS 和Phe-PS 的FTIR 光谱如图2 所示。在多孔淀粉中,波长3428 cm-1左右的宽峰代表OH 的拉伸振动,927 和1159 cm-1之间的区域通常与C=C,C=O 和C=H 的拉伸或弯曲振动有关[25]。光谱在3428 cm-1(苯酚OH 基团的拉伸振动)、2928 cm-1(脂肪族C-H 基团的拉伸振动)、1631 cm-1(芳香族C=C 基团的拉伸振动)、1327、1167、1040 cm-1(C=O 基团的对称拉伸振动)处显示宽吸收峰[26];829 和738 cm-1处的吸收峰归因于芳香环上C-H 基团的弯曲振动[27]。
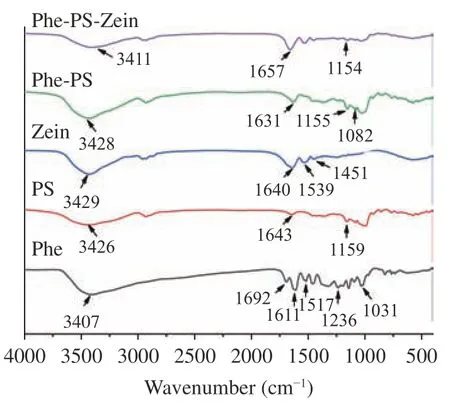
图2 Phe,Phe-PS 和Phe-PS-Zein 的FTIR 表征Fig.2 FTIR spectra of Phe,Phe-PS and Phe-PS-Zein
Phe-PS 微胶囊颗粒中也有类似的峰,且峰的范围很广,说明螺旋藻多酚被包裹在多孔颗粒中,没有明显的相互作用。此前有研究报道指出,氢键是酚类化合物与淀粉基壁材之间的主要相互作用[28]。在本研究中,多酚和淀粉分子中的-OH 基团可能在氢键的形成中发挥了重要作用,氢键的形成导致了多酚包封后淀粉光谱的变化。此外,在螺旋藻多酚颗粒中还观察到苯环的存在,其波数为848 cm-1。此外,高峰期为1692 cm-1对应于多酚芳香环的C=C 拉伸,在1631 cm-1处的峰显示在Phe-PS 复合物图谱中。该结果表明,由于多酚的一个或两个芳香环进入多孔淀粉的螺旋腔,是因为相互作用而发生的变化。在姜黄素-β-环糊精包涵体复合物中也报告了类似的现象[29]。在Phe-PS 颗粒中发现了更宽且不那么尖锐的条带,再次证实了螺旋藻多酚被包裹在淀粉纳米颗粒中。至于三种物质的FTIR 光谱差异,可以归因于多酚和多孔淀粉的聚合程度。
2.1.3 XPS 表征结果 为了进一步研究各制备样品的化学状态以及键能情况[13],对不同负载量样品进行了高分辨率XPS 光谱分析。图3 为O 轨道高分辨谱图,可以看到对于不同单质及复合物样品,结合能位于532.20 eV 的特征峰归因于样品中的C-O,位于533.28 eV 峰值主要是材料中羟基(-OH)所引起的衍射峰[30]。而在534.01 eV 的特征峰主要是由于样品O-C=O 键或者表面吸附水所致。Phe,PS 和Zein 中Zein 的C-O 键结合能最低,含量也最高,这与FTIR 结果一致。Phe 负载了PS 后结合能以及含量变化较小,而复合Zein 后C-O 含量明显增加,结合能也降低,表明Zein 与Phe-PS 成功复合。该结果与梁宏闪[31]的研究结论一致。
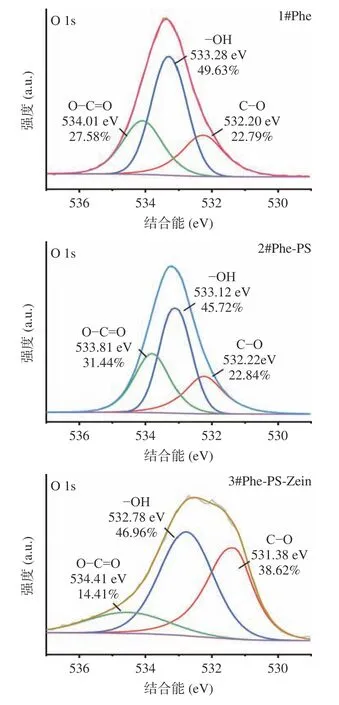

图3 Phe,Phe-PS,Phe-PS-Zein,PS 和Zein 的XPS 谱图(O 轨道高分辨谱图)Fig.3 XPS survey spectra of Phe,Phe-PS and Phe-PS-Zein(O Orbital high-resolution spectra)
2.1.4 XRD 表征结果 图4 为Phe,Phe-PS,Phe-PS-Zein,PS 和Zein 纳米颗粒的XRD 谱图。通过Jade 软件对测得的XRD 数据进行分析处理,经过寻峰对准处理可以发现,上述五种物质在15°~30°之间存在明显的衍射峰。对于Phe 而言,在22.9°存在明显的晶体衍射峰,但与PS 复合后,衍射峰明显左移,在20.4°观察到宽化的衍射峰。根据Debye-Scherrer公式[32],衍射峰宽化表明颗粒尺寸有所降低。添加Zein 后,晶体衍射峰强度有所降低,主要与Zein 的无定型结构有关。此外,从衍射峰尖锐程度来看,添加PS 和Zein 后,复合物的结晶度有所降低。通常而言,内部结晶区晶粒尺寸可通过X-射线衍射峰强度良好展现,若存在越小的晶粒尺寸,则会形成越低的衍射峰强度[33]。此现象实质上是多糖与蛋白质发生作用而再次排列组合,更大颗粒由此形成。

图4 Phe,Phe-PS,Phe-PS-Zein,PS 和Zein 的XRD 谱图Fig.4 XRD patterns of Phe,Phe-PS,Phe-PS-Zein and Zein
2.2 稳定性表征
2.2.1 DSC 表征 利用DSC 曲线研究了Phe,Phe-PS 和Phe-PS-Zein 的热稳定性,从图5 中可以看出,Phe 的吸热峰在Phe-PS 和Phe-PS-Zein 中未出现,表明Phe 被很好地包裹在复合微胶囊颗粒中[34]。此外,双层壁材包埋微胶囊颗粒的变性温度升高,这是由于Zein 和(或)PS 与Phe 之间相互作用,使得复合微胶囊颗粒的热稳定性增强。之前的研究表明,加入蛋白质做壁材后的微胶囊的热稳定性明显提高,这是由于蛋白质增加了生物聚合物颗粒之间的空间位阻[35]。
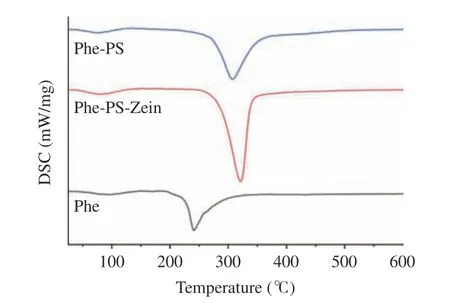
图5 Phe,Phe-PS 和Phe-PS-Zein 的DSC 曲线Fig.5 Differential scanning calorimetry of Phe,Phe-PS and Phe-PS-Zein
2.2.2 螺旋藻多酚微胶囊的储存稳定性 如图6 所示,4 ℃下储存21 d 后,Phe-PS-Zein 和Phe-PS 中螺旋藻多酚的保留率分别为80.97%和67.64%,比对照组的Phe 保留率(47.03%)分别高了33.94%和20.61%。这是因为PS 对Phe 的包埋起到了保护Phe的作用,而Phe-PS-Zein 内部的分子间相互作用更强,形成的结构更紧密,此外,玉米醇溶蛋白由于其分子内疏水作用而更易于聚集,多孔淀粉与其相互作用能够减弱玉米醇溶蛋白的疏水性,并增强微胶囊颗粒之间的静电和空间排斥,且加入玉米醇溶蛋白增加了分散体系的粘度,使其具有更好的物理稳定性,对Phe 的保护效果也更好。
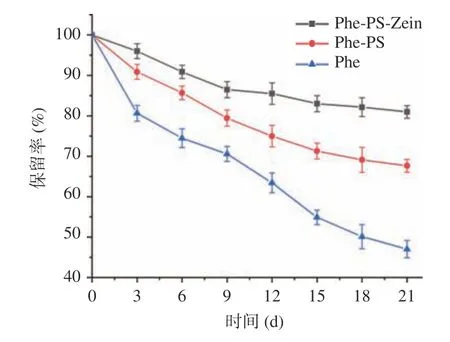
图6 复合微胶囊在4 ℃条件下储存21 d 后螺旋藻多酚的保留率Fig.6 Effects of the retention rate of polyphenols from Spirulina stored at 4 °C for 21 days
2.2.3 O2对螺旋藻多酚微胶囊稳定性的影响 将Phe,Phe-PS 和Phe-PS-Zein 一同放在接触空气的暗室中,每隔5 d 测定其Phe 含量并计算其保留率,结果如图7 所示。对照组的Phe 保留率在避光且与空气接触30 d 后下降到47.03%,同等条件下,Phe-PS和Phe-PS-Zein 保留率分别下降到77.64%和80.97%,证明将Phe 微胶囊化,可以有效减少O2对其降解的影响,且Phe-PS-Zein 提高Phe 稳定性的效果更好。另一方面,随着时间的延长,对照组Phe 在空气中的保留率下降趋势越来越大,而复合壁材包埋的Phe保留率一直平稳下降,说明微胶囊化说明复合微胶囊化对Phe 有着较好的保护作用。
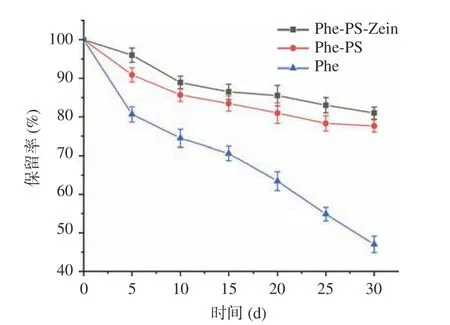
图7 O2 对复合微胶囊中螺旋藻多酚保留率的影响Fig.7 Effects of O2 on the retention rate of polyphenols from Spirulina
2.2.4 还原剂(NaHSO3)对螺旋藻多酚微胶囊稳定性的影响 将Phe,Phe-PS 和Phe-PS-Zein 溶解于不同浓度的NaHSO3溶液中,如图8 所示,还原剂对Phe-PS-Zein 的影响最小,随着NaHSO3浓度的增加,微胶囊多酚保留率下降趋势不明显,维持在90%以上。而Phe-PS 中螺旋藻多酚保留率随着NaHSO3浓度的增加下降至80%以下,当NaHSO3浓度为150 mg/mL时Phe 的保留率为73.45%,因此,复合壁材胶囊化后的螺旋藻多酚更加稳定,且Phe-PS-Zein 比Phe-PS 对Phe 的保护效果更好。

图8 NaHSO3 对复合微胶囊中螺旋藻多酚保留率的影响Fig.8 Effects of NaHSO3 on the retention rate of polyphenols from Spirulina
2.3 抗氧化性测定
天然多酚具有一定的抗氧化能力[36],可抑制单线态氧与自由基的活性,从而保护人体细胞和组织免受氧化损伤[37]。如图9 所示,对DPPH 实验结果进行统计学分析,结果表明三者对自由基的清除率具有显著性差异(P<0.05),Phe-PS 和Phe-PS-Zein 清除自由基的活性高于Phe,且Phe-PS-Zein 对DPPH 自由基的清除能力高于Phe-PS。FRAP实验也表现出相同的趋势且差异显著(P<0.05),这是因为Zein 中富含芳香族氨基酸如酪氨酸、苯丙氨酸和色氨酸,它们能够螯合过渡金属Fe3+,从而起到有效的抗氧化作用,使得Phe-PS-Zein 对Fe3+表现出优异的抗氧化保护能力[38]。

图9 Phe,Phe-PS 和Phe-PS-Zein 对DPPH 自由基清除力和对Fe3+的还原力Fig.9 DPPH scavenging activity and Ferric-reducing ability of Phe,Phe-PS 和Phe-PS-Zein
2.4 体外模拟消化测定
Phe 的体外生物利用率取决于溶解在胃肠道中的Phe 浓度[39]。如图10 所示,消化系统的水基环境限制了多酚的吸收与利用,SGF 期后,对照组的Phe释放量为28.97%±1.89%,而Phe-PS 和Phe-PSZein复合微胶囊颗粒中多酚的生物利用率分别为20.64%±1.09%和19.43%±0.77%,均低于游离多酚在SGF 期的生物利用率。实验结果表明,复合微胶囊颗粒能够控制SGF 阶段多酚的释放,尤其是Phe-PS-Zein,可能是Phe-PS-Zein 微胶囊颗粒表面Zein 和PS 的相互作用能够有效阻止微胶囊在胃环境中的降解,进而提高Phe 在SIF 期的生物利用率[40]。SIF 期后,Phe-PS 和Phe-PS-Zein 复合微胶囊颗粒中Phe 的生物利用率明显提高,分别为67.89%±1.89%和73.19%±2.04%,这是由于复合微胶囊颗粒在肠液中的解离和水解作用,促进了Phe 的释放。该结果也与之前关于体外消化过程中多酚生物可及性的研究一致[41]。综上所述,Phe-PS-Zein 在SGF 期降解程度较低,在SIF 期的生物利用度较高。
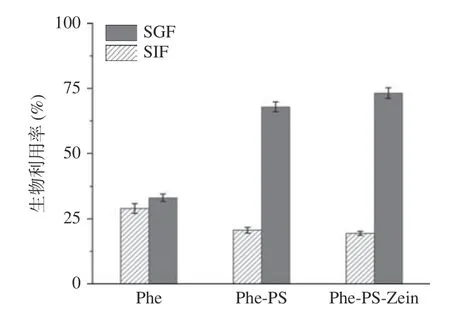
图10 Phe,Phe-PS 和Phe-PS-Zein 微胶囊颗粒的体外释放效果Fig.10 In vitro release profile of Phe,Phe-PS and Phe-PS-Zein
3 结论
本文制备了基于淀粉相的负载螺旋藻多酚的Phe-PS 微胶囊颗粒,并对其进行表征和稳定性分析。为了探究更稳定的螺旋藻多酚递送体系,利用反溶剂沉淀法制备了负载多酚的Phe-PS-Zein 微胶囊,通过DLS、FTIR、XRD、XPS、DSC 等技术对其结构进行了表征,并进行了稳定性和体外缓释作用的探究,比较了Phe-PS-Zein 与Phe-PS 两种复合微胶囊颗粒的稳定性、生物利用率等性能。主要结论如下:设计单因素实验对负载螺旋藻多酚的Phe-PSZein 微胶囊进行工艺优化,在芯壁比1:10,壁材比1:1,搅拌时间90 min,温度60 ℃和pH7 时有最高包埋率,达86.93%。比多孔淀粉单层壁材负载螺旋藻多酚得到的Phe-PS 微胶囊(芯材比1:10,温度80 ℃,磁力搅拌时间120 min,达到最佳包埋率60.29%)包埋效果更好。通过DLS、FTIR、XRD 和XPS 等技术对微胶囊结构进行了表征,并与游离的螺旋藻多酚进行比较。通过荧光光谱的分析,结果表明玉米醇溶蛋白-多酚复合体是在非共价作用力作用下形成的。XRD 和XPS 的图谱表明,添加Zein后晶体衍射峰强度有所降低,主要与Zein 的无定型结构有关。通过对DSC 分析和对抗氧化性、稳定性以及体外缓释效果的研究,比较了Phe-PS-Zein 与Phe-PS 两种微胶囊颗粒对螺旋藻多酚的保护效果,结果表明,Phe-PS-Zein 颗粒可以作为螺旋藻多酚的有效递送载体。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).
