螺旋藻肽亚铁螯合物的制备及结构表征
2024-05-12王丽娟李方巍曾名湧
张 雨,李 崴,王丽娟,李方巍,*,曾名湧,*
(1.中国海洋大学三亚海洋研究院,海南三亚 572000;2.中国海洋大学食品科学与工程学院,山东青岛 266003)
钝顶螺旋藻(Spirulina platensis)作为新兴食品原料,生长周期短、成活率高、营养丰富,尤其是蛋白含量达到50%~60%[1],且氨基酸种类丰富。相关研究表明Glu、Asp、Lys、His、Ser 和Cys 是肽与亚铁离子的主要螯合位点[2],因此钝顶螺旋藻具备螯合铁的条件。我国螺旋藻年产量(约9000 t)居世界首位,占全球微藻总产量的40%~50%[3]。但是,螺旋藻由于特殊性气味和对热、光的敏感性等问题,其生产应用仍有许多瓶颈问题需要解决,例如直接加工新鲜螺旋藻产品不易储存和有刺激性气味,而传统的热喷雾干燥会导致大部分生物活性成分的损失等。本文通过对螺旋藻进行精深加工,以期提高螺旋藻中生物活性成分的利用率。目前螺旋藻的加工应用主要有两方面:一方面是直接加工的粉末等产品;另一方面是精深加工的螺旋藻生物活性成分,精深加工产品种类单一,并且关于螺旋藻蛋白肽高值化利用的研究鲜有报道。因此,如何提高螺旋藻的接受度,实现螺旋藻蛋白肽高值化利用,是拓宽螺旋藻在食品加工领域中应用的重要方向。
铁是基本的微量营养素之一,是人体代谢过程所必需的。然而,缺铁是最常见的营养缺乏症之一[4]。口服补铁剂已成为缺铁患者的首要选择。由于亚铁盐类等传统补铁剂受食品中其他成分的影响而导致生物利用度有限,且在加工储存中稳定性较差,因此,蛋白肽亚铁螯合物营养丰富、价格低廉、生物利用度高、食用安全可靠,可用作新型补铁剂[5-6]。迄今为止,已经成功提取了燕麦[7]、大豆[8-9]、罗非鱼[10]、玉米[11]和海参[12]等可食用动植物蛋白中具有铁螯合活性的蛋白肽,且制备出蛋白肽亚铁螯合物。钝顶螺旋藻是优质蛋白的来源,通过酶法水解可以获得生物活性肽,不仅能提供人类营养,而且具有提供人体生理机能的功效,因此可以作为铁螯合肽的来源。不仅丰富铁螯合肽的来源,同时也利用量子化学计算探究肽亚铁螯合物的结构。
本文通过单因素实验和响应面试验优化螺旋藻蛋白肽亚铁螯合物的制备条件,采用荧光光谱分析研究肽结构变化、分子量测定研究参与螯合的肽类型和扫描电镜分析观察微观结构,随后又利用氨基酸组成实验探究螯合位点、多肽序列分析和量子化学计算模拟螯合物的结构模型、FTIR 光谱进行结构表征,期望能初步阐释螺旋藻蛋白肽亚铁螯合物的形成机制,以期为丰富铁强化剂种类和拓宽螺旋藻的应用范围提供实验基础。
1 材料与方法
1.1 材料与仪器
钝顶螺旋藻粉 新大泽公司;氯化亚铁、抗坏血酸、无水乙醇、醋酸钠、邻菲啰啉、PBS 缓冲液干粉、盐酸羟胺等为分析纯、溴化钾(光谱纯)国药集团化学试剂有限公司;胰蛋白酶(250 U/mg)北京索莱宝科技有限公司;氢氧化钠、盐酸 分析纯,北京化工厂。
GL-21M 高速冷冻离心机 湖南湘仪离心机有限公司;SCIENTZ-10ND 冷冻干燥机、XMTD-8222数显恒温水浴锅 宁波新芝生物科技有限公司;AL104 精密电子天平 梅特勒托利多仪器有限公司;DW-86L-388A 超低温冰箱 海尔公司;UV-2550酶标仪、LC-20AD 高效液相色谱仪 日本岛津公司;TSK gel GMPWXL 凝胶色谱柱 日本Tosoh(TSK 东曹)公司;F-4600 荧光分光光度计、S-510 扫描电子显微镜 日本日立公司;NicoletiS10 傅里叶红外光谱仪 美国赛默飞公司;200-PC 差示扫描量热仪(DSC)德国NETZSCH 仪器有限公司。
1.2 实验方法
1.2.1 螺旋藻蛋白提取工艺 根据参考文献[13]中的方法提取、纯化螺旋藻蛋白。
1.2.1.1 破壁 取适量钝顶螺旋藻粉,将其溶于0.01 mol/L pH6.8 的PBS 中,配制成料液比为1:10(w/v)的悬浮液,搅拌15 min,在-20 ℃下冷冻90 min,然后分别在37 ℃和4 ℃下解冻,如此反复3 次。冻融完成后,在4 ℃下离心(10000 r/min,20 min),取上清液于4 ℃下冷藏保存。
1.2.1.2 盐析 取破壁离心后的上清液进行搅拌,同时缓缓加入碾压均匀的(NH4)2SO4固体至浓度为50%达到饱和(5~10 min 内完成),搅拌40 min 使(NH4)2SO4固体颗粒溶解完全。
1.2.1.3 透析 将盐析溶液在4 ℃下离心(8000 r/min,15 min),然后将沉淀放入去离子水中于4 ℃下使用截留分子量为8~10 kDa 的透析袋透析,间隔2 h 更换纯水至少3 次,最后一次过夜后透析结束。
收集透析后的样品于-80 ℃中冻藏4 h 以上,然后真空冷冻干燥制成粉末并于-20 ℃下保存备用。
1.2.2 螺旋藻蛋白酶解工艺 根据参考文献[13]中的方法酶解螺旋藻蛋白。以实验室中制得的螺旋藻蛋白为底物,胰蛋白酶的酶解条件为温度37 ℃,pH8,料液比为1:10(w/v),加酶量3%,酶解反应2 h,沸水灭酶 10 min,冷却至室温,8000×g 离心15 min,收集酶解上清液,冻干为螺旋藻蛋白肽冻干粉,于-20 ℃储存备用。
根据参考文献[13]中的方法提取、纯化螺旋藻蛋白。
1.2.3 螺旋藻肽亚铁螯合物的制备条件优化
1.2.3.1 螺旋藻蛋白肽亚铁螯合物的制备工艺 根据参考文献[14]中的方法制备螺旋藻蛋白肽亚铁螯合物。称取一定量的螺旋藻蛋白肽冻干粉于锥形瓶中,加入去离子水控制料液比,再加入一定量抗坏血酸混匀,调节pH,根据不同质量比加入氯化亚铁,在设定的温度下水浴加热40 min,然后加入6 倍体积的无水乙醇,在室温下静置,离心(4000 r/min,10 min),除去上清液,用无水乙醇洗涤沉淀后再次离心,反复3 次,收集沉淀,冻干,用研钵研磨冻干产物得到粉末,于-20 ℃冷冻保存。
以螯合率及螯合物得率为评价指标,探究螺旋藻蛋白肽浓度、蛋白肽/氯化亚铁质量比、温度和pH 四个因素对螯合效果的影响。单因素实验条件如表1 所示。

表1 螯合反应单因素实验设计Table 1 Design of single factor experiment for chelating reaction
1.2.3.2 螺旋藻蛋白肽亚铁螯合物制备条件的响应面优化 基于制备螯合物的单因素实验结果,以螯合物得率为评价指标,选取pH(A)、螺旋藻蛋白肽浓度(B)和蛋白肽/氯化亚铁质量比(C)为影响因素,根据Box-Behnken 设计三因素三水平响应面优化试验。具体试验因素水平编码见表2。

表2 响应面试验因素与水平Table 2 Factors and levels of RSM
1.2.4 螯合率及螯合物得率的测定 采用邻菲啰啉比色法[14]测铁含量。
1.2.4.1 标准曲线绘制 用硫酸亚铁铵准确配制铁离子浓度为10 μg/mL 的标准溶液,取50 mL 容量瓶分别加入一定量标准溶液,再依次加入1 mL 盐酸溶液(1 moL/L),1 mL 10%盐酸羟胺溶液,1 mL 浓度为0.12%的邻菲啰啉和5 mL 10%的醋酸钠溶液,用去离子水定容,获得铁离子的终浓度分别为0、0.4、0.8、1.2、1.6、2 μg/mL。将溶液于室温下放置30 min,以铁离子浓度为0 μg/mL 的溶液作为空白,测定吸光度A510nm。通过计算得到标准曲线方程为y=0.1162x+0.0016(R2=0.9997)。
1.2.4.2 样品螯合率及螯合物得率的测定 根据参考文献[14]中的方法测定样品中的铁含量。称取0.05 g 的螯合物,加入2 mL 浓盐酸,后用去离子水定容至100 mL 容量瓶中,摇匀。吸取5 mL 样品溶液于50 mL 容量瓶中,按上述标准曲线的步骤测定吸光度。样品中铁离子含量根据式(1)计算。螯合率及螯合物得率分别按式(2)、式(3)计算。
式中:c—经标准曲线换算得到的浓度,μg/mL;v0—样品定容后体积,mL;v1—取样体积,mL;m—取样的质量,g。
式中:m—螯合物中铁的质量,mg;m0—加入反应体系中铁的质量,mg。
式中:m1—反应所得螺旋藻肽亚铁螯合物的质量,mg;m2—加入体系中蛋白肽及氯化亚铁的质量和,mg。
1.2.5 荧光光谱测定 参考文献[12]使用荧光分光光度计测定螺旋藻蛋白肽及其螯合物的荧光光谱。激发波长280 nm,发射波长295~500 nm,激发和发射的狭缝宽度为5 nm,电压为400 V,记录测定结果。
1.2.6 分子量测定 参考文献[15]取约10 mg 样品,溶解于1 mL 的水中并混合均匀,用注射器吸取水溶液用0.45 μm 的分子膜过滤,微量注射器吸取100 μL 滤液,注入GPC 色谱组,开始实验。流动相:0.1 mol/L NaNO3+0.06% NaN3水溶液,流动相流速0.6 mL/min,柱温35 ℃。GPC 实验确定分子量及其分布时,采用窄分布聚乙二醇作为标样,从而得到其校正曲线,将校正曲线的纵坐标换成与分子尺寸有关的参数,即可获得适合于各种高聚物的校正曲线。有了校正曲线,即可根据VE读得相应的分子量。本实验校正曲线公式为y=405005x+6×106(R2=0.6468)。
1.2.7 扫描电镜(SEM)测定 取少量螺旋藻肽粉及肽亚铁螯合物均匀涂抹于样盘上,进行喷金处理后,再对样盘进行抽真空处理。利用热场发射扫描电镜分别于500 倍、1000 倍、10000 倍下获取图像,观察螺旋藻蛋白肽和螺旋藻肽亚铁螯合物的微观结构[12]。
1.2.8 氨基酸组成测定 利用高效液相色谱法(HPLC)测定螺旋藻蛋白肽及螯合物的氨基酸组成。准确称取适量样品,移取3.0 mL 6 mol/L 盐酸溶液含0.1%苯酚溶液至样品瓶中,超声溶解,将溶液转移至安培瓶中,连续5 次,充氮,熔封,烘箱110 ℃水解24 h 后,N2吹干盐酸,加3.0 mL 水复溶。移取上述溶液200 μL 加入稀释后的A 溶液100 μL 和稀释后的B 溶液100 μL,摇匀,室温反应60 min;然后加入正己烷溶液400 μL 旋紧盖子后振摇5~10 s,室温静置分层,取下层200 μL 溶液,加入800 μL 水混合均匀,再取200 μL 加入800 μL 水混合均匀,用孔径为0.22 μm 有机膜过滤,待分析。具体参数:流动相A 0.1 mol/L 醋酸钠溶液(pH6.50):乙腈=93:7;流动相B 水:乙腈=20:80;色谱柱C18,5 μm,4.6×250 mm;流速1.0 mL/min;柱温40 ℃;波长254 nm;进样量10 μL;工作站记录时间60 min。实验结束得到样品中各类氨基酸含量,并对比每种氨基酸的含量[12]。
1.2.9 螺旋藻蛋白肽序列分析 取10 μL 流动相A 液(100%水、0.1%甲酸)溶解冻干粉末,4 ℃下离心(14000×g,20 min),取1 μg 上清液进样,液质检测。具体参数:流动相A 100%水、0.1%甲酸;流动相B 80%乙腈、0.1%甲酸;质谱仪 Q Exactive HFX;离子源Nanospray Flex™(NSI);离子喷雾电压2.4 kV;离子传输管温度275 ℃。质谱采用数据依赖型采集模式,生成质谱检测原始数据(.raw)。数据库的选择是以所需物种、数据库注释完备性及序列可靠性为参考依据的。在选择数据库时,遵循如下原则,若为已经测序生物,直接选用该物种数据库,若为非测序生物,则选择与被测样品最为相关的大类蛋白质组数据库。采用Peaks 8 软件搜库。
1.2.10 螺旋藻肽亚铁螯合物的结构模型 采用量子化学计算及波函数分析方法[16]对螺旋藻肽亚铁螯合物的结构进行分析预测。量子化学计算前,根据1.2.9 中测得的主要螯合肽段的来源和序列,从PDB 库(https://legacy.uniprot.org/)中下载藻蓝蛋白(1HA7)、别藻蓝蛋白(1B33)结构,目标肽段的位置及结构则利用Autodock 4.2.6 软件获取。使用Gaussian 16(A.03)程序完成分子结构的几何优化和单点能计算。量子化学计算则通过密度泛函理论(DFT)方法进行。几何优化及单点能计算采用hf 函数结合3-21G 基组实现。最后,通过Multiwfn 3.8完成独立梯度模型(IGM)分析[17],并借助Visual Molecular Dynamics(VMD)程序绘制结构模型及等值面图。
1.2.11 FTIR 光谱测定 称取约2 mg 螯合物样品放入玛瑙研钵中,加入干燥过的光谱纯KBr 200 mg,在红外灯下混合研磨均匀,使其粒度在2.5 μm 以下,装入压片模具,抽气加压,压力约为60 MPa,维持3~5 min,卸掉压力则可得一透明的KBr 样品片,利用NicoletiS10 红外分光光度计在波数范围500~4000 cm-1进行红外光谱扫描,定性分析后得到红外光谱图。同时按照同一操作方法进行螺旋藻蛋白肽冻干粉末的空白样品制备。
1.3 数据处理
每个实验做三次平行,采用 SPSS 18.0 软件进行数据的显著性分析,应用 Origin 8.5 软件绘图。
2 结果与分析
2.1 螺旋藻肽亚铁螯合物制备的单因素实验结果
2.1.1 肽浓度对螯合反应的影响 如图1 所示,在肽浓度为1%时螯合率和螯合物得率最高。随着溶液中肽液浓度的增加,亚铁离子与蛋白肽之间的接触机率减小,降低了亚铁离子与结合位点之间接触的概率,同时也降低了单位质量蛋白肽与亚铁离子的结合,因为多肽之间产生竞争性抑制。综合考虑螯合率和螯合物得率,初步选择螺旋藻蛋白肽亚铁螯合反应的肽液浓度为1%。
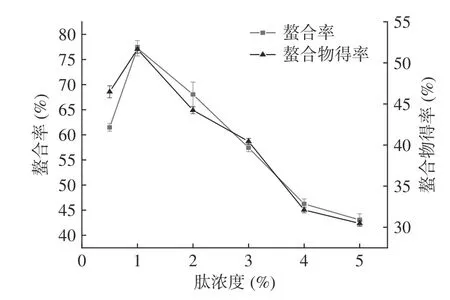
图1 肽浓度对螯合率和螯合物得率的影响Fig.1 Effects of peptides concentration on chelating rate and chelate yield of samples
2.1.2 蛋白肽与亚铁盐质量比对螯合反应的影响如图2 所示,在蛋白肽/氯化亚铁质量比为6:1 时螯合率(79.59%±1.2135%)最高,蛋白肽/氯化亚铁质量比为8:1 时螯合率(79.20%±1.1801%)出现不显著性(P>0.05)降低;在蛋白肽/氯化亚铁质量比为5:1 时螯合物得率(40.31%±0.0673%)达到最大。因为蛋白肽/氯化亚铁质量比太小,形成的环状结构不稳定,且生成的螯合物易分解[15];反之,当肽与铁结合位点饱和后,肽与亚铁盐质量比增大,导致多肽之间产生竞争性抑制,影响螯合反应正常进行。综合考虑螯合率和螯合物得率,初步选择螺旋藻蛋白肽亚铁螯合反应的质量比为6:1。

图2 蛋白肽/氯化亚铁质量比对螯合率和螯合物得率的影响Fig.2 Effects of SP/FeCl2·4H2O ratio on chelating rate and chelate yield of samples
2.1.3 pH 对螯合反应的影响 如图3 所示,在pH6时螯合率达到最大值。当pH 较低时,-COOH 的H+在pH 升高时更容易被电离,提供了更多的机会与亚铁离子结合[18]。在碱性条件下,溶液中OH-的浓度增加,OH-将与供电子基团竞争亚铁离子而形成羟基螯合物,进而生成氢氧化亚铁沉淀,因此不适合在碱性条件下进行螯合反应[19]。螯合物得率虽在pH6时有下降,但总体是增加的,这一结果与廉雯蕾[15]研究米蛋白肽亚铁螯合反应的结果相似。综合考虑螯合率和螯合物得率,初步选择螺旋藻蛋白肽亚铁螯合反应pH 为6。
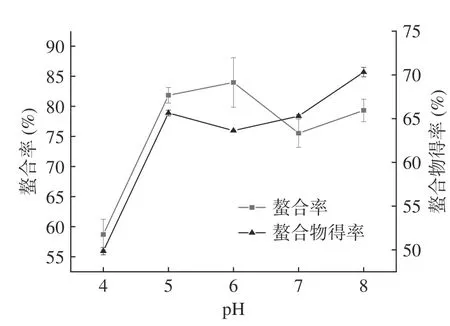
图3 pH 对螯合率和螯合物得率的影响Fig.3 Effects of pH on chelating rate and chelate yield of samples
2.1.4 温度对螯合反应的影响 如图4 所示,当温度增加到60 ℃时,螯合率和螯合物得率达到最大值;当温度在60 和80 ℃之间时,螯合率没有显著变化,螯合物得率小幅度减小。表明适当的热处理促进了螯合作用进行,使其更易达到稳定的螯合物结构[20]。综合考虑螯合率和螯合物得率,初步选择螺旋藻蛋白肽亚铁螯合反应的温度为60 ℃。
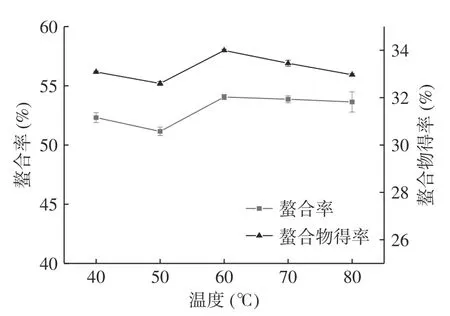
图4 温度对螯合率和螯合物得率的影响Fig.4 Effects of temperature on chelating rate and chelate yield of samples
2.2 螺旋藻肽亚铁螯合物制备工艺响应面优化结果
2.2.1 响应面试验结果 基于单因素实验结果,并考虑到实际所得的螯合物可能附着有亚铁离子对螯合率的测定影响较大,因此选择螯合物得率为响应值,选取肽液浓度(A)、pH(B)和肽亚铁盐质量比(C)三个因素,设计三因素三水平的响应面试验,总共17 个实验点,具体方案及结果如表3 所示。

表3 响应面设计方案及试验结果Table 3 Results and design of response surface experiment
2.2.2 回归方程建立及方差分析 利用Design-Expert 8.0.5 软件对表3 数据进行回归拟合,得到螯合物得率对以上三个因素的二次多项回归模型为:Y=42.91+0.63A-0.60B-2.25C-0.073AB+0.49AC-1.46BC-1.53A2-2.13B2-3.02C2。为检验该回归方程的有效性,对其进行方差分析,结果见表4。
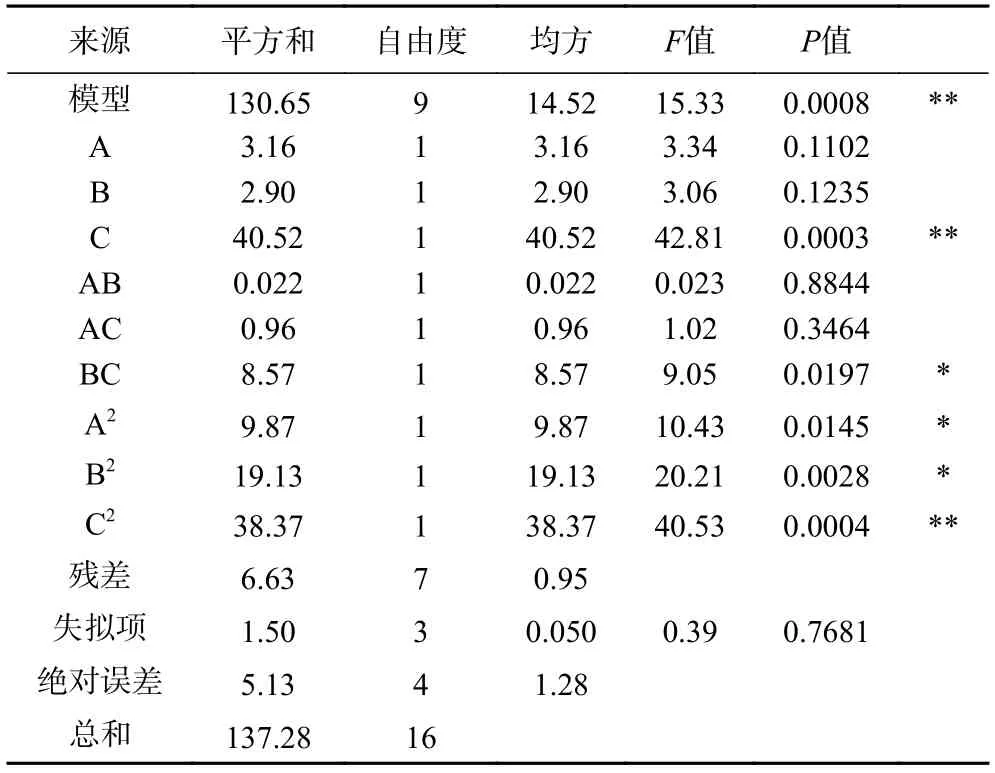
表4 回归模型方差分析Table 4 ANOVA analysis of regression model
由表4 可知,模型达到极显著水平(P<0.01),说明实验数据与模型相符;失拟项P值为0.7681>0.05,不显著,表明回归方程的拟合程度较好;回归决定系数R2=0.9517,模型校正系数R2Adj=0.8897,变异系数C.V.仅为2.45%,说明该模型试验误差较小,可信度高。因此,可用此模型分析和预测螺旋藻蛋白肽亚铁螯合物的制备工艺。
根据二次多项回归方程分别绘制响应曲面图,利用Design-Expert 8.0.6 软件得到各因素相互作用的响应面和等高线图,如图5~图7 所示。再结合表4 中的P值可知,模型的一次项C 对响应值的影响极显著(P<0.01),A、B 项对响应值的影响不显著;交互项BC 对响应值的影响显著(P<0.05);二次项B2、C2对响应值均有显著(P<0.05)影响,表明各因素对螯合物得率的影响不是简单的线性关系。各因素对螯合物得率的影响从大到小分别是蛋白肽/氯化亚铁质量比>螺旋藻蛋白肽浓度>pH。在三个因素两两交互作用中,pH 与蛋白肽/氯化亚铁质量比交互作用显著,其他因素的交互作用不显著。

图5 因素A 和B 交互作用对螯合物得率影响的响应面图Fig.5 Response surface diagram of the interaction between factors A and B on the yield of chelates

图6 因素A 和C 交互作用对螯合物得率影响的响应面图Fig.6 Response surface diagram of the interaction between factors A and C on the yield of chelates
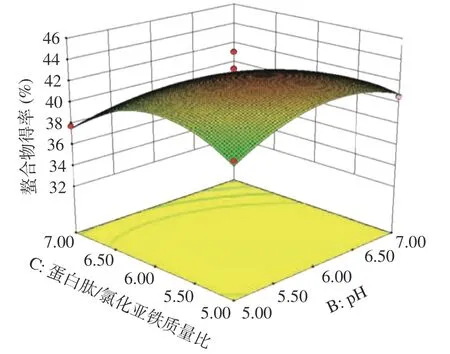
图7 因素B 和C 交互作用对螯合物得率影响的响应面图Fig.7 Response surface diagram of the interaction between factors B and C on the yield of chelates
2.2.3 螯合工艺最佳参数确定及验证试验 通过Design-Expert 8.0.6 软件模拟,初步得到了螺旋藻肽亚铁螯合物的最佳制备工艺条件:pH5.98,蛋白肽/氯化亚铁质量比5.64:1,蛋白肽浓度1.07%,温度60 ℃,时间40 min。在此条件下,螯合物得率达43.37%。为了验证该最适工艺条件的准确性,根据实际情况将工艺条件调整为pH6,肽亚铁质量比6:1,蛋白肽浓度1%,温度60 ℃,时间40 min,重复进行3 次实验,螺旋藻肽亚铁螯合物螯合物得率为44.13%±0.4267%,与理论计算值的误差0.76%。说明响应面优化得到的工艺条件初步为最适工艺条件。
2.3 荧光光谱分析
荧光光谱是研究参与螯合反应的蛋白质或肽的结构变化及与其他分子结合的重要研究工具[21]。蛋白质内源荧光是由芳香族氨基酸如苯丙氨酸、色氨酸及酪氨酸在一定的激发波长下发出的内源性荧光,肽发生折叠会导致荧光强度降低[22]。如图8 所示,在305 以及338 nm 处螺旋藻肽亚铁螯合物的荧光强度明显低于螺旋藻肽的荧光强度,可以推测螺旋藻肽与亚铁离子螯合后形成的新结构导致荧光猝灭,同时也表明螯合反应中螺旋藻肽发生了明显的折叠[21]。综合上述结果,螺旋藻肽内源性荧光发生猝灭的原因是螯合反应后产生了新结构,导致荧光强度的降低[23]。
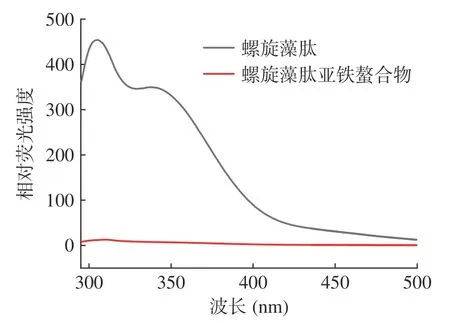
图8 螺旋藻肽与肽亚铁螯合物的荧光光谱Fig.8 Fluorescence spectra of spirulina peptide and peptide ferrous chelate
2.4 分子量测定
如图9 所示,重均分子量的分布曲线显示,与螺旋藻蛋白肽相比,螯合物的分子质量较小,且螯合物的主要出峰时间(16.49、18.17 min)也比蛋白肽(16.70、18.43 min)的晚。根据凝胶色谱法(Gel Permeation Chromatography,GPC)的原理,分子量越小,通过时间越长,由出峰时间也可知,螯合物的平均相对分子质量比蛋白肽更小,与重均分子量分布曲线结果相符。由表5 也可看出,螺旋藻蛋白肽的平均相对分子质量大于螺旋藻肽亚铁螯合物的平均相对分子质量。推测亚铁离子主要与短肽相结合,且肽与螯合物的平均相对分子质量均分为三部分,螯合物最大平均分子量为82837 Da,而蛋白肽的最大平均分子量为959262 Da。研究表明,肽与金属的比例大约在2:1 至40:1 之间变化,取决于金属类型、纯度和肽的结合强度[24]。螯合物分子量为2702 Da 的肽段占比最多(59.96%),蛋白肽的肽段分子量基本为4806 Da(52.8%)和225 Da(44.29%),根据肽段分子量分布推测亚铁离子可以与两个及两个以上的短肽结合,从而形成稳定的螯合结构。
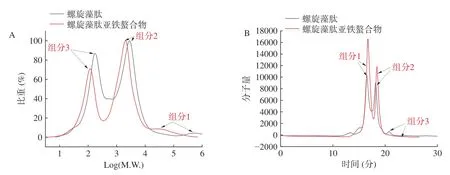
图9 相对分子量分布曲线图(A)和色谱图(B)Fig.9 Molecular weight distribution curve (A) and chromatogram curve (B)

表5 螺旋藻蛋白肽及螺旋藻肽亚铁螯合物的相对分子量分布Table 5 Relative molecular weight distribution of spirulina peptide and peptide ferrous chelate
2.5 扫描电镜(SEM)分析
图10 为在500 倍、5000 倍和10000 倍的显微镜下观察到的螺旋藻蛋白肽(SP)和螯合物(SP-Fe)的微观结构。可以看出,SP 表面光滑致密,呈片状;在不同放大倍数下表面呈现无规则分布的裂纹,这是由于在真空冷冻干燥过程中水分散失造成的。而当SP 与亚铁离子螯合时,SP-Fe 表现出松散和表面粗糙的块状结构。SP-Fe 微观结构的变化是由于SP 与亚铁离子在螯合过程中的相互作用,破坏了肽表面原有的致密结构,而不是两者之间简单的物理混合,这一结论与海参卵水解产物-钙螯合物的研究结果一致[25]。同时也符合荧光光谱结果,表明螯合反应后产生了新结构[26]。

图10 螺旋藻蛋白肽(SP,A-1、A-2、A-3)及螺旋藻肽亚铁螯合物(SP-Fe2+,B-1、B-2、B-3)的微观结构Fig.10 Microstructure of SP (A-1,A-2,A-3) and SP-Fe2+(B-1,B-2,B-3)
2.6 氨基酸组成分析
螺旋藻蛋白肽和螺旋藻蛋白肽亚铁螯合物的氨基酸组成及相对含量见表6。数据表明,螯合前后氨基酸的相对含量有所变化。蛋白肽的总氨基酸含量为48.03%,螯合物的总氨基酸含量为20.03%。与蛋白肽相比,螯合物的总氨基酸含量有所减少,这是由于螺旋藻蛋白肽中存在铁结合位点,螯合反应后铁与蛋白肽结合生成了新结构。相关研究证明,多肽与金属离子有不同的结合位点,包括末端-NH2和-COOH 基团、多肽键和氨基酸的活性侧链(如天冬氨酸和谷氨酸)[27]。在本研究中,螺旋藻蛋白肽与亚铁离子结合后,酸性氨基酸(谷氨酸和天冬氨酸)、精氨酸、赖氨酸的相对含量均有所增加,表明谷氨酸和天冬氨酸的羧基、精氨酸的氨基、赖氨酸的胍基可能是主要的铁结合位点。同时甘氨酸和组氨酸含量分别提高了0.307%和0.249%,表明甘氨酸和组氨酸在铁螯合中也发挥了重要作用。也有研究表明,半胱氨酸的羟基及巯基侧链有较好的金属螯合活性[24],其在螺旋藻蛋白肽螯合前的相对含量为0.127%,螯合后相对含量为0.301%,说明半胱氨酸也可能提供了亚铁离子的结合位点。
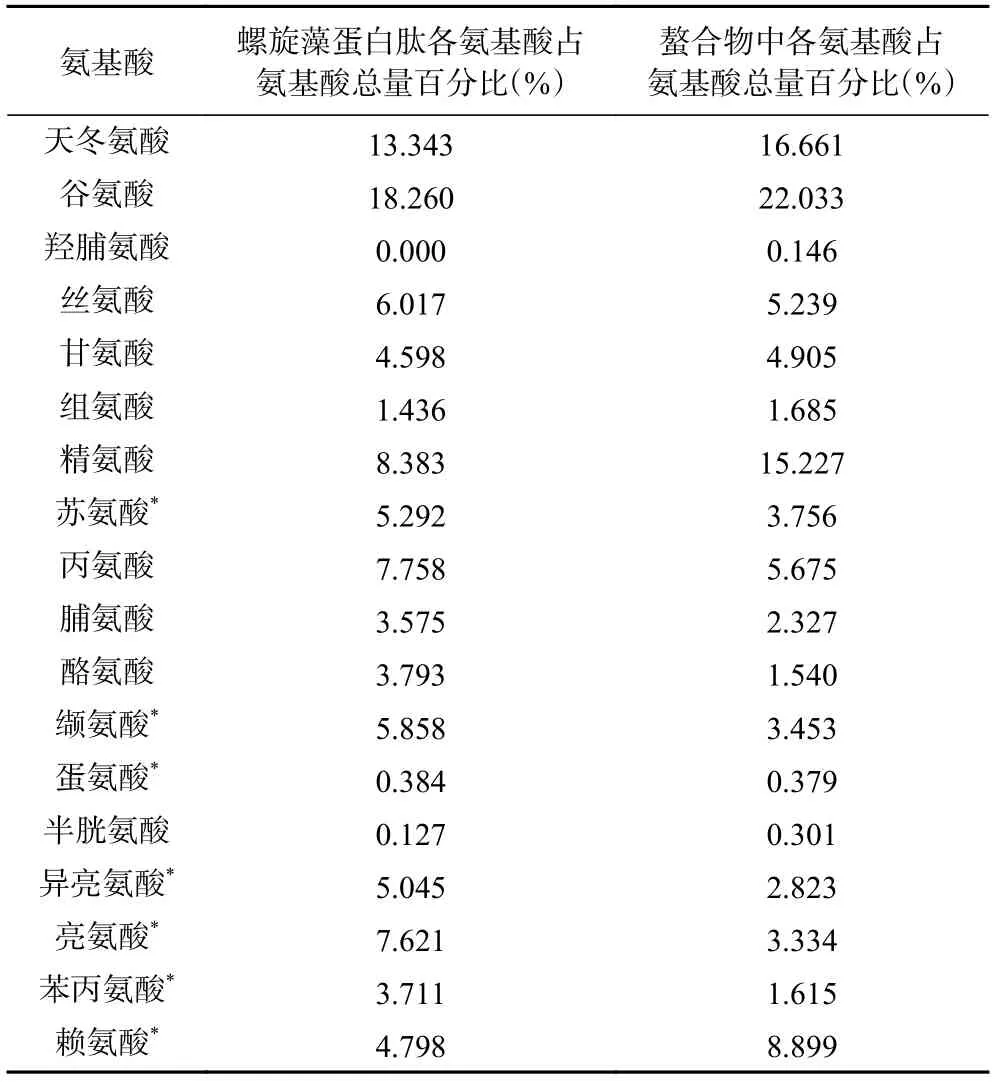
表6 螺旋藻蛋白肽螯合前后氨基酸对比分析Table 6 Comparative analysis of amino acids before and after chelation of Spirulina protein peptides
2.7 螺旋藻蛋白肽序列
如图11A 所示,别藻蓝蛋白和藻蓝蛋白所含的肽段数占全部肽段数最高。多肽序列的鉴定对于研究亚铁离子螯合肽的结构与螯合活性之间的关系是必要的。根据多肽序列测定结果可知,螺旋藻蛋白经胰蛋白酶酶解后获得了3357 种肽段,肽段长度范围为5~31 个氨基酸,其中10 个氨基酸组成以下的肽段占79.65%,且研究表明肽与金属的比例大约在2:1 至40:1 之间变化,取决于金属类型、纯度和肽的结合强度[24],因此推测亚铁离子主要与短肽结合。同时如图11B 所示,在这些肽段中SIVTKSIVNAD AEAR 占比最高为1.91%,其次是肽段MKTPLTEA占比为1.26%,分别属于别藻蓝蛋白和藻蓝蛋白,同属于藻胆蛋白,符合螺旋藻蛋白质中藻胆蛋白含量最高的组成结构。因此,推测亚铁离子结合的肽段主要来自于藻胆蛋白中的别藻蓝蛋白和藻蓝蛋白。

图11 螺旋藻中不同蛋白质种类及含量(A)和螺旋藻中不同肽种类及含量(B)Fig.11 Types and contents of different proteins in Spirulina (A) and types and contents of different peptides in Spirulina (B)
2.8 螺旋藻肽亚铁螯合物的结构模型
量子化学计算通过操纵物质的量子态,并利用其独特的特性(如叠加和缠绕),能有效地解决量子化学中的许多重要问题(如分子的电子结构)并提供准确的结果[28]。现阶段可利用量子化学计算模拟物质的结构。本研究采用含量占比最高的两个肽段为计算模型,初步探究螺旋藻肽螯合物的模型结构。如图12A、图13A 分别为别藻蓝蛋白和藻蓝蛋白经胰蛋白酶酶解获得的含量最高的肽段SIVTKSIVNA DAEAR 和MKTPLTEA 的结构示意图,为后续模拟肽亚铁螯合物的结构提供了有力支持。研究表明,肽与金属的比例可能在2:1 至40:1 之间变化,取决于配体类型、纯度和肽的结合强度[25]。上述相对分子量分析结果显示螯合物的相对分子量较小,由此参考肽与金属2:1 的比例,分别利用两条肽段构建肽亚铁螯合物的结构模型,结果如图12B 和图13B 所示。在螯合物结构模型图中,两种肽段均与Fe 结合,箭头所指为Fe 原子,位于肽段中间位置,被肽段包围,结构稳定。这与Sun 等[28]研究结果一致。图12C~图12D 和图13C~图13D 为铁与肽段的弱相互作用独立梯度模型(IGM)及散点图,能更直观地展现铁与肽的结合位点。IGM 图中随着Sign(λ2)ρ增加,分子间的相互作用发生改变,由强吸引作用(蓝)到范德华作用(绿)最后是强互斥作用(红),中间粉色原子是铁,能明显看出它与周围氧(红)、氢(白)、氮(蓝)有很强的静电吸引作用,这与上述氨基酸分析结果一致,铁主要与谷氨酸和天冬氨酸的羧基、精氨酸的氨基、赖氨酸的胍基结合。因此,通过氨基酸电负性末端包围形成的电负性空腔是镶嵌铁原子的绝佳位置,更容易产生强吸引作用,形成稳定的螯合结构。

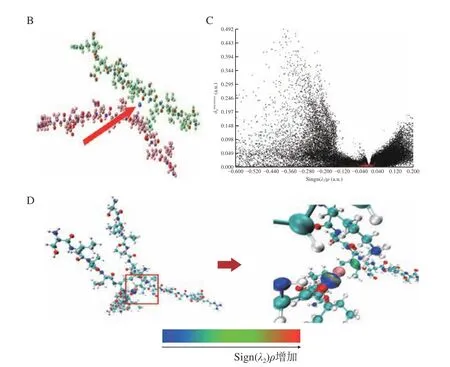
图12 别藻蓝蛋白分离肽段量子化学计算螯合物结构模拟图Fig.12 Simulation diagram of chelate structure computed by quantum chemistry of allophycocyanin isolated peptide

图13 藻蓝蛋白分离肽段量子化学计算螯合物结构模拟图Fig.13 Simulation diagram of chelate structure computed by quantum chemistry of phycocyanin isolated peptide
2.9 FTIR 光谱分析
红外光谱分析技术可以用来探究生物聚合物中分子官能团的变化[29]。如图14 所示,螺旋藻蛋白肽在3236 cm-1波段处有一个吸收峰,肽与亚铁离子螯合后,吸收峰位移至3359 cm-1,说明氨基酸的-N-H参与了亚铁离子的螯合反应,同时-N-H 的电子云密度由于-N-Fe 的形成而变得更强[30]。在1700~1600 cm-1处的吸收波段为酰胺-I 带,在1600~1500 cm-1处的吸收波段为酰胺-Ⅱ带,主要为-C=O键的拉伸、N-H 键的变形及-CN 键的拉伸引起的振动[30]。Chen 等[31]研究EPAH-钙螯合物的FTIR 光谱显示,酰胺-I、酰胺-Ⅱ和N-H 带的吸收峰发生移位,表明羧基氧和氨基氮原子提供了钙离子的结合位点。螺旋藻蛋白肽与亚铁离子螯合后特征吸收峰从1651 cm-1红移至1654 cm-1,可能是因为-C=O与亚铁离子结合后发生了改变,且酰胺IV 带从615 cm-1移动到623 cm-1,表明螺旋藻蛋白肽的酰胺键也参与了螯合反应[32]。1400 cm-1附近为-COO-伸缩振动引起的吸收峰[33],螺旋藻蛋白肽在1409 cm-1处出现特征吸收峰,螯合后蓝移至1390 cm-1,考虑可能是-COOH 与Fe2+之间形成离子键,中和正电荷从而行成稳定结构。由于-C-O-伸缩振动,在1099 cm-1处的吸收峰移动到1138 cm-1的位置,可以推测-C-O-Fe 的形成[32]。以上结果说明螺旋藻肽在与亚铁离子发生反应后产生了新结构,铁主要与谷氨酸和天冬氨酸的羧基、精氨酸的氨基、赖氨酸的胍基结合,且Fe 主要与O、N、H 产生静电吸引作用而结合,镶嵌在氨基酸电负性末端形成的空腔中,与上述螯合物的弱相互作用独立梯度模型结果一致。
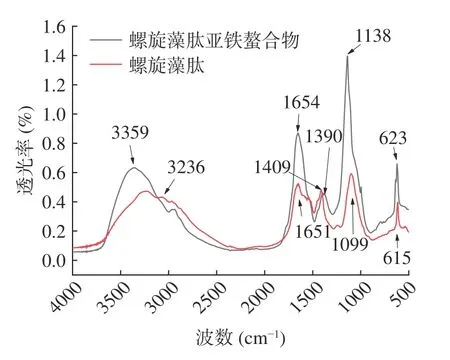
图14 螺旋藻肽及肽亚铁螯合物的傅里叶红外光谱Fig.14 Fourier transform infrared spectroscopy of Spirulina peptide and peptide ferrous chelates
3 结论
本研究通过单因素实验和响应面试验,优化得到螺旋藻肽亚铁螯合物的初步螯合条件,为pH6、肽亚铁质量比6:1、肽液浓度1%、温度60 ℃、时间40 min,在此条件下螯合物得率为44.13%。通过对比氨基酸组成可知,谷氨酸和天冬氨酸的羧基、精氨酸的氨基、赖氨酸的胍基是主要的铁结合位点;荧光光谱、分子量测定、扫描电镜、多肽测序和量子化学计算模拟螯合物结构分析表明,螯合反应中螺旋藻肽发生了明显折叠引起结构改变,形成稳定的螯合结构。本研究证明了螺旋藻蛋白肽与亚铁盐螯合反应后产生了新结构,铁主要与谷氨酸和天冬氨酸的羧基、精氨酸的氨基、赖氨酸的胍基结合,且镶嵌在氨基酸电负性末端形成的空腔中,形成稳定的结构,螺旋藻蛋白肽中存在铁结合位点,具有螯合铁的潜力。研究结论为阐明蛋白肽与金属离子的螯合机理提供了依据,有助于推进螺旋藻肽亚铁螯合物的应用。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).
