两种甲醇脱氢酶在食甲基杆菌甲醇代谢中的作用
2024-05-12郭雅卿王东澍张惟材王恒樑
郭雅卿,王东澍,朱 力,张惟材,刘 颖,*,王恒樑,*
(1.哈尔滨商业大学食品工程学院,黑龙江哈尔滨 150028;2.军事医学研究院生物工程研究所病原微生物生物安全国家重点实验室,北京 100071)
吡咯喹啉醌(pyrroloquinoline quinone,PQQ)是一种不同于烟酰胺和核黄素的第三类氧化还原酶的辅酶[1],具有增强抗氧化酶活性、促进生成神经生长因子、抗辐射、预防慢性心力衰竭、抗高原缺氧等作用[2-5],在功能性食品和医药行业都具有良好的开发前景。目前,合成PQQ 的方式主要有化学合成法和微生物发酵法[6]。与化学合成法相比,微生物发酵法具有污染小、成本低、产率高等优点,因此在工业化生产中被广泛应用[7]。迄今自然界中只有某些革兰氏阴性菌能够产生PQQ,其中甲基营养型细菌的PQQ 合成水平最高[8-9]。甲醇脱氢酶(methanol dehydrogenase,MDH)是甲基营养菌代谢甲醇的关键酶,首先催化甲醇还原PQQ 生成PQQH2,并以细胞色素c 作为电子受体,将两个电子转移至细胞色素c,在该过程中自由基半醌会将PQQH2再氧化回PQQ[10-11]。
甲醇脱氢酶存在于细胞周质中,有MxaFI和XoxF两种类型[12-13]。MxaFI是由MxaF和MxaI所编码的两个α大亚基和两个β小亚基组成的四聚体(α2β2),其中MxaF的活性位点需要Ca2+和PQQ 作为辅基[14-15];XoxF型MDH 需要在活性位点上结合镧系元素(如镧或铈等)和PQQ 才具有生物活性,实现对甲醇的氧化[16]。HIBI 等[17]从含有La3+培养基中生长的细胞中纯化的MDH 对应于XoxF,而从Ca2+生长的菌体中纯化得到的MDH 与MxaF相对应。在甲醇代谢过程中,MxaFI和XoxF两种类型的MDH 存在着某种联系和分工。CHISTOSERDOVA 等[16]研究发现,MxaF缺陷菌株不能在甲醇上生长,且认为在甲基营养菌中Ca2+依赖型的MxaF型MDH 是甲醇代谢中唯一活跃的MDH;后又发现缺失XoxF1和XoxF2的菌株不能利用甲醇作为碳源和能源生长,且几乎完全丧失甲醇脱氢酶活性,与MxaF敲除菌株的表型相同。随着对甲醇脱氢酶的深入研究,发现La3+能够对甲醇脱氢酶进行调控。NAKAGAWA 等[18]向MxaF缺失株的培养基中补充La3+,发现能够恢复菌体的生长,实验表明XoxF在菌株AM1 中作为La3+依赖型的MDH 参与甲醇代谢。
甲醇脱氢酶对菌株生长及PQQ 合成有较大的影响[19],李淼鑫等[20]发现提高MDH 的表达水平能够影响PQQ 的生物合成水平。孙晓宇等[21]通过突变甲醇脱氢酶的启动子来降低其活性,达到了提高PQQ 产量的目的。李大攀等[22]将MDH 基因敲除后,MDH 的活力、PQQ 合成水平及氧化甲醇的能力均下降。本实验室从土壤中分离筛选得到一株PQQ 产生菌食葡糖食甲基杆菌MP688,能够以甲醇为唯一碳源进行生长,后经多轮物理和化学诱变得到了高产菌株J1-1。在前期研究结果中,将菌株J1-1中的mpq0771基因敲除后,敲除菌不能利用甲醇生长,与Ca2+依赖的MDH 特征相似[21]。现经过基因比对分析,在基因组上找到了另外一个甲醇脱氢酶基因mpq2496,推测可能为La3+依赖的MDH。通过考察菌株生长状态、PQQ 合成、MDH 表达及酶活等因素,初步分析了mpq0771和mpq2496基因在菌株生长代谢中的作用和关系,为阐明甲醇脱氢酶在食甲基杆菌的生长和代谢产物合成过程中的调控机制提了供理论依据。
1 材料与方法
1.1 材料与仪器
食葡糖食甲基杆菌(Methylobacterium glucophilum)J1-1、大肠杆菌(Escherichia coli)pTIG、敲除菌J1-1Δmpq0771本实验室保存;细菌基因组DNA提取试剂盒 北京天根生化科技有限公司;快速质粒小提试剂盒 南京诺唯赞生物科技有限公司;限制性内切酶(10 U/μL)、琼脂糖凝胶DNA 回收纯化试剂盒 赛默飞世尔科技公司;Pfu DNA 聚合酶(2.5 U/μL)、2×Basic Assemble Mix 北京全式金生物技术有限公司;细菌RNA 提取试剂盒、cDNA 第一链合成试剂盒、荧光定量PCR 试剂盒、大肠杆菌感受态细胞DH5α北京擎科生物科技有限公司;甲醇、酵母提取物、胰蛋白胨、琼脂粉、NaCl、MgSO4·7H2O、(NH4)2SO4、Na2HPO4·12H2O、KH2PO4、MnCl2·4H2O、ZnSO4·7H2O、CuSO4·5H2O、CaCl2、柠檬酸铁 分析纯,国药集团化学试剂有限公司;LaCl3·7H2O、庆大霉素(Gentamicin,Gm)、氨苄青霉素(Ampicillin,Amp)分析纯,上海源叶生物科技有限公司;Tris-HCl 分析纯,北京酷莱博科技有限公司;LB 培养基:蛋白胨10 g/L,酵母粉5 g/L,NaCl 10 g/L,121 ℃灭菌;MP 基础培养基:MgSO4·7H2O 0.2 g/L,KH2PO41.4 g/L,(NH4)2SO43.0 g/L,Na2HPO43.0 g/L,CaCl230.0 mg/L,MnCl2·4H2O 5.0 mg/L,ZnSO4·7H2O 5.0 mg/L,CuSO4·5H2O 0.5 mg/L,柠檬酸铁30.0 mg/L,115 ℃灭菌,使用时添加甲醇至10 mL/L,得到MP 培养基,在MP 培养基中添加CaCl2或LaCl3的至终浓度为30 μmol/L,得到含各种金属离子的培养基。
A-14 型常温高速离心机、1-15K 型低温高速离心机 美国Sigma 公司;9080 型恒温培养箱 上海一恒科技公司;BP211D 型分析天平(精度0.01 mg) 德国Sartorius 公司;DYY-Ⅲ-8B 型稳压稳流型电泳仪 北京六一仪器厂;WDP-160 型低温振荡摇床 北京沃德创新医药科技中心;Gel-pro 2020D 型凝胶成像仪 美国Pharmacia Biotech 公司;FLC-3 型超净台 哈尔滨东联有限公司;PRO-2612433 型金属浴 北京金银杏生物科技有限公司;HZQ-F160型恒温振荡摇床 苏州培英实验设备有限公司;CFX96TM 型荧光定量PCR 仪、MiniPROTEAN®3 Cell 型蛋白电泳仪 美国Bio-RAD 公司;T-1 型PCR 仪 德国Biometra 公司;UV-2100 型紫外分光光度计 美国UNICO 公司;VC505 型超声细胞破碎仪 美国Sonics 公司;Milropulser 型电转化仪北京友华照钦医疗器械有限公司。
1.2 实验方法
1.2.1 生物信息学分析 利用J1-1 基因组序列和生物信息学分析筛选出基因组中甲醇脱氢酶基因,再通过BLAST 与扭脱甲基杆菌AM1 中的甲醇脱氢酶基因进行比对分析。基因和蛋白序列获得及序列比对分析网址:http//www.ncbi.nlm.nih.gov/,MP688登录号为CP002252.1,AM1 登录号为CP001510.1。
1.2.2 分子生物学操作 基因组提取、质粒提取、PCR 产物扩增、酶切、连接、转化等常规分子生物学操作参照文献[23]方法。
1.2.3 引物设计 文中所需引物序列如表1。

表1 引物名称及序列Table 1 Names and sequences of primers
1.2.4 敲除菌J1-1Δmpq0771的构建 以J1-1 基因组为模板,采用表1 引物UP-F、UP-R、DOWN-F、DOWN-R 分别扩增上、下游同源臂基因片段(1500 bp),引物Gm-F 和Gm-R 扩增Gm 抗性基因片段(789 bp),产物经1%琼脂糖凝胶电泳后,用胶回收试剂盒纯化。pTIG 质粒用EcoRI、XhoI 内切酶进行双酶切,37 ℃反应2 h,产物经1%琼脂糖凝胶电泳回收。将上述回收产物利用2×Basic Assemble Mix 重组试剂盒进行连接,获得的产物通过热激转化法转入E.coliDH5α感受态细胞中,转化后涂布至含有Amp 抗性的LB 平板上,37 ℃培养。挑取单克隆并活化,菌液PCR 进行验证,结果为阳性的菌液进行测序鉴定。鉴定结果正确后,提取质粒pTIGUP-Gm-DOWN,以该质粒为模板,使用引物UP-F、DOWN-R 扩增片段UP-Gm-DOWN,片段经1%琼脂糖凝胶电泳回收,回收后电击转入J1-1 感受态细胞中,通过Gm 抗性筛选得到敲除菌J1-1Δmpq0771。
1.2.5 生长曲线及PQQ 生物合成测定 将菌株接种至MP 基础培养基中,30 ℃、200 r/min 进行活化,活化后分别接种至含有不同金属离子的培养基中,每隔12 h 测定OD600及PQQ 合成水平,绘制生长曲线及PQQ 合成曲线图,PQQ 测定方法参考文献[24]中的光谱法。
1.2.6 甲醇脱氢酶酶活测定 取1 mL 培养至对数中期的菌液,10000 r/min 离心10 min 后弃上清,重悬于1 mL 20 mmol/L 的Tris-HCl(pH7.0)缓冲液中,置于冰浴中超声处理,4 ℃低温10000 r/min 离心5 min,上清液用于酶活性检测,测定方法参考文献[20]。
1.2.7 甲醇脱氢酶蛋白表达测定 取1 mL 已培养至对数中期的菌液,12000 r/min 离心1 min 后弃上清,重悬于500 μL 1×TE(10 mmol/L pH8.0 Tris-HCl)缓冲液中,置于冰上进行超声破碎(工作3 s,间歇3 s,2 min)。破碎后的菌液在12000 r/min 下离心1 min,取上清进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodiumdodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)。
1.2.8 质谱鉴定 目的电泳条带切下装入无酶EP管中,封口膜封闭管口,送至北京华大基因有限公司进行蛋白质谱鉴定。
1.2.9 实时荧光定量PCR 将菌株J1-1 分别接种至甲醇/无、甲醇/Ca2+、甲醇/La3+和甲醇/Ca2++La3+培养基中,培养至对数生长期,利用试剂盒提取RNA 并逆转录为cDNA 后进行荧光定量PCR,检测不同培养条件下mpq0771、mpq2496基因相对表达情况。
1.3 数据处理
各实验的指标测定均重复3 次,结果用平均值±标准偏差表示,使用Microsoft Excel 进行绘图;序列比对使用DNAMAN 软件进行比对。
2 结果与分析
2.1 菌株J1-1 中甲醇脱氢酶基因的生物信息学分析
通过对J1-1 全基因组序列系统的比对,J1-1 中mpq0771基因与MxaF基因的核苷酸序列同源性为72%,氨基酸序列同源性为53%;mpq2496基因与XoxF基因的核苷酸序列同源性为66%,氨基酸序列同源性为53%;mpq0771基因与mpq2496基因的核苷酸序列同源性为61%,氨基酸序列同源性为48%。如图1 所示,与MxaF 型MDH 的氨基酸序列的D303、E177 对应mpq0771 的D323、E198,推测为催化反应过程中所必需的,与Ca2+发生相互作用[25];如图2 所示,与XoxF 型MDH 的氨基酸序列的D320 对应mpq2496 的D357,推测参与催化反应并与La3+进行配位[26]。综上结果提示,在菌株J1-1 中可能也存在两种类型的甲醇脱氢酶。

图1 mpq0771 中198、323 位氨基酸序列与MxaF 中177、303 位氨基酸序列比对Fig.1 Alignment of amino acid sequences 198 and 323 in mpq0771 and 177 and 303 in MxaF
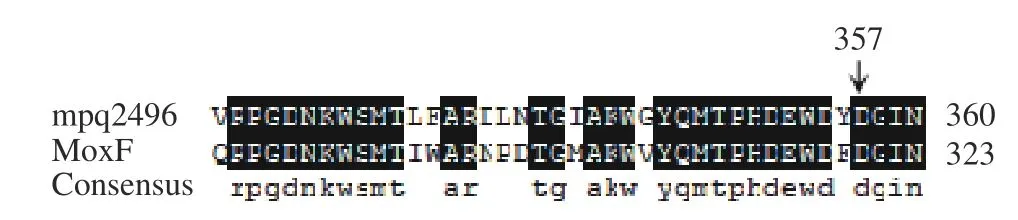
图2 mpq2496 中357 位氨基酸序列与XoxF 中320 位氨基酸序列比对Fig.2 Alignment of amino acid sequences 320 in mpq2496 and 357 in XoxF
2.2 Ca2+、La3+对菌株J1-1 生长及PQQ 生物合成的影响
将菌株J1-1 分别在甲醇/无、甲醇/Ca2+、甲醇/La3+和甲醇/Ca2++La3+4 种培养基中培养,每隔12 h取样测定其OD600及PQQ 产量并绘制曲线(如图3)。菌株J1-1 在含有Ca2+、La3+的培养基中的生长速率均高于在无离子添加培养下的生长速率。前期时,菌株J1-1 在添加Ca2+条件下的PQQ 合成量高于野生菌,后期时合成量低于野生菌;菌株J1-1 在两种含La3+培养基中的PQQ 合成量一直低于野生菌。实验表明Ca2+、La3+均能够促进菌体的生长,但会显著降低PQQ 合成量。
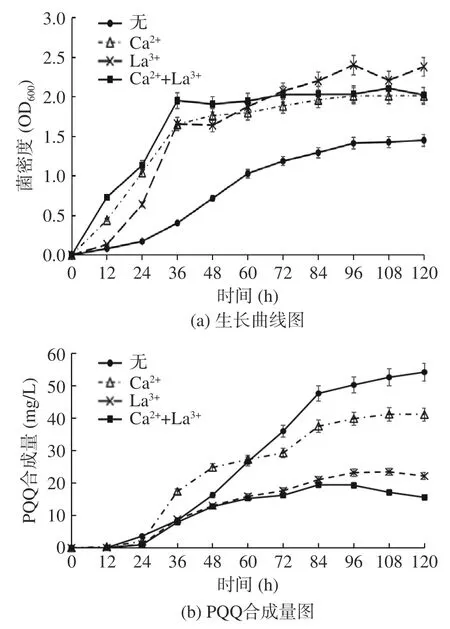
图3 菌株J1-1 在不同培养条件下表型图Fig.3 Phenotypic maps of J1-1 strain under different culture conditions
2.3 Ca2+、La3+对菌株J1-1 甲醇脱氢酶活力的影响
取1 mL 在甲醇/无、甲醇/Ca2+、甲醇/La3+和甲醇/Ca2++La3+4 种培养基中的J1-1 菌液,测定甲醇脱氢酶总酶活。如图4 所示,在甲醇/La3+和甲醇/Ca2++La3+的培养条件下,菌株J1-1 的甲醇脱氢酶活性高于甲醇/Ca2+的培养条件。前期研究表明,菌株J1-1 的甲醇脱氢酶活性与PQQ 产量呈负相关,MDH 氧化甲醇速率加快,导致生成的甲醛累积,菌体“中毒”,从而PQQ 产量下降[21],该实验结果与J1-1在甲醇/La3+和甲醇/Ca2++La3+中的PQQ 合成量低于甲醇/Ca2+的现象相符。

图4 菌株J1-1 在不同培养条件下甲醇脱氢酶酶活测定Fig.4 Determination of methanol dehydrogenase activity of strain J1-1 under different culture conditions
2.4 Ca2+、La3+对菌株J1-1 甲醇脱氢酶蛋白表达的影响
取1 mL 在甲醇/无、甲醇/Ca2+、甲醇/La3+和甲醇/Ca2++La3+4 种培养基中的J1-1 菌液,进行超声处理,取全菌进行SDS-PAGE,蛋白电泳图谱如图5。根据前期实验结果可知,65 kDa 处的蛋白条带为mpq0771基因编码的甲醇脱氢酶。mpq0771 在甲醇/无(泳道1 和2)、甲醇/Ca2+(泳道3 和4)条件下有明显的表达;在甲醇/La3+(泳道5 和6)和甲醇/Ca2++La3+(泳道7 和8)的条件下无肉眼可见的条带,但在其上方处出现一条蛋白表达量增加的条带(蛋白分子量大约为68 kDa),胶内酶切并进行质谱分析鉴定。质谱结果如表2 所示,该蛋白条带与mpq2496基因编码的甲醇脱氢酶匹配最佳,分值为4757,覆盖率为46%,且分子量大小也相符。以上结果显示mpq2496与文献[27-28]报道中XoxF 的特征相似,La3+存在时XoxF 基因表达更强。
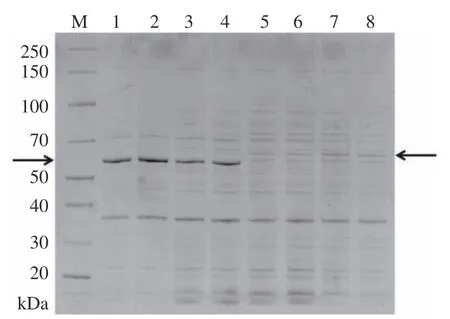
图5 菌株J1-1 在不同培养条件下蛋白表达图Fig.5 Protein expression map of J1-1 strain under different culture conditions
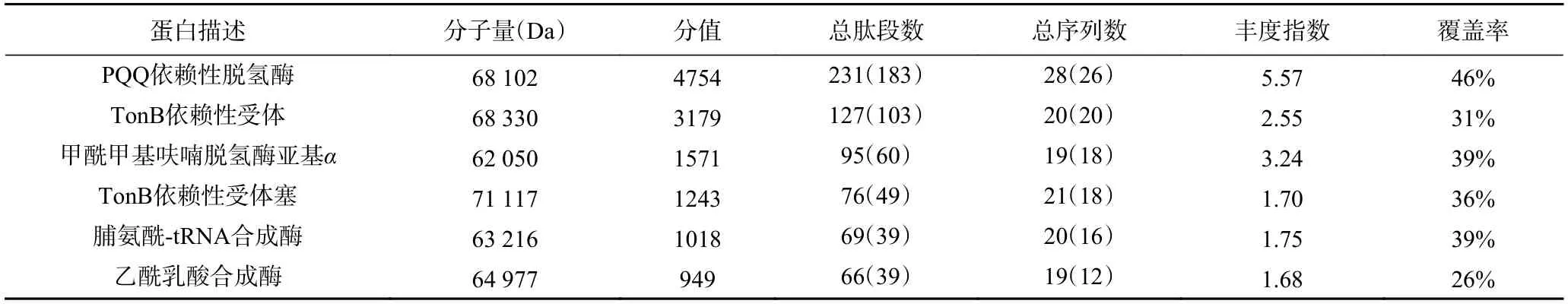
表2 质谱检测结果Table 2 Results of mass spectrum detection
2.5 Ca2+、La3+对菌株J1-1 甲醇脱氢酶基因相对表达量的影响
以cDNA 为模板,GAPDH为内参基因,测定菌株J1-1 在不同条件下mpq0771、mpq2496基因相对表达水平,结果分别如图6a 和图6b 所示。mpq0771和mpq2496 参与甲醇代谢并发挥作用,且Ca2+、La3+对二者的表达水平均有影响。与甲醇/无条件相比,La3+存在时,mpq2496的表达水平均上调,mpq0771的表达水平均下调。与SDS-PAGE 电泳结果相符,无离子添加和只添加Ca2+时,mpq0771 表达水平较高,但在La3+存在时,mpq0771 表达受到阻遏,mpq2496 表达被激活。WANG 等[29]研究也表明La3+可能会阻遏Ca2+依赖型酶和其他蛋白表达。

图6 不同基因在不同培养条件下相对表达水平Fig.6 Relative expression of different genes under different culture conditions
2.6 Ca2+、La3+对敲除菌J1-1Δmpq0771 生长及PQQ生物合成的影响
mpq0771所编码的甲醇脱氢酶是菌株J1-1 能够利用甲醇进行生长的关键基因,在甲醇代谢过程中发挥重要作用。如图7a 所示,菌株J1-1 在缺失mpq0771基因后,培养5 d 后其菌密度仍低于0.2,不能利用甲醇生长。图7b 为PQQ 合成量图,结果显示J1-1Δmpq0771菌株可在含La3+的培养基中利用甲醇生长并能合成PQQ,说明有除mpq0771基因编码的甲醇脱氢酶在发挥作用,使菌株能够正常生长。
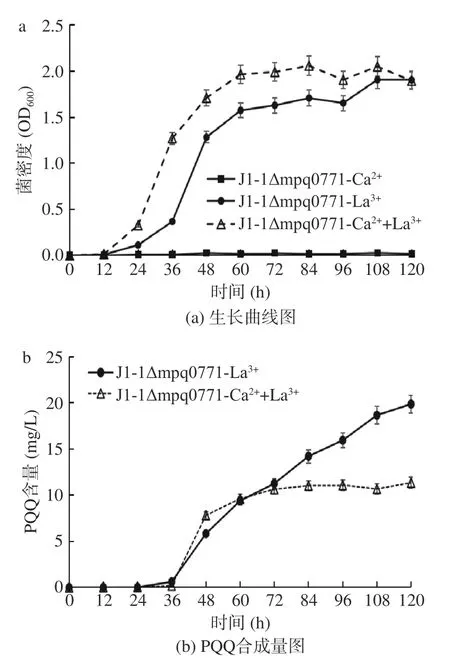
图7 敲除菌J1-1Δmpq0771 在不同培养条件下表型图Fig.7 Phenotypic maps of J1-1Δmpq0771 knockout strain under different culture conditions
2.7 Ca2+、La3+对敲除菌J1-1Δmpq0771 甲醇脱氢酶活力的影响
如图8 所示,敲除菌J1-1Δmpq0771在Ca2+的培养基中不能利用甲醇进行生长,检测不到甲醇脱氢酶的活性;在甲醇/La3+和甲醇/Ca2++La3+条件下的甲醇脱氢酶酶活,敲除菌J1-1Δmpq0771可以利用甲醇且能检测到甲醇脱氢酶活性,说明mpq2496 能够发挥甲醇脱氢酶的作用,也进一步反映了甲醇脱氢酶对于菌株利用和代谢甲醇的重要性。
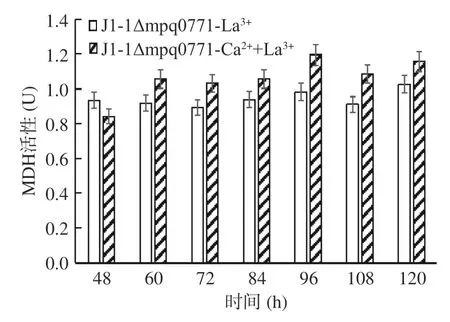
图8 敲除菌J1-1Δmpq0771 在不同培养条件下甲醇脱氢酶酶活测定Fig.8 Determination of methanol dehydrogenase activity of J1-1Δmpq0771 knockout strain under different culture conditions
2.8 Ca2+、La3+对敲除菌J1-1Δmpq0771 甲醇脱氢酶蛋白表达的影响
敲除菌J1-1Δmpq0771的SDS-PAGE 电泳结果如图9 所示。J1-1Δmpq0771在甲醇为碳源的培养基中不能生长,但可在果糖为碳源的培养基中生长。在MP/果糖中J1-1Δmpq0771(泳道2)相较于野生菌J1-1(泳道1)的蛋白指纹图谱缺失一条65 kDa 的甲醇脱氢酶蛋白条带,说明在J1-1Δmpq0771中mpq0771 编码的甲醇脱氢酶不能正常表达,也印证了敲除基因mpq0771后菌株不能再利用甲醇。J1-1Δmpq0771菌株在La3+(泳道3)和Ca2++La3+(泳道4)的培养条件下,mpq2496编码的甲醇脱氢酶蛋白表达量较野生菌高,说明当La3+存在时,mpq2496 能够代替mpq0771 发挥甲醇脱氢酶的作用,即能够利用甲醇进行生长。

图9 敲除菌J1-1Δmpq0771 在不同培养条件下蛋白表达图Fig.9 Protein expression profiles of J1-1Δmpq0771 knockout bacteria under different culture conditions
3 结论
在菌株J1-1 中存在着两种类型的甲醇脱氢酶,mpq0771基因编码的是Ca2+依赖的MxaF 型MDH,mpq2496基因编码的是La3+依赖的XoxF 型MDH,且均参与甲醇代谢。通过考察Ca2+、La3+对菌株J1-1生长状态、PQQ 合成、MDH 表达及酶活等的影响,发现敲除mpq0771基因会对菌株的生长及对甲醇的利用产生较大影响,提示该基因在甲醇代谢中的重要性,且当其表达量高时PQQ 合成水平较高。研究还发现,La3+能使敲除菌J1-1Δmpq0771利用并代谢甲醇,该结果反映了La3+存在时mpq2496 可以代替mpq0771 发挥甲醇脱氢酶的作用,维持菌体生长,即La3+可使XoxF 型MDH 成为食甲基杆菌的主要甲醇脱氢酶[30],mpq0771 与mpq2496 之间还具有分工作用。
综上,菌株J1-1 中mpq0771及mpq2496基因编码的甲醇脱氢酶在甲醇代谢中具有重要作用,也进一步说明了甲醇脱氢酶是甲醇代谢过程中的关键调控点[31]。菌株J1-1 中的两种甲醇脱氢酶具有高表达的特性,提示可利用基因工程技术对此开发一种表达外源蛋白的系统。甲基营养菌具有特殊的一碳代谢网络,可实现利用生物转化生产高附加值产品,如化工产品、天然产物、食品添加剂等[32-33],因此对甲醇脱氢酶作用的研究不仅可为后续深入研究甲基营养菌甲醇利用途径提供理论依据,还有利于生物发酵业的发展。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).
