EDC/NHS交联重组胶原蛋白水凝胶修复关节软骨缺损
2024-05-11黄长瑾唐晓军
黄长瑾,雷 桓,唐晓军
(1. 中国医学科学院北京协和医学院 整形外科医院,北京 100144)
(2. 西北大学化工学院,陕西 西安 710069)
(3. 西北大学 生物医药研究院,陕西 西安 710069)
1 前 言
关节软骨是一种无血管、无淋巴和无网膜的分层结缔组织,由胶原蛋白和蛋白多糖组成。随着人年龄增长,这种极易退化的组织更容易磨损[1-2]。关节软骨损伤、缺损已成为骨科常见疾病。关节软骨缺损会导致严重疼痛、活动受限,甚至造成全关节骨关节炎(osteoarthritis,OA)或永久性关节残疾。此外,由于软骨的无血管结构,其自我再生能力有限。因此,关节软骨再生仍是再生医学中一个具有挑战性的问题[3]。
胶原蛋白在关节软骨损伤的修复过程中起着至关重要的作用[4,5]。目前,已有报道称,多种动物源胶原蛋白可用于构建软骨修复的组织工程支架或水凝胶[6,7]。在关节软骨中,I型胶原和III型胶原均能促进软骨细胞产生细胞外基质[8,9]。然而,动物源胶原蛋白具有低机械强度、免疫原性风险、易产生过敏反应和病毒隐患等缺点[10,11]。
近年来,重组胶原蛋白因具有良好的水溶性、非免疫原性和优异的生物学特性,在伤口敷料和止血海绵等生物材料领域得到了广泛应用,但其力学性能较弱且降解速率较快[12]。用于骨修复的生物材料的机械性能直接影响材料在骨和关节软骨修复过程中的稳定性和支撑性,而降解率影响材料体内修复的可持续性和有效性[13-16]。研究表明,可通过交联增强重组胶原蛋白的机械性能及降低其降解速率[17]。由于重组胶原蛋白的分子特性,高温和辐射强度往往会使蛋白质失活或降解[18]。1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)/N-羟基琥珀酰亚胺(NHS)试剂也通常用于蛋白质交联,该方法交联效果稳定,EDC和NHS不与凝胶产生连接,细胞毒性小[19]。
因此,在本研究中,通过EDC/NHS试剂交联不同类型重组胶原蛋白制备水凝胶,并比较2种水凝胶对软骨缺损的修复效果,为后期应用于软骨修复领域提供依据。
2 实 验
2.1 主要仪器与试剂
所用仪器包括:KZ-II型高速组织研磨仪(武汉Servicebio);D3024R型台式高速冷冻离心机(北京大龙兴创);扫描电子显微镜(Zeiss Ultra 55,德国卡尔蔡司公司);通用材料压缩机(WDW3020,Interstrom Inc.);Sorvall ST8型台式离心机(美国Thermo公司)。
所用材料包括:纯化的重组I型人源化胶原蛋白([HPLC]≥99%,Mr=97 kDa)和重组III型人源化胶原蛋白([HPLC]≥99%,Mr=130 kDa)(由陕西省生物材料与发酵工程技术研究中心提供);EDC/NHS试剂(上海阿拉丁生物技术有限公司);CCK-8试剂盒(南京建成生物公司);TRIzol试剂(赛默飞世尔科技公司);人骨髓间充质干细胞(human bone-marrow mesenchymal stem cells,HBMSCs)(武汉普诺赛生命科技有限公司);HBMSCs成软骨诱导分化培养基(武汉普诺赛生命科技有限公司)。
2.2 重组胶原蛋白水凝胶的制备
在37 ℃和300 r·min-1搅拌条件下,将定量的EDC缓慢溶解在300 mmol·L-1的磷酸盐缓冲液(phosphate buffered solution,PBS)中,使得EDC最终浓度为1.0 g·mL-1。将溶液的pH值调节至4.7后,继续搅拌,将冻干后的重组胶原蛋白固体加入到溶液中并充分混合。EDC可作为重组胶原蛋白链上的羧基活化剂。在相同的条件下,将NHS试剂加入到上述完全混合的溶液中,其中n(EDC)∶n(NHS)=4∶1,并在300 r·min-1下搅拌6 h,得到凝胶状固体[20]。进行冷冻干燥后,粉碎成直径为0.2~1 mm的颗粒,置于50~1200倍体积的PBS清洗5次,每次60 min,以去除凝胶中的残留EDC/NHS试剂。将洗好的颗粒溶胀于PBS中,分别得到重组I型胶原蛋白水凝胶(Gel-Ⅰ)和重组Ⅲ型胶原蛋白水凝胶(Gel-Ⅲ),重组胶原蛋白含量均为20 mg·mL-1,进而灌装于注射器中。
2.3 重组胶原蛋白水凝胶的表征
2.3.1 结构表征
为了观察水凝胶的微观结构,使用液氮将重组胶原蛋白水凝胶冷冻干燥后,涂覆7 nm厚的金层,放置于扫描电子显微镜下观察。
2.3.2 力学性能测试
使用通用材料压缩机测试重组胶原蛋白水凝胶的压缩强度及推挤力[21]。
压缩强度:将水凝胶切割成高度为10 mm、直径为10 mm的圆柱,以1 mm·min-1的速度施加200 g的负荷研究其压缩应力,每组至少测试3次。
推挤力:将填充有重组胶原蛋白水凝胶的注射器安装于通用材料压缩机,设置推挤速度为30 mm·min-1,检测并记录推挤力曲线。
2.3.3 降解性能测试
用pH值为7.4的PBS溶液配制浓度为50%的I型胶原酶溶液,过滤除菌后放于4 ℃备用。先对干燥后的水凝胶材料称重(W0),然后用60 Co射线照射。在无菌条件下,将所有样品置于相同体积的酶溶液中,用封口膜封住瓶口。放于37 ℃细胞培养箱中,分别在1,2,3,4,5和6周取样,用超纯水冲洗酶解后的样品3次,然后用真空冷冻干燥机干燥后称重(W1)。根据公式WL=(W0-W1)/W0×100%计算水凝胶的降解率(WL)。
2.3.4 溶胀性能测试
记录冷冻干燥后的重组胶原蛋白水凝胶初始质量,记录为Wi。随后,在37 ℃下,将其置于PBS中(pH=7.4),在固定的时间点(5,10,30,60,90,120,180 min)取出,称重并记录为Wt,直至质量没有变化。溶胀度SR按式(1)计算:
(1)
交联度按式(2)[22]计算:
(2)
其中,ρx为样品在37 ℃下由弹性模量和溶胀率所确定的交联度,G为样品的弹性模量,Q为样品在37 ℃下的溶胀度,T为绝对温度(310 K),R为平衡常数(8.314×103kPa·cm3·mol-1·K-1)。
2.4 体外生物活性研究
2.4.1 细胞毒性试验
将2种水凝胶以100 mg·mL-1的浓度浸入到HBMSCs成软骨诱导分化培养基中,在37 ℃下浸提72 h,过滤后得到浸提液备用。将生长状态良好的HBMSCs接种于96孔板上(接种密度为1×104个/孔)并于培养箱中培养,将2种水凝胶的浸提液分别加入到孔板中(100 μL/孔)作为试验组,另外一组仅加入培养基作为对照组。分别培养24,48和72 h后加入含有CCK-8试剂的培养基,并在培养箱中再培养2~4 h。使用450 nm波长光测量每个孔的吸光度A。细胞存活率用式(3)计算:

2.4.2 黏附试验
将冷冻干燥后的重组胶原蛋白水凝胶置于12孔板中。将生长状态良好的HBMSCs经消化、离心、重悬、计数操作后,滴加100 μL含有1×105个HBMSCs的悬浮液于水凝胶上,使HBMSCs完全粘附在凝胶上生长。6 h后,加入1.5 mL HBMSCs成软骨诱导分化培养基于孔板中,并在培养箱中培养12 h。使用戊二醛固定水凝胶,通过SEM观察水凝胶中的HBMSCs。
2.4.3 甲苯胺蓝染色
按照2.4.1中的方法得到2种水凝胶浸提液备用。将生长状态良好并经过稀释的HBMSCs接种于12孔板上(接种密度为3×105个/孔)。待细胞长满孔底部80%以上后,将原有培养液移除。将2种水凝胶的浸提液分别加入到孔板中(1 mL/孔)作为试验组。对照组加入1 mL的HBMSCs成软骨诱导分化培养基。培养24 h后,使用4%多聚甲醛将HBMSCs固定,将定量甲苯胺蓝染色溶液加入孔中,并在37 ℃下孵育1 h。染色结束后,用PBS洗涤2次。拍摄记录图像,并使用ImageJ软件分析蓝色染色区域的面积。
2.4.4 免疫荧光染色
细胞固定后与特定抗体(Ⅱ型胶原蛋白COLⅡ)在室温下孵育,使用 DAPI 染色观察细胞核。孵育结束后,使用尼康 A1 激光共聚焦显微镜进行拍摄。
2.4.5 实时荧光定量PCR(real-time quantitative polymerase chain reaction,RT-qPCR)
按2.4.3相同的方法使用浸提液处理HBMSCs 24 h后,使用TRIzol法提取细胞RNA[23]。随后,使用从Thermo Fisher Scientific(USA)获得的逆转录互补DNA(cDNA)合成试剂盒进行cDNA合成。利用cDNA进行RT-qPCR试验[24]。以β-actin基因作为内参基因。表1列出了实验中使用的详细引物信息。

表1 RT-qPCR 所用引物序列
2.5 体内软骨修复功效探究
2.5.1 试验动物及分组
所有动物实验均经过西北大学实验动物管理与伦理委员会审查,实验符合动物伦理机构相关的要求(伦理批号:NWU-AWC-20220904M)。将12只健康的新西兰兔子适应性喂养7 d后,将12只兔子分为2组,每组6只。一组为Gel-Ⅰ组,用Gel-Ⅰ填充兔子左侧关节软骨缺损处,右侧关节软骨穿孔作为缺损对照。另一组为Gel-Ⅲ组,用Gel-Ⅲ样品填充兔子左侧关节软骨缺损,右侧关节软骨穿孔作为缺损对照[25]。
2.5.2 关节软骨缺损动物模型建立
将麻醉后的兔子固定在解剖台上,覆盖无菌洞巾,使用碘伏对手术区域进行消毒。在膝盖外侧做一个纵向切口打开关节,在髌骨脱位并暴露出关节软骨,使用钻孔器在左腿胫骨关节面钻孔(直径4 mm,深度2 mm)建立关节软骨缺损模型,并将水凝胶缓慢注射到软骨缺损处。右侧只进行缺损造模作为缺损对照。术毕逐层缝合伤口,对皮肤伤口进行消毒,术后3 d内每天肌肉注射8万单位青霉素。术后恢复期间,每天监测兔子2次,持续5 d。实验过程及手术过程示意图见图1。
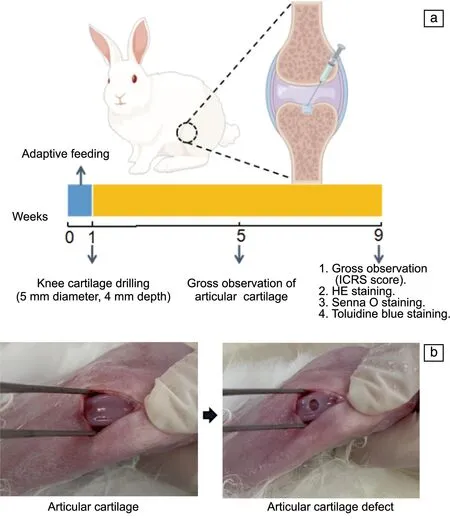
图1 关节软骨缺损动物模型建立:(a)动物实验流程图,(b)关节软骨缺损手术前后Fig.1 Establishment of an animal model for articular cartilage defect:(a)animal experiment flowchart,(b) articular cartilage before and after surgery
2.5.3 软骨缺陷观察和组织学分析
术后第4周和第8周取出兔子膝关节骨组织,并拍摄缺陷修复情况,记录修复处的覆盖范围、与周围正常软骨组织的融合程度,根据ICRS软骨修复评分标准评估修复组织[26]。膝关节标本固定2 d后,通过Micro-CT扫描缺损区修复的骨组织,并使用VGS Studio Max软件生成三维结构,观察冠状和轴向位置的新骨组织,计算骨体积/组织体积(BV/TV)、小梁数量(Tb.N)、小梁分离度(Tb.Sp)和小梁厚度(Tb.Th)以评估骨修复效果。
使用EDTA对关节标本脱钙2个月,石蜡包埋,制备5 μm厚的切片用于后续染色实验,包括苏木精染色(H&E)、甲苯胺蓝染色(T-B)和番红固绿染色(S-F),以观察骨软骨缺损处新修复的软骨组织。根据GB/T 16886.6-2022《医疗器械生物学评价第6部分:植入后局部反应试验》对组织进行观察和评分。使用ImageJ软件测量H&E染色切片新生软骨的厚度、缺损处S-F染色和T-B阳性区域的面积。
2.6 统计学分析
使用Origin和IBM SPSS Statistics 21.0(SPSS Inc. USA)进行数据处理。所有实验独立重复3次,实验结果以“平均值(mean)±标准偏差(standard deviation,SD)”的形式表示。以下情况认为有显著性,有统计学意义:P<0.05(*),P<0.01(**),P<0.001(***)。
3 结果与讨论
3.1 交联机理
EDC/NHS交联剂与重组胶原蛋白的羧基反应,偶联到O-异酰基脲结构上,这种活化的中间体与重组胶原的氨基交联,形成酰胺键[27]。在交联过程中,EDC和NHS催化胶原链中的羧基和氨基之间形成酰胺键,本身并不产生交联[28],如图2所示。因此,EDC和NHS不与凝胶产生连接,细胞毒性小[29]。

图2 EDC/NHS交联重组胶原蛋白凝胶的制备机理示意图Fig.2 Mechanism schematic of recombinant collagen gel preparation by EDC/NHS cross-linking
3.2 水凝胶微观结构
图3a和3b是Gel-Ⅰ和Gel-Ⅲ 2种水凝胶的SEM形貌,可以观察到不规则的多孔结构,孔连通性较好,孔径在50~200 μm之间(图3c)。水凝胶的孔径受交联度的影响,进而影响水凝胶的机械强度、网状结构以及溶胀特性[30]。在骨软骨再生过程中,孔径较小(100~200 μm)的支架更有利于软骨形成[31,32]。在含小孔(150 μm)更多的水凝胶上,软骨细胞表达更高水平的COL2A1,而750 μm孔大小的水凝胶中的软骨生成细胞大多呈现肥大表型,更高水平表达COL10A1[33,34]。在本研究中,Gel-Ⅰ和Gel-Ⅲ的孔径都在50~200 μm之间,均可更好地诱导HBMSCs分化为软骨细胞。

图3 水凝胶的SEM形貌(a,b)和孔径分布(c)Fig.3 SEM morphologies (a,b) and pore size distributions (c) of gels
3.3 水凝胶可注射性能及降解性能
2种水凝胶填充于注射器中均能均匀推出,且推挤力小于10 N(图4b),表明2种水凝胶均具有可注射性,可以满足治疗时的操作便捷性要求[35]。
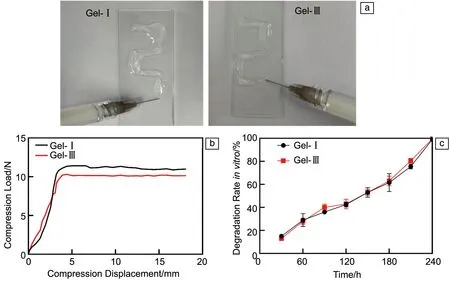
图4 水凝胶的可注射性(a)、推挤力-位移曲线(b)和降解曲线(c)Fig.4 Injectability (a),pushing force-displacement curves (b) and degradation curves (c) of gels
此外,重组胶原蛋白水凝胶用于人体,那就必需被人体内的酶液降解,因此实验选用胶原酶来代替人体内能够产生的酶液进行降解性能研究。如图4c所示,Gel-Ⅰ和Gel-Ⅲ的降解曲线没有显著性差异。水凝胶在降解过程中存在分子链的变化,降解行为来源于水凝胶网络以及基质本身的降解。
3.4 水凝胶力学性能及溶胀性能
在原料方面,与重组Ⅲ型胶原蛋白相比,重组I型胶原蛋白具有更强的拉伸强度,制成水凝胶后,Gel-Ⅰ亦表现出比Gel-Ⅲ更大的抗压能力(图5a,P<0.05)。在日常生活中,关节软骨需要承受关节区域的压力[36]。因此,机械强度是影响植入材料在关节骨软骨缺损修复应用的关键因素。现有研究表明,兔和人关节软骨的压缩模量值分别约为0.8 MPa和(1.03±0.48) MPa[37,38]。本研究制备的Gel-Ⅰ和Gel-Ⅲ的最大压缩强度均大于1.5 MPa,因此,Gel-Ⅰ和Gel-Ⅲ均能满足人体和兔关节软骨的力学性能。
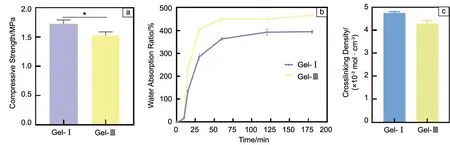
图5 水凝胶压缩强度(a)、溶胀性能(b)和交联度(c)Fig.5 Compressive strength (a),swelling property (b),and cross-linking degree (c) of gels
2种水凝胶的吸水率迅速增加并逐渐趋于平稳,在120 min内可达到溶胀平衡(图5b)。交联度与水凝胶机械强度、孔径、溶胀行为之间存在密切关系。稳定的分子链和更多的交联位点可以增加水凝胶的交联度,促使较高的压缩强度。2种水凝胶的交联度和压缩强度成正比关系,推测可能是由于EDC/NHS主要作用于重组胶原蛋白的氨基和羧基,而Col Ⅰ的酸性氨基酸数量多于Col Ⅲ(酸性氨基酸:Col Ⅰ141个,Col Ⅲ129个;碱性氨基酸:Col Ⅰ 137个,Col Ⅲ 137个),因此Gel-Ⅰ相比Gel-Ⅲ具有相对较大的交联度(图5c)、更高的机械强度(图5a)和较小的孔径(图3a)。
3.5 水凝胶细胞相容性
图6a的细胞增殖率数据表明,与对照组相比,Gel-Ⅰ组在培养第3 d和第7 d显著促进了HBMSCs的增殖(P<0.05,P<0.01)。尽管Gel-Ⅲ组没有观察到促细胞增殖作用,但与对照组相比没有显著差异,表明无细胞毒性作用。通过SEM进一步观察了HBMSCs在重组胶原蛋白水凝胶上的黏附作用,结果表明,Gel-Ⅰ和Gel-Ⅲ上均有HBMSCs的聚集生长(图6b)。上述结果表明,用重组胶原蛋白制备的Gel-Ⅰ和Gel-Ⅲ具有良好的生物相容性。
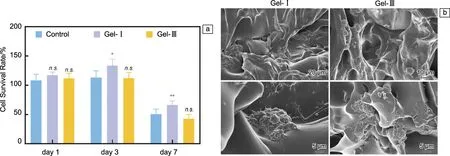
图6 水凝胶体外生物活性研究结果:(a)细胞增殖率实验结果,(b)细胞黏附的微观形貌Fig.6 In vitro bioactivity evaluation of hydrogels:(a)cell survival rate results,(b) SEM morphologies of cell adhension
3.6 水凝胶促HBMSCs成软骨分化作用
诱导HBMSCs成软骨分化表征结果显示,Gel-Ⅰ组和Gel-Ⅲ组的T-B染色均呈阳性(图7a),表明2种凝胶都能促进糖胺聚糖的分泌,且Gel-Ⅰ的促进作用优于Gel-Ⅲ。COLⅡ是软骨组织的主要成分,由软骨细胞分泌,有助于维持软骨细胞结构和功能[39]。通过免疫荧光染色进一步反映软骨细胞细胞外基质COL Ⅱ的分泌(图7b)。
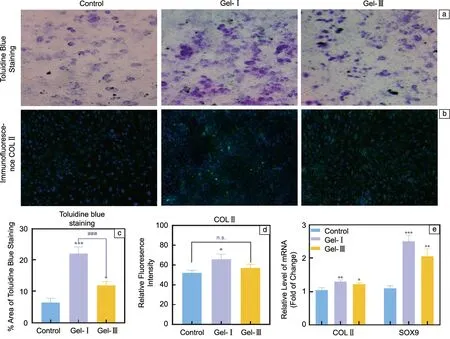
图7 重组胶原蛋白水凝胶促进人骨髓间充质干细胞(human bone-marrow mesenchymal stem cells,HBMSCs)向软骨细胞分化的效果表征:甲苯胺蓝染色结果(a)及COLⅡ免疫荧光染色结果(b);(c,d)甲苯胺蓝染色和免疫荧光染色量化分析;(e)软骨细胞标记基因的相对表达水平统计Fig.7 Effect of recombinant collagen hydrogel on promoting differentiation of HBMSCs into chondrocytes:toluidine blue staining results (a) and COLⅡ immunofluorescence staining results (b);(c,d) quantitative analysis of toluidine blue staining and immunofluorescence staining;(e) statistics of relative expression level of chondrocyte marker genes
Gel-Ⅰ干预后,细胞内绿色荧光区域的强度和面积增加,表明细胞分泌的COLⅡ增加(图7d),细胞有从HBMSCs向软骨细胞分化的趋势。糖胺聚糖和COLⅡ是软骨细胞外基质的关键成分,在软骨修复中起到重要作用。上述结果表明,Gel-Ⅰ干预后,HBMSCs分泌的糖胺聚糖与COLⅡ表达的比例高于Gel-Ⅲ,表明Gel-Ⅰ 促进HBMSCs向软骨细胞分化的能力优于Gel-Ⅲ。
进一步测定各组HBMSCs中软骨标记基因的相对表达量[40]。结果如图7e所示,与对照组相比,Gel-Ⅰ组的COLⅡ基因和SRY转录因子9(SRY-box transcription factor 9,SOX9)基因的表达水平显著上调(P<0.05,P<0.01)。Gel-Ⅲ组的COLⅡ基因表达没有显著差异(P>0.05),SOX9基因的表达显著升高(P<0.05)。这些结果表明,Gel-Ⅰ具有促进HBMSCs向软骨细胞分化的优越能力,并且促进分化的效果优于Gel-Ⅲ。
3.7 重组胶原蛋白水凝胶促进体内关节软骨修复的效果
通过建立兔关节软骨缺损模型评价重组胶原蛋白水凝胶的体内修复效果[41]。在整个过程中,实验动物状态良好,无死亡现象,且伤口未发生感染。术后4周,3组动物软骨缺损部位新生组织的形态和外观与周围正常软骨均有差异,并有明显边界(图8)。对术后8周的关节软骨缺损处及修复效果,根据ICRS评分标准进行评分。结果显示,Gel-Ⅰ组软骨缺损已基本完全修复,缺损处新生组织表面光滑透明,与周围正常软骨在形态和颜色上无明显差异,未见明显边界。Gel-Ⅲ组大部分软骨缺损已被修复,但缺损修复后的组织颜色为乳白色,与正常软骨之间有明显的边界。对照组软骨缺损部位仍有较大缺损。与对照组相比,Gel-Ⅰ和Gel-Ⅲ组的填充水凝胶均表现出良好的软骨修复能力(P<0.001,P<0.01),且Gel-Ⅰ的修复能力优于Gel-Ⅲ(P<0.05)。
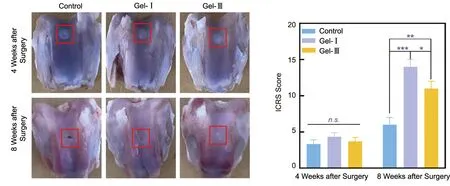
图8 不同类型重组胶原蛋白水凝胶对兔子体内软骨缺损修复效果的照片和ICRS评分Fig.8 Images and ICRS evaluation of in vivo cartilage repair by different types of recombinant collagen prepared hydrogels
通过显微CT观察各组水凝胶促进软骨缺损内部生长的情况[42]。结果如图9所示,对照组软骨和软骨下层仍有明显缺损,未形成有效修复;Gel-Ⅰ组植入材料与周围骨骼和软骨融合良好,Gel-Ⅲ组仍有部分内部间隙,且该组的软骨修复效果略差于Gel-Ⅰ组。通过VGS Studio Max软件分析了骨体积/组织体积(BV/TV)、小梁数量(Tb.N)、小梁分离度(Tb.Sp)和小梁厚度(Tb.Th)。术后8周,Gel-Ⅰ组在骨体积大小方面表现出明显优势(P<0.05),表明软骨下骨已形成并有效恢复,小梁的数量和厚度最高,小梁间距最小,即小梁分布更均匀。

图9 软骨缺损修复术后8周显微CT扫描图像及数据分析Fig.9 Micro-CT scan images and data analysis after 8 weeks of cartilage defect repair surgery
术后8周的组织学染色结果如图10所示。从新组织切片的细胞形态来看,对照组细胞分散,且缺损表面可见大量炎症细胞,软骨下骨重建程度小于50%。Gel-Ⅰ组新生组织可见软骨细胞。细胞呈圆形,排列整齐,结构正常,未见炎症细胞,且软骨下骨修复程度良好,缺损处新软骨厚度与相邻软骨厚度相同。Gel-Ⅲ组缺损处有新生组织,其厚度略低于邻近软骨,新组织表面有大量排列规则的纤维细胞,表明新组织主要为纤维组织。根据GB/T 16886.6-2022 《医疗器械生物学评价第6部分:植入后局部反应试验》[43],从3个角度对每组组织进行评分:新生血管、纤维化和脂肪浸润。结果显示,对照组的组织中存在大量新生血管,缺损处出现明显的脂肪细胞堆积,组织反应评分较高。Gel-Ⅰ组几乎没有明显的组织反应,组织反应评分在0~1之间。植入Gel-Ⅲ后,组织中表现出较宽条带形式的纤维化反应,其组织反应评分与对照组和Gel-Ⅰ组均有显著差异。 H&E染色结果显示,缺损处新生软骨厚度Gel-Ⅰ>Gel-Ⅲ>对照组,3组之间存在显著差异(P<0.001)。S-F染色与T-B染色结果显示,在Gel-Ⅰ组中观察到更大面积的阳性区域面积,表明该组的软骨覆盖率更高;且其厚度与邻近软骨组织的厚度一致,并且分布均匀,没有明显的间隔。针对Gel-Ⅰ和Gel-Ⅲ在软骨修复效果之间的差异,推测原因如下:在原材料方面,与重组III型胶原相比,重组I型胶原具有良好的张力和强度,可以为组织提供结构支撑,并保持其弹性和稳定性。在结构上,Gel-Ⅰ具有更均匀的多孔结构,有助于软骨细胞在凝胶上生长,加速软骨修复。从生物学角度来看,与Gel-Ⅲ对比,Gel-Ⅰ更能显著促进HBMSCs向软骨细胞分化,从而释放糖胺聚糖和COLⅡ,促进软骨组织修复。
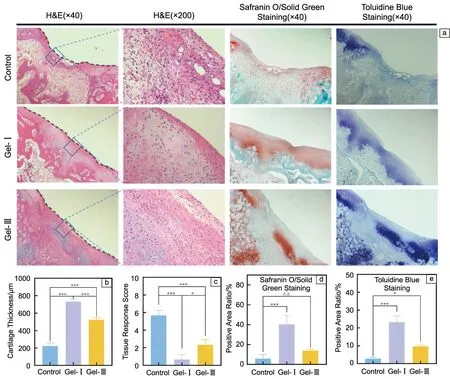
图10 软骨缺损修复术后8周组织学染色及分析:(a)软骨缺损部位的组织病理学染色,(b)软骨缺损部位新生软骨厚度分析,(c)对组织切片的组织反应的评分结果,(d)软骨缺损部位番红固绿染色阳性的面积比例,(e)软骨缺损部位甲苯胺蓝染色阳性的面积比例(数据表示为平均值±标准差)Fig.10 Histological staining and analysis after 8 weeks of cartilage defect repair surgery:(a) histopathological staining of cartilage defect sites,(b) thickness analysis of newborn cartilage at cartilage defects sites,(c) tissue response scoring,(d) the area ratio of positive staining of Safranin O/solid green at cartilage defect sites,(e) the area ratio of positive toluidine blue staining at cartilage defect sites (Data were expressed as the mean±standard deviation)
4 结 论
(1)使用EDC/NHS试剂交联重组胶原蛋白制备可注射水凝胶Gel-Ⅰ和Gel-Ⅲ,比较了两者的孔径、压缩强度、推挤力、溶胀性能/交联度、降解性能,结果显示Gel-Ⅰ具有更优的力学性能。
(2)在体外细胞研究中,2种凝胶均表现出良好的生物相容性,在诱导HBMSCs分化成软骨细胞的试验中Gel-Ⅰ的诱导分化能力优于Gel-Ⅲ。
(3)在兔膝关节软骨损伤模型中,Gel-Ⅰ和Gel-Ⅲ对比对照组均显示出显著的软骨缺损修复效果,Gel-Ⅰ比Gel-Ⅲ具有更强的软骨修复潜力。一方面,Gel-Ⅰ的力学性能和良好的生物相容性可以保护软骨缺损免受二次损伤。另一方面,Gel-Ⅰ可以更大程度地促进HBMSCs向软骨细胞的分化,促进细胞外基质的合成,减缓胶原蛋白的降解,从而更好地修复关节软骨。本研究展现了Gel-Ⅰ在软骨修复中的潜力,但还需要进一步的研究来阐明其机制。
