基于超声引导下微波消融胰腺癌肝转移的疗效探讨及其受益人群筛选
2024-05-11柴孟薇丁文臻
马 骏 柴孟薇 丁文臻 郑 琳 于 杰 梁 萍
胰腺癌是恶性程度最高的肿瘤之一,患者5 年生存率仅10%~20%[1]。由于病变位置深,临床症状多不明显,仅10%的患者在发现胰腺癌时具有手术机会,且术后60%的患者可在1 年后复发[2]。对于胰腺癌肝转移患者,美国国立综合癌症网络美国和日本胰腺学会指南[3]均推荐进行FOLFIRINOX(亚叶酸钙、氟尿嘧啶、伊立替康和奥沙利铂)或AG(吉西他滨联合白蛋白紫杉醇)一线联合化疗方案。而患者即使接受化疗,其1 年生存率也仅20%左右[4]。因此,对于转移性胰腺癌患者,寻找一种更为积极的治疗方式以延长生存时间具有重要的意义。近年来,超声引导下微波消融在肝脏领域得到广泛应用,尤其在小肝癌治疗中取得了与手术相媲美的治疗效果[5],但在胰腺癌肝转移方面应用较少。本研究探讨了超声引导下微波消融治疗胰腺癌肝转移的疗效,筛选消融治疗受益人群,旨在为临床诊治提供参考。
资料与方法
一、研究对象
回顾性收集2018 年5 月至2022 年12 月于解放军总医院行超声引导下微波消融的胰腺癌肝转移患者41 例,其中男24 例,女17 例,年龄31~78 岁,平均(57.63±10.44)岁。所有病灶均于消融前经穿刺活检证实为胰腺癌肝转移,原发灶均为中低分化胰腺癌;其中26 例术前进行化疗,15 例术前未行化疗;单纯肝转移31 例,合并其他脏器转移10 例;原发灶经过治疗者26例,未行处理者15例;病灶数量≥3个者11例,<3个者30例;病灶最大径≤5 cm者35例,>5 cm者6例;术前血清糖类抗原(CA)199≥500 U/ml 者17 例,<500 U/ml者24例。纳入标准:①年龄>18岁;②转移灶局限于肝内或肝外转移病灶稳定(4 周内病灶最大径之和增加<20%且无新生病灶出现);③术前均未行靶向免疫治疗;④对肝脏所有病灶均行完全消融。排除标准:肝脏转移灶进展、严重凝血功能障碍和器官衰竭者。本研究经医院医学伦理委员会批准(批准号:S2021-439-01),所有患者术前均签署知情同意书。
二、仪器与方法
1.仪器与试剂:超声引导使用GE Logiq E9彩色多普勒超声诊断仪,3C 探头,频率2.5~7.0 MHz;造影剂使用SonoVue(意大利博莱科公司);微波消融使用KY-2000 微波消融仪(南京康友医疗科技有限公司),输出频率为2450 MHz;术中常规使用全自动麻醉机及心电监护仪。
2.消融方法:术前行二维超声及超声造影确定病灶大小及位置,并选择合适的穿刺路径,待患者全身麻醉后消毒手术位置,1%利多卡因皮下注射后尖刀切皮。消融前采用18 G 活检针对病灶进行2~3 次穿刺,通过病理检查确定病灶性质。然后进行微波消融,于超声引导下插入微波消融针,根据病灶位置、形状和大小确定消融功率(10~60 W)和消融时间(1~10 min)。消融针的有效尖端为0.5 cm或1.0 cm,整个消融过程中予实时水循环降低针杆温度以保证治疗安全,消融安全边界至少达到5 mm 以实现完全消融,并通过多次进针重叠消融以实现更大的有效治疗面积。消融结束后即刻行超声造影观察消融边界,若无增强的消融区域完全覆盖病灶,则认为完全消融(图1);若仍有残余增强区则进行再次消融。为防止针道种植及出血,消融结束退针过程中常规行针道消融。
3.一般资料收集:记录患者年龄、性别、病灶综合大小(病灶数量与最大径的乘积)、原发灶处理情况[除化疗外的其他局部治疗方式(如手术、栓塞等)]、美国东部肿瘤协作组制定的简化的活动状态评分表(ECOG)评分等,以及术前最近1 次(消融前3 d 内)实验室检查结果,包括CA199、CA125、癌胚抗原、甲胎蛋白、国际标准化比值、血糖、肌酐、血常规及肝功能指标等。
4.临床随访:术后第1年每3个月随访1次,1年之后每半年随访1 次,以患者死亡为随访终点。随访内容包括:总生存时间(消融手术时间至患者死亡时间)、并发症发生情况(包括主要并发症和其余并发症)。其中主要并发症定义为任何可能需要额外治疗的事件,如延长住院时间、永久性不良后遗症等;其余并发症均定义为轻微并发症,如发热、暂时性腹痛、恶心呕吐等。
三、统计学处理
应用R语言(4.3.3),连续变量以中位数表示,采用Mann-WhitneyU检验;分类变量以例表示,采用χ2检验或Fisher确切概率法。患者基线资料和实验室检查结果均行共线性分析和单因素分析,将差异有统计学意义的指标纳入多因素Cox 回归分析,筛选胰腺癌肝转移患者预后的独立影响因子,建立预测患者术后半年和1 年生存率的联合诊断模型,并绘制列线图可视化。绘制校准曲线评估模型的有效性;决策曲线评估模型的临床收益;应用survival包绘制时间依赖受试者工作特征(ROC)曲线,根据约登指数最大值将纳入患者分为高危组和低危组,绘制生存曲线评估并比较两组生存情况的差异。P<0.05为差异有统计学意义。
结果
一、临床随访结果
41 例胰腺癌肝转移患者,中位随访时间12(4,15)个月;其中19 例在1 年内死亡,22 例存活1 年以上,中位生存时间12(6,14)个月。微波消融后28 例出现术后发热,9 例出现术后暂时性腹痛,均于休息后迅速缓解,所有患者均无主要并发症发生。
二、共线性分析及单因素分析结果
将患者基线资料和实验室检查结果纳入共线性分析(表1),最终筛选出23 个指标纳入单因素分析,结果显示CA199、CA125 及病灶综合大小均与胰腺癌肝转移患者总生存时间相关(HR=1.100、1.004、1.117,均P<0.01)。见表2。
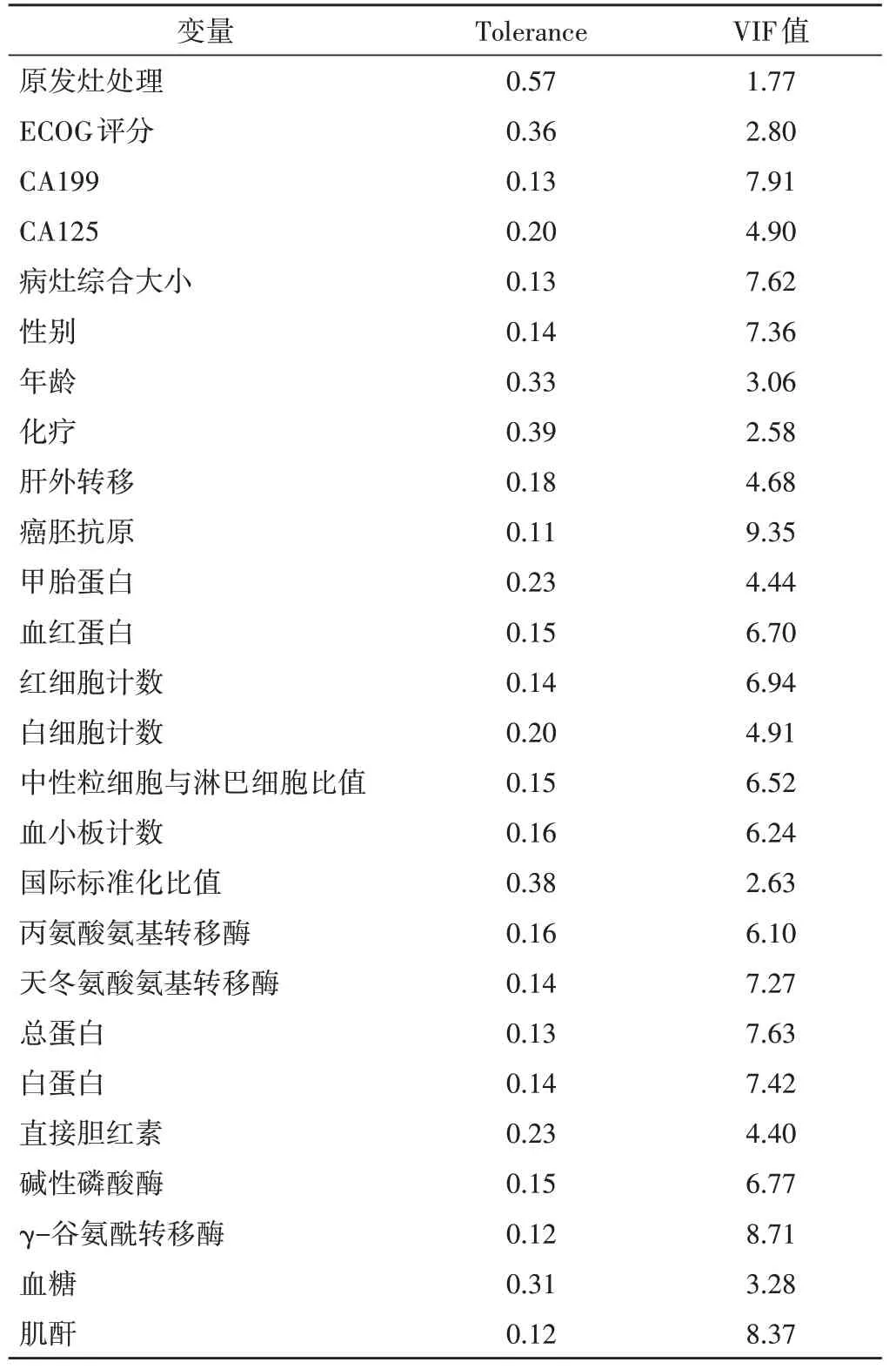
表1 共线性分析结果
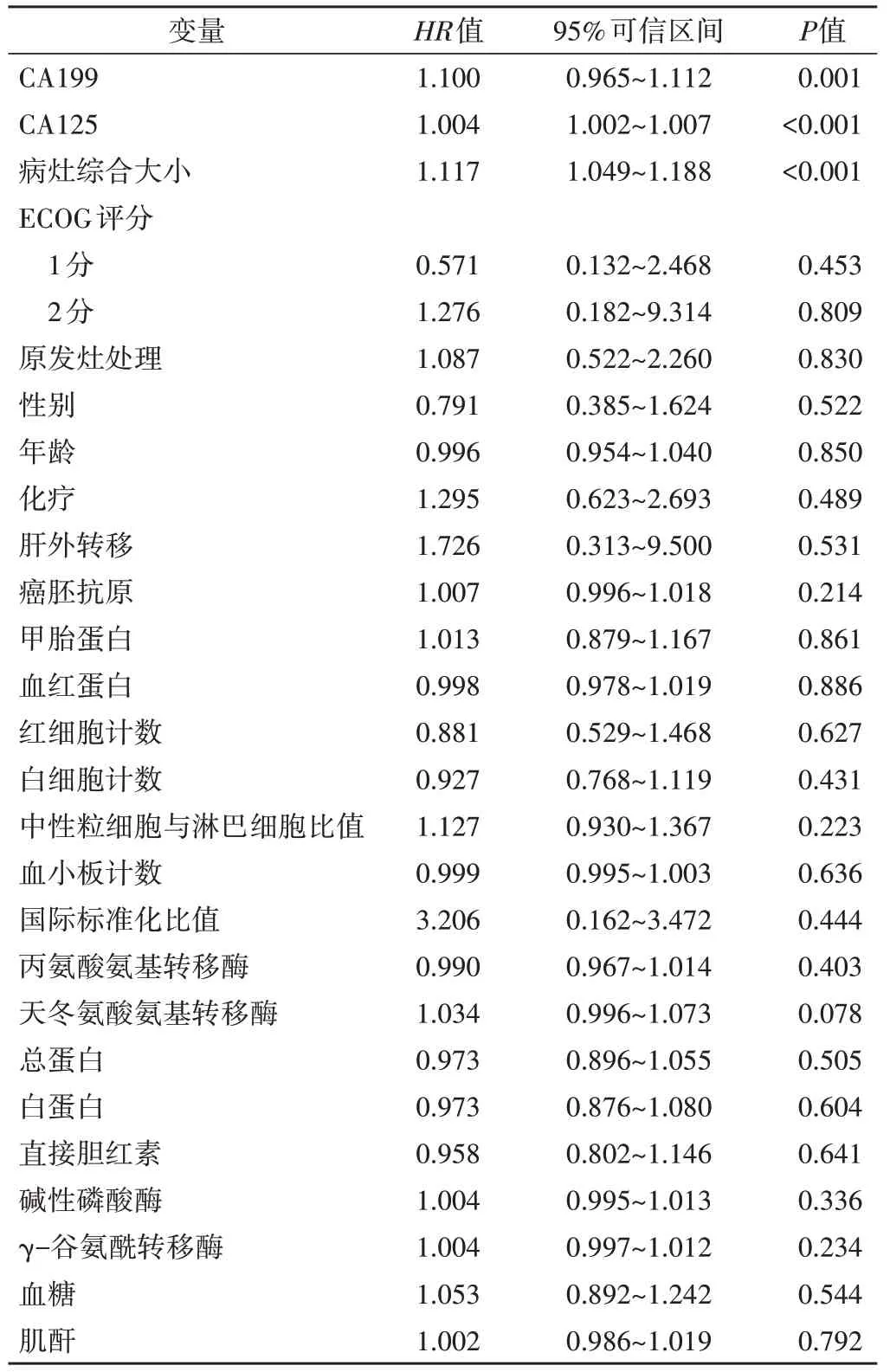
表2 单因素分析结果
三、多因素Cox回归分析结果
将单因素分析中差异有统计学意义的指标(CA199、CA125 和病灶综合大小)和既往文献[6-7]中胰腺癌肝转移患者预后相关的独立危险因素(中性粒细胞与淋巴细胞比值、癌胚抗原)纳入多因素Cox回归分析,结果显示CA125、病灶综合大小均为胰腺癌肝转移患者预后的独立影响因子(HR=1.004、1.110,P=0.012、0.021)。见表3。

表3 多因素Cox回归分析结果
四、模型的建立及验证
1.分别建立基于CA125、病灶综合大小和基于CA199(根据临床实际和既往文献[8]表明CA199 为判断手术可行性、预测肿瘤预后的重要因素)、CA125、病灶综合大小的联合预测模型(图2),结果显示三项联合预测模型的一致性指数高于两项联合预测模型(0.761 vs.0.756),故后续研究排除两项联合预测模型,仅对三项联合预测模型的效能进行验证。
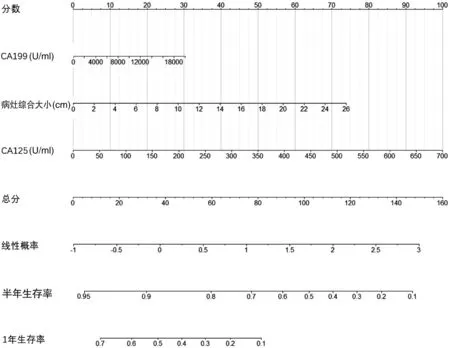
图2 CA199、CA125、病灶综合大小联合应用预测胰腺癌肝转移患者生存时间的列线图
2.校准曲线显示,该预测模型具有良好的区分能力和校准度。见图3。决策曲线显示,该预测模型可以很好地预测胰腺癌肝转移患者术后半年及1年生存率,可获得临床收益。见图4。
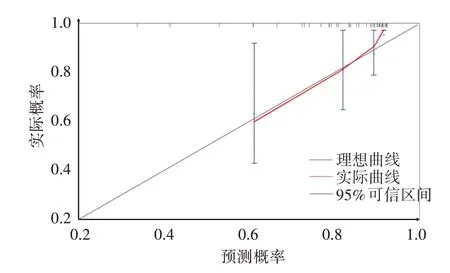
图3 三项联合预测模型的校准曲线图
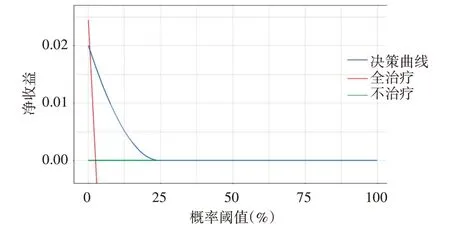
图4 三项联合预测模型的决策曲线图
3.根据时间依赖ROC 曲线得到所有患者列线图总分的截断值为33 分,由此分为高危组患者18 例,低危组患者23例。生存曲线显示,两组中位生存时间比较[7(5,11)个月vs.15(13,18)个月],差异有统计学意义(P=0.046)。见图5。
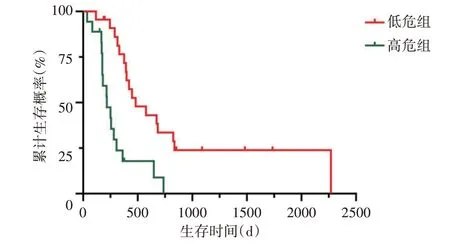
图5 预测高危组和低危组患者生存时间的生存曲线图
讨 论
胰腺癌肝转移恶性程度高,患者预后差、生存时间较短。微波消融以其热效率高、损伤小成为胰腺癌肝转移的可能治疗手段。本研究通过评价超声引导下微波消融治疗胰腺癌肝转移的疗效,筛选胰腺癌肝转移患者预后的独立影响因子,并绘制列线图预测患者生存情况,旨在筛选消融治疗受益人群。
对于晚期胰腺癌患者,全身化疗仍是主要的治疗方式。研究[9]表明吉西他滨联合紫杉醇化疗可将患者的中位生存时间延长至8.5 个月。既往文献[10-12]也报道肝脏寡转移的胰腺癌(转移灶局限于肝脏且数量<5个,CA199<1000 U/ml)可在局部治疗中获益。Park等[13]提出的射频消融治疗标准要求肝转移灶最大径≤3 cm,数量≤5 个且无肝外转移灶。研究[14]显示肝脏寡转移的胰腺癌患者射频消融治疗后中位生存时间为10.8个月,较单纯化疗患者(5.8个月)明显延长。然而在临床工作中,胰腺癌患者以全身多发转移为主,肝脏转移灶数量多且大小不一,多数患者发现时已失去手术治疗机会。本研究结果显示,超声引导下微波消融对病灶最大径>5 cm 或数量≥3 个的胰腺癌肝转移患者仍有较好的治疗效果,且全部患者的中位生存时间[12(6,14)个月]与既往研究[10]结果相当。分析原因可能为微波消融具有热场效率高、热传导快、治疗面积覆盖广的特点,保证了热消融可以达到局部根治的效果。因此,对于胰腺癌肝转移患者,单纯以病灶大小或数量纳入分析并不能充分地体现出肿瘤负荷对其预后的影响,故寡转移的标准并不能筛选出微波消融治疗的真正受益人群。本研究采用的病灶综合大小(病灶数量与最大径的乘积)同时考虑了转移灶数量和大小,可更准确地反映肿瘤负荷的大小,从而精准筛选出微波消融治疗的受益人群。
既往研究[8,14-16]报道CA199、中性粒细胞与淋巴细胞比值及病灶大小均为胰腺癌肝转移预后不良的独立预测因子。研究[17]发现当CA125<62 U/ml时可以进行局部手术治疗,但CA125≥62 U/ml 时接受手术治疗的预后不会明显改善,分析这是由于CA125 可以反映肿瘤负荷的大小所致,但这一结果在其他消融相关研究中并未得到证实。本研究单因素及多因素Cox回归分析显示,CA125、病灶综合大小均为胰腺癌肝转移患者预后的独立影响因子(均P<0.05),但CA199 并未纳入最终结果,分析可能为本研究样本量较小所致。既往文献[8,15]报道CA199 可作为判断手术可行性、预测肿瘤预后的重要因素,故本研究分别建立基于CA125、病灶综合大小和基于CA199、CA125、病灶综合大小的联合预测模型,结果显示三项联合预测模型的一致性指数高于两项联合预测模型,其预测效能更高。本研究进一步验证了三项联合预测模型的效能,结果显示该模型具有良好的区分能力和校准度,且可以很好地预测胰腺癌肝转移患者术后半年及1 年生存率,获得临床收益。此外,生存曲线分析显示高危组与低危组患者中位生存时间比较,差异有统计学意义(P=0.046),提示胰腺癌肝转移高危患者进行微波消融治疗后死亡风险是低危患者的9.03 倍,可为临床决策患者是否进行微波消融治疗提供参考信息。
综上所述,超声引导下微波消融治疗胰腺癌肝转移安全、有效,联合实验室指标和病灶综合大小能够准确预测胰腺癌肝转移患者术后半年和1 年生存率,为临床决策提供依据;胰腺癌肝转移低危患者接受超声引导下微波消融治疗后生存时间明显延长,可以获得较好的临床收益。但本研究为回顾性、单中心研究,且样本量较小,有待今后行大样本、多中心研究进一步验证。
