经腹联合经会阴超声在克罗恩病管理中的临床价值
2024-05-11柳建华
席 芬 柳建华
克罗恩病(Crohn’s disease,CD)是一种胃肠道慢性非特异性肉芽肿性炎症,好发于回肠末段和盲肠,在我国的发病率逐年上升[1]。该病目前无法治愈,活动期与缓解期交替反复发作,终生影响患者的生活质量,若患者未得到最佳治疗,还可能导致严重的并发症(如肠道狭窄、肠瘘等)。内镜检查是诊断CD 的金标准,但其为侵入性检查,且不能观察全肠壁及肠外病变。超声检查无创、无辐射、可重复、价廉,在CD病情管理中有无可比拟的优势[2]。本研究旨在探讨经腹联合经会阴超声检查在克罗恩病管理中的临床应用价值。
资料与方法
一、研究对象
选取2015 年1 月至2023 年6 月于我院就诊的CD患者87 例,男58 例,女29 例,年龄14~67 岁,平均(32.6±13.8)岁。纳入标准:均于1个月内接受肠镜、超声及实验室检查。排除标准:①超声与肠镜检查间隔时间>1 个月;②超声与肠镜检查期间曾行类固醇、甲氨蝶呤等药物治疗;③超声或肠镜检查资料不全,如超声图像质量欠佳、因肠段狭窄肠镜无法到达末段回肠或部分肠段已切除;④病变仅发生于肛周、直肠。本研究经我院医学伦理委员会批准(批准号:B-2023-002-01),入选者均知情同意。
二、仪器与方法
1.超声检查:使用法国声科Aixplorer 彩色多普勒超声诊断仪,XC6-1凸阵探头,频率1~6 MHz;SL10-2线阵探头,频率4~15 MHz。患者检查前禁食禁水8 h,排气排便后,首先取仰卧位行经腹超声检查,使用凸阵探头进行整体扫查,从右髂窝处开始,沿肠管走行扫查全段结肠、小肠,然后使用线阵探头以相同顺序再次扫查各段肠管。嘱患者取截石位行经会阴超声检查,使用凸阵探头观察肛周及直肠情况。主要观察指标包括:肠壁厚度(浆膜层、肌层、黏膜下层、黏膜肌层、黏膜层共5 层结构的厚度)、肠壁结构、肠壁血流分布及肠外并发症发生情况[3]。应用剪切波弹性成像(shear wave elastography,SWE)检测肠壁杨氏模量平均值。以上操作均由同一具有10 年以上工作经验的超声医师完成,所有参数均重复测量3 次取平均值。
2.评价标准及分组:参考文献[4],本研究将肠壁厚度≥0.3 cm定义为增厚,并根据超声所测肠壁厚度将纳入患者分为5组,即<0.3 cm组、0.3~0.5 cm组、≥0.5~0.7 cm 组、≥0.7~0.9 cm 组、≥0.9 cm 组。肠壁血流分级采用Limberg 分级[5],具体为:①0 级,肠壁无增厚且未见明显血流信号;②Ⅰ级,增厚肠壁未见血流信号;③Ⅱ级,增厚肠壁仅见稀疏较短血流信号;④Ⅲ级,增厚肠壁可见长条状血流信号;⑤Ⅳ级,增厚肠壁可见长条状血流信号,与肠系膜相连。见图1。肠外并发症包括:肠系膜脂肪增厚、淋巴结增大、腹腔积液、肛周脓肿或肛裂等。
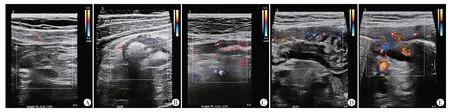
图1 肠壁血流Limberg分级示意图
3.肠镜检查:于无痛麻醉下行全肠道内镜检查,使用Olympus 260 电子胃肠镜观察末段回肠及全段结肠。根据简化克罗恩病内镜评分(simple endoscopic score for Crohn’s disease,SES-CD)分别对末段回肠、右半结肠、横结肠、左半结肠、乙状结肠进行评分[6],包括病变肠段累及范围、溃疡大小及肠道狭窄情况,每项0~3分,总分0~9分。其中总分0~2分为缓解期,3~6分为轻度活动期,≥7 分且肠壁无溃疡或溃疡直径<5 mm为中度活动期,≥7 分且肠壁溃疡直径≥5 mm 为重度活动期。由两名熟练掌握该评分系统的消化内科医师根据肠镜检查结果独立评分,结果不一致时协商统一。
4.实验室检查:通过胶乳免疫比浊法检测患者血清超敏C反应蛋白(hs-CRP)。
三、统计学处理
应用SPSS 22.0统计软件,计量资料以x±s表示,计数资料以频数或率表示。各超声参数与肠镜检查结果、血清hs-CRP的相关性分析采用Pearson相关分析法,r<0.2为极弱相关或无相关,0.2≤r<0.4 为弱相关,0.4≤r<0.6为中度相关,0.6≤r<0.8 为高度相关,0.8≤r<1 为显著相关。P<0.05为差异有统计学意义。
结果
本研究87 例CD 患者中,同时进行超声及肠镜检查的肠段共435个,包括末段回肠、右半结肠、横结肠、左半结肠、乙状结肠各87个。
一、肠镜检查结果
肠镜检查显示,435 个肠段中,缓解期肠段326 个(74.9%),活动期肠段109 个(25.1%)。其中末段回肠受累最严重,59.8%处于活动期,轻度活动期占73.1%,中重度活动期占26.9%;其次为右半结肠,10.3%处于活动期;乙状结肠受累者仅3.5%处于活动期。见表1。
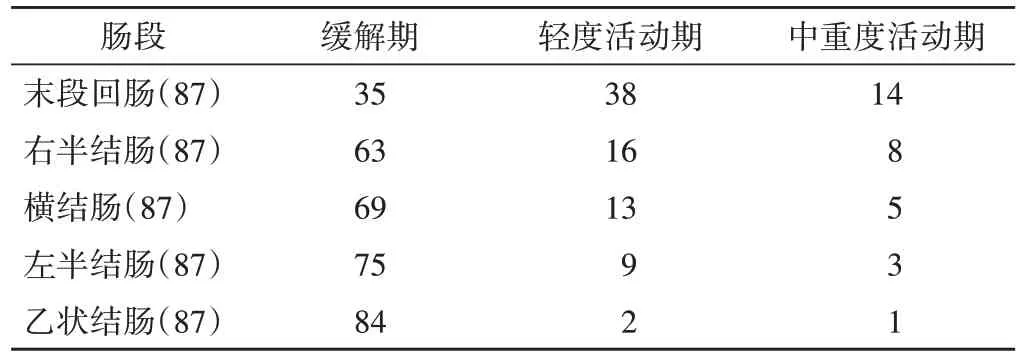
表1 435个肠段SES-CD分期情况 个
二、经腹联合经会阴超声检查结果
1.肠壁厚度:超声测得肠壁厚度为0.2~1.4 cm,末段回肠及右半结肠平均肠壁厚度分别为(0.484±0.179)cm、(0.357±0.248)cm。共187 个肠段出现不同程度肠壁增厚,部分肠段伴正常肠壁层次结构模糊或消失、肠管僵硬、肠蠕动减弱等,以末段回肠肠壁增厚最多见(40.2%),其次为右半结肠(17.2%)。
2.Limberg 血流分级:435 个肠段中,末段回肠64.4%(56/87)出现肠壁血流增多,以Ⅱ级最多见(47.1%)。右半结肠Limberg 血流分级为0、Ⅰ、Ⅱ、Ⅲ、Ⅳ级分别有55、5、17、7、3 个肠段。余横结肠、左半结肠及乙状结肠Limberg 血流分级均较低,Ⅱ、Ⅲ、Ⅳ级分别有19、16、11个肠段。
3.肠外并发症发生情况:87 例CD 患者中,淋巴结可见或增大42 例,检出率48.3%;腹腔积液9 例,检出率10.3%;肛周脓肿及肛裂12 例,检出率13.8%;肠系膜脂肪增厚7例,检出率8.0%。
4.共96 个肠段进行SWE 检查,肠壁杨氏模量平均值为0.8~77.1 kPa,这些增厚肠段中82.3%位于末段回肠及右半结肠。见图2。
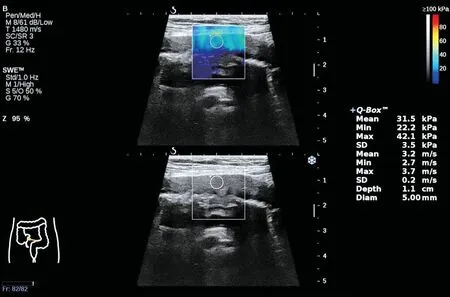
图2 SWE图示末段回肠感兴趣区内肠壁杨氏模量平均值为31.5 kPa
三、肠壁厚度、Limberg 血流分级与SES-CD 分期的关系
1.不同肠壁厚度肠段的SES-CD 分期情况见表2。相关分析显示,肠壁厚度与SES-CD 分期呈高度正相关(r=0.796,P<0.001)。当肠壁厚度≥0.5 cm 时,71%的肠段为活动期。

表2 不同肠壁厚度肠段的SES-CD分期情况 个
2.不同Limberg血流分级肠段的SES-CD分期情况见表3。相关性分析显示,Limberg血流分级与SES-CD分期呈高度正相关(r=0.742,P<0.001)。即Limberg 血流分级越高,SES-CD 分期越严重,当血流分级为0 级时,96.9%的肠段为缓解期;当血流分级为Ⅳ级时,所有肠段均为活动期。
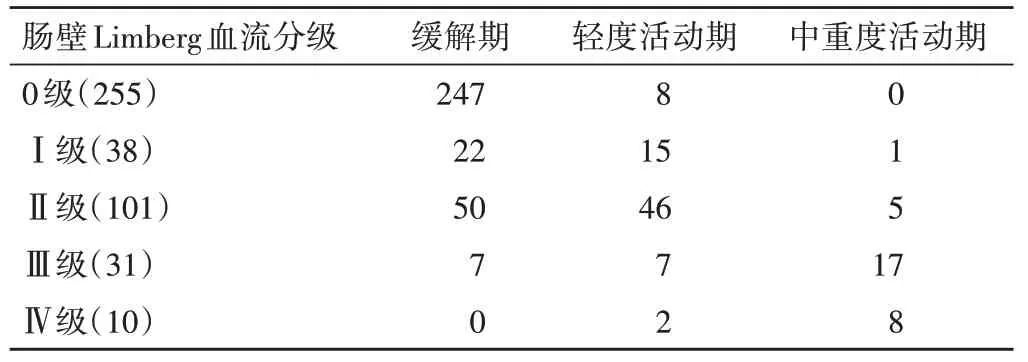
表3 不同Limberg血流分级肠段的SES-CD分期情况 个
四、末段回肠肠壁厚度、Limberg 血流分级与血清hs-CRP的关系
由于本研究纳入的CD 患者最常累及末段回肠,故对超声检查前后1 个月内进行血清hs-CRP 检测的54 例患者进行进一步分析。相关性分析显示,末段回肠肠壁厚度与血清hs-CRP 呈中度正相关(r=0.496,P<0.001),Limberg 血流分级与血清hs-CRP 呈弱正相关(r=0.399,P=0.004)。
五、各肠段肠壁杨氏模量平均值与SES-CD 评分的关系
相关性分析显示,各肠段肠壁杨氏模量平均值与SES-CD评分无相关性(r=0.013,P=0.253)。
六、CD病理检查情况
本研究中共141 个肠段进行病理检查,结果提示其黏膜病理组织学表现缺乏特异性,常见表现有淋巴细胞和浆细胞浸润、隐窝变形或破坏、裂隙状溃疡、炎性肉芽肿及纤维化等。共检出53 个肠段有肉芽肿表现,检出率为37.6%。
讨 论
CD是一种慢性肉芽肿性炎症,可发生于胃肠道各部位,炎症可累及肠壁各层,可形成瘘管、发生肠腔狭窄等,该病目前尚无法治愈,病情反复发作,需要长期随访并及时调整治疗方案,故选择合适的检查手段评估CD 的病情分期具有重要的意义。肠镜是诊断CD及评估病情的金标准,但其为侵入性检查,操作繁琐,有出血、肠穿孔的风险。受限于肠道炎症或肠腔狭窄等因素,部分患者尤其是术后患者往往不能耐受或不适用肠镜检查,或检查时不一定能到达病变最常累及部位,且CD 为进行性、破坏性的肠壁透壁性疾病,肠镜无法评估全肠壁及肠外病变。CT、MRI 因具有辐射或价格昂贵,不适合长期临床随访及较长时间的动态观察。超声具有无创、安全、价廉、操作简便、可重复性好的优势,在评价CD 的进展方面应用广泛,其不仅可以观察全部肠段的肠壁结构,还可以显示肠间隙,以及肠镜不能到达的空回肠部位[7]。研究[8]显示经腹超声诊断小肠CD 患者的灵敏度和特异度分别达86%~97%、83%~97%,与CT、MRI 诊断价值基本相当,同时在术后评估、分辨狭窄性质、诊断并发症方面均更具优势。本研究应用经腹联合经会阴超声评估CD 患者肠道病变及肠外并发症,旨在探讨其在CD 管理中的临床应用价值。
CD患者由于炎症和水肿,肠壁常呈节段性不规则增厚,高频线阵探头分辨率高,可清晰观察肠壁结构并测量肠壁厚度,不受患者病情或仪器性能等影响,可重复性好[9]。研究[4]发现当肠壁厚度的截断值为0.3 cm 时,其诊断灵敏度较高,而截断值为0.4 cm 时具有更高的特异度。Maaser 等[10]研究报道炎性肠病溃疡性结肠炎的肠壁厚度与炎症程度相关,治疗12周后肠壁厚度正常化程度与临床症状高度相关(90.5%肠壁厚度恢复正常患者伴有临床症状好转,9.5%无效,P<0.001),认为单独监测肠壁厚度有可能预测治疗反应。本研究将同时进行超声及肠镜检查的CD 患者作为研究对象,结果显示肠壁厚度与SES-CD 评分呈高度正相关(r=0.796,P<0.001),当肠壁厚度≥0.5 cm 时,71%的肠段为活动期,提示超声所测肠壁厚度可作为评估CD疾病活动度的可靠指标[11]。
超声显示CD 活动期还表现为肠壁内血流信号增多及动脉血管阻力指数减低,在炎症背景下,肠壁内外血流量均可增加,且炎症情况越严重,血管化程度越高,应用彩色多普勒超声观察肠壁血流情况有助于评估CD 肠道炎症。本研究结果显示,Limberg 血流分级与SES-CD 分期呈高度正相关(r=0.742,P<0.001),92.6%的活动期肠段Limberg 血流分级≥Ⅰ级,而缓解期该比例仅24.2%,75.8%的缓解期肠段Limberg 血流分级为0 级。表明活动期肠段的Limberg 血流分级较缓解期更高,提示应用Limberg 血流分级可对不同SES-CD 分期的肠道血管化程度进行评估,从而判断炎症程度。此外,hs-CRP 作为一种经典的炎性指标,也可反映肠道黏膜损伤情况[12],但其易受全身因素影响而准确率较低。本研究中末段回肠肠壁厚度与血清hs-CRP 呈中度正相关(r=0.496,P<0.001),Limberg血流分级与血清hs-CRP呈弱正相关(r=0.399,P=0.004),提示肠壁厚度、Limberg 血流分级与血清hs-CRP 在评估CD 疾病活动度方面有一定的协同性,与既往研究[13]结果基本一致。
CD可导致肠腔狭窄,患者需根据其纤维化程度选择不同的治疗方式。炎性为主的肠腔狭窄多采用内科药物保守治疗,而纤维性为主的肠腔狭窄则需进行内镜下球囊扩张或外科手术切除治疗,因此准确评价肠腔狭窄及纤维化程度具有重要的意义。纤维化组织的硬度较炎症病灶更大,SWE 可通过量化肠壁组织的硬度鉴别纤维化与炎性肠壁。既往研究[14]认为SWE有助于鉴别炎症性狭窄与纤维性狭窄;Chen等[15]应用SWE 对CD 患者肠壁纤维化程度进行评估,发现严重纤维化的肠壁杨氏模量平均值[(23.0±6.3)kPa]明显高于中度和轻度纤维化的肠壁[(17.4±3.8)kPa、(14.4±2.1)kPa],差异均有统计学意义(均P<0.05)。本研究由于术后进行肠段病理组织学检查的标本少,仅分析了肠壁杨氏模量平均值与SES-CD 评分的关系,结果显示二者并无相关性,原因可能为SES-CD 评分与肠道炎症程度相关,而肠壁杨氏模量平均值与肠道纤维化程度相关,二者判断肠道结构的角度不同。
低频凸阵探头可以很好地显示肠外病变,本研究应用超声不仅可以观察肠黏膜的病变,还可以观察肠外和腹腔病变,对于临床诊断和制定治疗方案具有一定的指导意义。经会阴超声可以观察肛瘘瘘管的内口、外口、走行及其与括约肌的关系,对肛瘘的诊断也具有较高的临床应用价值。此外,超声还可以观察肠镜不能获得的肠壁分层结构,CD患者肠壁层状结构的消失也提示深层的纵向溃疡,但识别肠壁分层结构时易受仪器、操作者主观因素及患者身体状况等影响,故本研究并未对其进行分析。且本研究纳入样本量较小,男女性别比为2∶1,与大样本流行病学研究[1]中的男女性别比(1.5∶1)略有差异,有待今后扩大样本量进一步探讨。
综上所述,经腹联合经会阴超声可较准确地判断CD 疾病活动度、病变部位及肠外合并症发生情况,可作为CD 病情随访的常用手段,为临床医师提供有价值的信息。
