高频超声所测肝脾指数对非酒精性脂肪肝分级诊断的多中心研究
2024-05-11周洪雨邓家琦孟繁坤吴晓莉向虹瑾
祁 航 周洪雨 邓家琦 孟繁坤 吴晓莉 卢 强 向虹瑾 经 翔 罗 燕
非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)的发病率在全球范围内持续快速增长,已成为全球主要的慢性肝病之一[1],目前该病在我国需要住院治疗的病例总数已超过病毒性肝炎[2]。轻度脂肪肝常仅需观察或调整生活方式,中、重度脂肪肝可能伴随肝纤维化、肝硬化甚至肝癌等,并与其他高风险疾病如心血管疾病、糖尿病等密切相关。因此,早期诊断及分级对NAFLD 的临床干预及评估非常重要。目前诊断脂肪肝的“金标准”为肝脏穿刺活检[3],但其有创;CT 和MRI 虽在诊断脂肪肝方面较为准确,但难以普及及随访,临床应用均有局限。超声是目前应用最广泛的无创检查方法,但常规超声检查主观性较强,诊断NAFLD 分级的准确性尚未得到临床指南的推荐[4]。肝肾指数(hepatorenal index,HRI)为基于灰阶超声的半定量参数[5],可在一定程度上避免操作者主观性,但较难区分轻度与中度肝脏脂肪变性,且不适用于有肾脏疾病的患者;受控衰减系数[6]和声衰减成像[7]等在评估肝脏脂肪变性程度方面日益受到重视,但存在诊断阈值不明确、增加患者额外检查费用等不足。肝脾指数(hepatosplenic index,HSI)即肝脏与脾脏平均灰度值比值,本研究应用高频超声测量HSI,旨在探讨其在NAFLD 分级诊断中的临床价值。
资料与方法
一、研究对象
回顾性收集2020 年1 月至2021 年12 月我院、天津市第三中心医院、西南医科大学附属医院、首都医科大学附属北京佑安医院、攀枝花中心医院共233 例肝脏疾病患者,其中男113 例,女120 例,年龄18~87岁,平均(50.00±14.18)岁。纳入标准:①年龄≥18岁;②均完成肝脏及脾脏超声检查,有完整的检查资料;③无过量饮酒史[每日饮酒折合乙醇量<30 g(男)或<20 g(女)];④均经肝脏占位手术或穿刺活检病理证实,包括因肝脏占位手术获得占位周边肝实质脂肪肝病理分级结果、因不明原因脂肪肝合并或不合并肝功能异常接受肝脏穿刺活检获得脂肪肝病理分级结果;⑤超声检查与病理检查间隔时间<14 d。排除标准:①肝移植;②妊娠或哺乳期;③合并酒精性肝病、病毒性肝炎、药物性肝炎病史;④合并脾脏病变如脾静脉血栓、脾梗死或脾脏部分切除;⑤无法获得满意的肝脏及脾脏超声图像。本研究由四川大学华西医院生物医学研究伦理委员会、天津市第三中心医院机构审查委员会、西南医科大学附属医院机构审查委员会、首都医科大学附属北京佑安医院伦理委员会、攀枝花中心医院机构审查委员会批准,并已通过中国临床试验注册中心注册(注册号:ChiCTR2000029961),患者或其家属均签署知情同意书。
二、仪器与方法
1.超声检查:使用Philips EPIQ 7 彩色多普勒超声诊断仪,C5-1 探头,频率1~5 MHz;eL18-4 探头,频率4~18 MHz。检查前患者空腹8 h 以上,取仰卧位,上肢上举,充分暴露胸腹部,应用C5-1 探头扫查右侧肋间,观察肝脏形态、大小、实质回声、超声远场衰减等情况。然后切换为eL18-4探头,适当调整图像增益和时间增益补偿,深度调整为6 cm,嘱患者于平静呼吸下屏气2~3 s,选取肝脏实质回声均匀且无大血管的区域存图;然后于相同仪器及增益条件下,扫查患者左侧肋间并选取脾脏实质回声均匀的区域存图。以上操作由5 名具有5 年以上工作经验的超声医师严格按照多中心研究操作手册完成。
2.图像分析:应用Adobe Photoshop 2022 图像处理软件,打开患者肝脏和脾脏的超声图像,启动软件自带的灰度直方图功能。为避免包膜附近的伪像干扰及深面组织的衰减影响,设定感兴趣区(ROI)分别位于肝脏和脾脏包膜下约0.5 cm 处,避开肝内血管及肋骨声影。设置取样框大小为60像素×60像素(图像大小为1024像素×768像素),避开血管或胆管,在肝脏、脾脏的超声图像中各取3个ROI,记录每个ROI内的灰度值计算平均值,肝脏与脾脏平均灰度值比值即为HSI。以上操作均由3名熟练掌握图像处理软件的超声医师完成。
3.病理检查及分组:对肝组织切片和穿刺标本进行HE染色,获得脂肪肝病理分级[8]。具体为:①正常,<5%的肝细胞脂肪变性;②轻度,5%~33%的肝细胞脂肪变性;③中度,>33%~66%的肝细胞脂肪变性;④重度,>66%的肝细胞脂肪变性。本研究根据病理结果将233 例患者分为正常者27 例(正常组)、轻度脂肪肝者77 例(轻度组)、中度脂肪肝者83 例(中度组)、重度脂肪肝者46例(重度组)。
4.临床资料收集:通过查阅病历,记录患者的一般情况,包括性别、年龄、体质量指数(BMI),收集病理检查前15 d 内的实验室检查结果,包括天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、γ-谷氨酰转移酶(GGT)、碱性磷酸酶(ALP)、总胆红素(STB)、直接胆红素(DBil)、白蛋白(ALB)、球蛋白(GLB)、总胆固醇(TC)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、甘油三酯(TG)、空腹血糖(FBG)等。
三、统计学处理
应用SPSS 26.0统计软件,计量资料以x±s表示,多组比较采用单因素方差分析,两两比较采用LSD-t检验;计数资料以例表示,采用χ2检验。采用多元线性回归分析HSI与各临床资料及肝脏脂肪变性程度的相关性。绘制受试者工作特征(ROC)曲线分析HSI对不同程度肝脏脂肪变性的诊断效能。P<0.05 为差异有统计学意义。
结果
一、各组临床资料比较
各组年龄、AST、ALB、TC、LDL、TG比较,差异均有统计学意义(均P<0.05)。重度组与正常组、轻度组、中度组年龄比较,正常组、轻度组与中度组、重度组ALB 比较,中度组、重度组与正常组AST 比较,重度组与中度组、中度组与轻度组TC、LDL、TG 比较,中度组与正常组TC 比较,差异均有统计学意义(均P<0.05);性别比、ALP、STB、DBil、GLB、HDL 各组两两比较差异均无统计学意义。见表1。
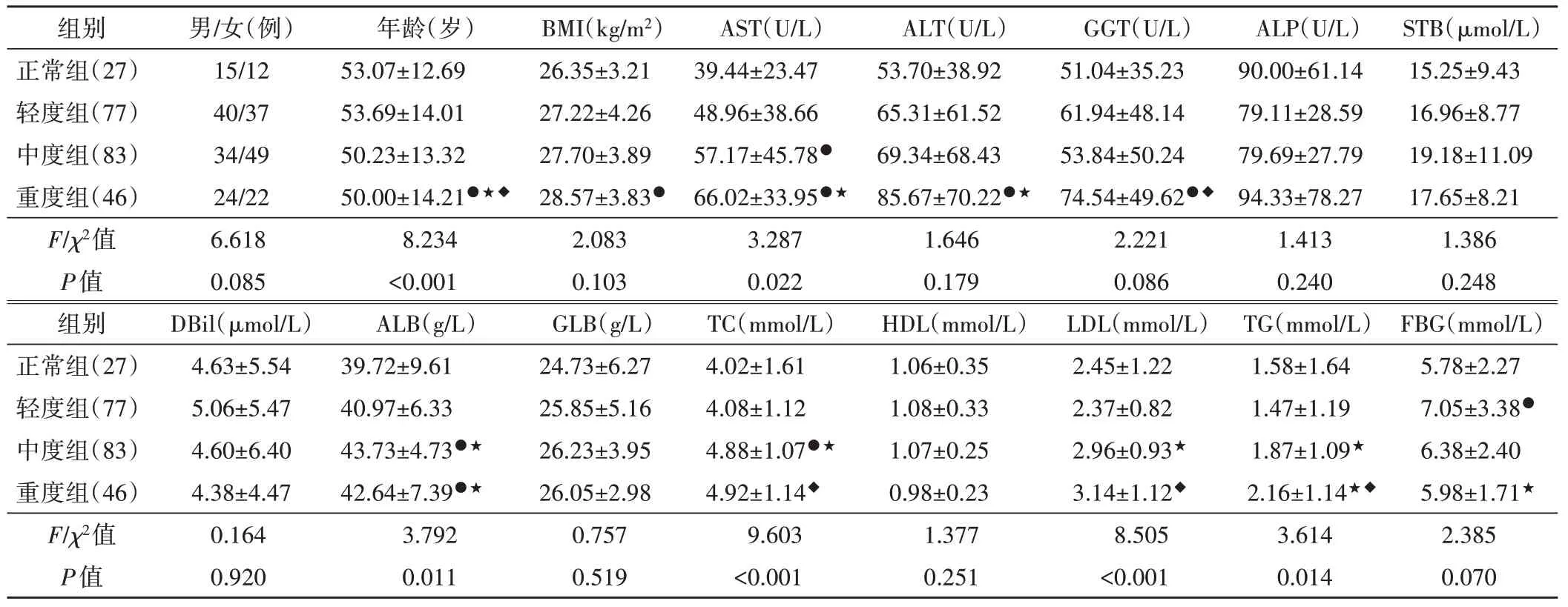
表1 各组临床资料比较
二、各组HSI比较
正常组、轻度组、中度组、重度组HSI分别为1.04±0.09、1.11±0.14、1.22±0.13、1.33±0.17,其中重度组HSI最高,中度组、轻度组次之,正常组最低,各组两两比较差异均有统计学意义(均P<0.05)。各组肝、脾超声图及病理图见图1~4。

图1 正常组患者(男,51岁)肝、脾超声图及肝组织病理图
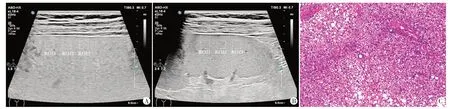
图2 轻度组患者(男,78岁)肝、脾超声图及肝组织病理图
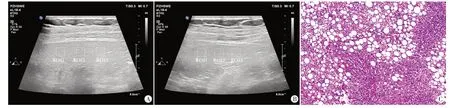
图3 中度组患者(女,74岁)肝、脾超声图及肝组织病理图
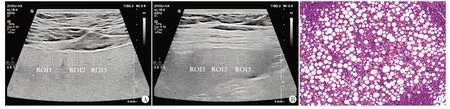
图4 重度组患者(女,32岁)肝、脾超声图及肝组织病理图
三、多元线性回归分析结果
以HSI 为因变量,年龄、AST、ALB、TC、LDL、TG 及脂肪变性程度为自变量,进行多元线性回归分析,结果显示,HSI 与脂肪变性程度呈线性正相关(β=0.115,P<0.001);与年龄呈弱相关(β=0.001,P<0.05);与其他指标均无相关性。见表2。

表2 多元线性回归分析结果
四、ROC曲线分析结果
ROC 曲线分析显示,HSI诊断有无肝脏脂肪变性、中度及以上肝脏脂肪变性、重度肝脏脂肪变性的曲线下面积(AUC)分别为0.84(95% 可信区间:0.76~0.91)、0.86(95%可信区间:0.81~0.91)、0.80(95%可信区间:0.72~0.88),截断值分别为1.13、1.16、1.24,灵敏度和特异度分别为60.2%、82.0%、78.3%和92.3%、92.4%、86.6%。见图5。
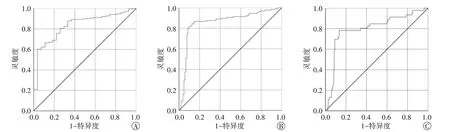
图5 HSI诊断有无肝脏脂肪变性(A)、中度及以上肝脏脂肪变性(B)、重度肝脏脂肪变性(C)的ROC曲线图
讨 论
由于NAFLD 的高发病率,基于超声进行NAFLD分级诊断一直是临床研究的热点。灰阶超声是目前常用的脂肪肝筛查和诊断的方法,其典型超声表现为肝脏实质回声增强、细腻,伴后方回声衰减[4]。研究[9]表明超声在诊断中至重度肝脏脂肪变性方面具有较高的灵敏度和特异度(分别为84.8%和93.6%),但其在识别轻度肝脏脂肪变性方面存在一定的争议和困难,总体灵敏度和特异度均较低(分别为65%和81%)[10],且易受操作者主观影响,不同患者及设备等因素也可导致研究结果在观察者间存在较大差异。HRI是基于灰阶超声半定量评估肝脏脂肪变性程度的参数,即在同一切面上获得肝脏和右肾皮质的平均灰度值,二者比值即为HRI,不但获取简单,且与肝脏脂肪变性程度有较好的相关性,但考虑到HRI 以肾脏为参照,而人群中慢性肾脏病的患病率较高(2019 年我国慢性肾脏病患病率约10.58%)[11],可能影响对肝脏脂肪变性程度的诊断准确性。目前临床常用的诊断脂肪肝的CT参数为肝脏与脾脏CT 值比值,其值≥0.7~1.0 为轻度,0.5~0.7 为中度,≤0.5 为重度[12]。该方法基于脾脏相对于不同程度脂肪肝在CT图像上密度稳定的假设,以脾脏为参照,通过比较肝脏密度的变化准确反映肝脏脂肪变性程度。由于肝脏的超声成像受腹壁厚度的影响[13],受该方法的启发,本研究推测以脾脏为参照,通过计算肝脏与脾脏平均灰度值的比值(即HSI)将可能减少甚至消除腹壁厚度的影响,并克服不同超声设备成像的差异,从而更准确地评估肝脏脂肪变性程度。此外,高频超声具有更高的细节分辨能力,目前临床常用的主流超声诊断仪的高频超声频带较宽,具有一定的穿透能力[14],能够获得肝、脾包膜下一定深度内的超声图像及信息。基于此,本研究提出应用高频超声测量HSI,并探讨其在NAFLD 分级诊断中的可行性及临床价值。
由于目前超声检查肝脏多采用低频超声探头,且未常规采集脾脏高频超声图像,导致本研究前期收集病例时有15例患者被排除,但实际工作中应用高频超声成功获取肝脏及脾脏图像的成功率均较高,对于少数脾脏超声图像不满意者,可以通过改变患者体位及呼气配合等方式完成检查。此外,测量HSI的主要目的为消除不同患者腹壁厚度对结果的影响,故建议将探头置于左、右上腹的相应或相似位置采集肝脏及脾脏超声图像。而在实际工作中,肝脏超声图像常于右上腹前壁锁骨中线附近获取,脾脏超声图像常于左上腹腋中线附近获取,两处腹壁厚度可能存在少许差异,本研究采用归一化的方法获取HSI,加之借鉴CT 常通过测量肝脏与脾脏CT值比值以诊断和分级脂肪肝,初步认为锁骨中线和腋中线处腹壁厚度的差异对本研究结果的影响有限,有待今后寻求更客观的验证。
脂代谢指标如TG、TC 等均为评价NAFLD 疾病进展的常用指标,可较好地反映其严重程度,而HSI亦可反映肝脏脂肪变性程度。本研究结果显示,各组年龄、AST、ALB、TC、LDL、TG比较,差异均有统计学意义(均P<0.05),与胡灵溪等[15]研究结果相似,为进一步探索脂肪肝的发病机制和治疗提供了重要线索。本研究正常组、轻度组、中度组、重度组HSI分别为1.04±0.09、1.11±0.14、1.22±0.13、1.33±0.17,各组两两比较差异均有统计学意义(均P<0.05);且HSI 与脂肪变性程度呈线性正相关(β=0.115,t=22.824,P<0.001),表明随着肝脏脂肪变性程度的加重,HSI逐渐增高,与其他基于超声参数评估肝脏脂肪变性程度的研究[6]结果相似。
Zhu 等[16]应用综合多个实验室指标的脂肪肝指数模型诊断脂肪肝的灵敏度为44.3%,特异度为94.0%,但研究[17]指出该模型在区分轻度与中、重度脂肪肝方面效能欠佳。本研究ROC 曲线分析显示,HSI 诊断有无肝脏脂肪变性、中度及以上肝脏脂肪变性、重度肝脏脂肪变性的AUC 分别为0.84、0.86、0.80,均高于张记等[18]采用受控衰减系数诊断轻、中、重度NAFLD 的AUC(0.55、0.68、0.73)。进一步分析显示,HSI 诊断中度及以上肝脏脂肪变性的灵敏度、特异度分别为82.0%、92.4%,诊断重度肝脏脂肪变性的灵敏度、特异度分别为78.3%、86.6%,与既往研究[5]应用HRI 诊断中度及以上、重度肝脏脂肪变性的效能相似(灵敏度和特异度分别为90%、90%和90%、93%)。尽管HSI和HRI 的参照测量对象不同,但二者均通过比较肝脏与参照脏器的灰度值来间接反映肝脏脂肪变性程度,当参照脏器无基础病变时,二者诊断效能相似。Tran等[19]研究显示HRI 诊断有无肝脏脂肪变性的灵敏度、特异度分别为50.0%、91.7%,本研究中HSI 诊断有无肝脏脂肪变性的效能略高,灵敏度、特异度分别为60.2%、92.3%。分析可能与本研究采用的高频探头能获取更多肝脏脂肪变性时的细节信息有关,也可能与研究纳入的受试者不同、超声设备不同等有关。
本研究的局限性:①未评估NAFLD 是否受气球样变、小叶炎症、纤维化的影响;②纳入研究对象的病因多样,不同疾病的病理生理学改变及病程发展可能存在差异,可能影响结果;③虽然本研究为多中心研究,但采用的超声设备单一,可能对结果的泛化有一定影响。今后需扩大样本量以验证HSI诊断有无肝脏脂肪变性及鉴别不同程度肝脏脂肪变性的诊断效能,并比较HSI与HRI评估同一组病例肝脏脂肪变性程度的效能。
综上所述,高频超声所测HSI 在评估肝脏脂肪变性程度方面具有无创、简便的优势,在NAFLD 分级诊断中有重要的临床价值。
