绝经后子宫内膜癌患者MMR 蛋白表达缺失的影响因素分析
2024-05-11张静娟冯文张林娜
张静娟 冯文 张林娜
作为妇科中最常见的恶性肿瘤之一, 子宫内膜癌(endometrial carcinoma, EC)发病率比2008 年增长了21%, 大约37 个女性中就会有1 个患有子宫内膜癌[1]。到2022 年, 中国新发病例数预计达到84520 例[2]。子宫内膜癌的发病高危因素较多, 包括高龄、肥胖、糖尿病、多囊卵巢综合征(PCOS)、林奇综合征(LS)等。绝经后妇女仍是子宫内膜癌发病的主要人群。错误配对修复(mismatch repair, MMR)系统是保护基因组完整性的一个主要途径。有研究发现[3], 错误配对修复蛋白缺陷(d-MMR)在不同类型肿瘤中出现的频率中子宫内膜癌出现频率高达31.4%, 其指出错误配对修复蛋白缺陷的检测可以用于筛选林奇综合征患者。由于在子宫内膜中, 细胞的DNA 复制频率比较高, 所以会导致碱基错配的几率提升。为了维持基因稳态, 错误配对修复基因发挥着重要作用, 能够识别并清除错配的碱基。然而, 当错误配对修复基因缺失时, 内膜细胞在复制过程中会出现广泛的微卫星不稳定性(microsatellite instability, MSI), 从而诱导子宫内膜癌的发生[4,5]。目前普遍认为[6]mutS 同源物2(MSH2)、mutS 同源物6(MSH6)、mutL 同源物1(MLH1)及PMS2 这四种错误配对修复蛋白在子宫内膜癌的发病机制中起到重要作用,其中一种或多种蛋白缺失即出现错误配对修复蛋白缺陷。较高的睾酮(testosterone, T)会增加女性患上2 型糖尿病及PCOS 的风险。大量研究表明, 高水平血清T与子宫内膜癌的发病风险显著相关, 且成为影响子宫内膜癌发生的独立影响因素。有研究指出, T 水平与子宫内膜癌的微卫星状态相关。研究发现[7,8]高度表达的(carcinoembryonic antigen, CEA)有利于子宫内膜癌的诊断且与子宫内膜癌病理类型相关。Luo 等[9]研究指出PMS2 错误配对修复蛋白缺陷与性别和血清CEA水平相关。但国内外关于血清T、CEA 与子宫内膜癌MSI/错误配对修复蛋白缺陷研究仍较罕见。本研究旨在通过检测血清CEA、T 水平, 评估错误配对修复蛋白表达缺失的可能性, 并推测绝经后子宫内膜癌患者的预后及优化治疗方法。
1 资料与方法
1.1 一般资料 选取2021 年11 月~2022 年10 月本院收治的绝经后子宫内膜癌手术患者62 例纳入研究,纳入标准:①在此期间接受过子宫内膜癌手术治疗,并经病理诊断确诊;②采用免疫组织化学(IHC)方法测定术后病理的错误配对修复蛋白表达;③术前未使用过激素类药物, 且未接受过放化疗治疗;④具有完整的临床病历资料。排除标准:①患者患有肾上腺疾病、心脏病等以及对内分泌功能有影响的疾病(如卵泡膜细胞瘤等);②存在其他影响血清CEA 及T 水平的因素;③临床资料不完整。以错误配对修复蛋白的表达为依据[术后, 2 位病理学主任医师分别对子宫内膜肿瘤组织切片进行IHC 分析, 并以光镜观察到双花扁豆凝集素(DAB)染色情况为依据, 判断MSH2、MSH6、MLH1和PMS2 四种错误配对修复蛋白的表达水平], 将1 种及以上错误配对修复蛋白表达缺失的22 例患者纳入MSI 组, 而4 种错误配对修复蛋白表达不缺失的40 例患者则纳入微卫星稳定型(microsatellite stability, MSS)组。
1.2 方法 统计两组患者的临床资料, 包括年龄、绝经年龄、BMI、子宫内膜厚度、孕次、CEA、T。取3~4 ml 患者在术前清晨的空腹静脉血标本, 存储于5 ml的EDTA-Na2抗凝试管中, 立即送检, 在4℃下离心分离血清, 采用DX1800 全自动微粒子化学发光分析仪进行测定血清CEA 和T 水平。
1.3 观察指标 比较两组临床资料, 采用Logistic 回归分析绝经后子宫内膜癌患者错误配对修复蛋白表达的影响因素, 并分析血清T、CEA 水平对绝经后子宫内膜癌患者错误配对修复蛋白表达缺失的预测价值。
1.4 统计学方法 运用SPSS25.0 软件对所得数据进行分析。计量资料以均数±标准差(±s)表示, 行t 检验;计数资料以率(%)表示, 行χ2检验;绝经后子宫内膜癌患者错误配对修复蛋白表达缺失的影响因素分析采用Logistic 回归分析;绘制ROC, 分析血清CEA、T 水平对绝经后子宫内膜癌患者错误配对修复蛋白表达缺失的预测价值, 以AUC 评价, AUC≤0.50提示无预测价值, 0.50<AUC≤0.70 提示预测价值较低,0.70<AUC≤0.85 提示预测价值中等, AUC>0.85 提示预测价值较高。取α=0.05 为检验水准, P<0.05 为差异有统计学意义。
2 结果
2.1 两组临床资料比较 两组的年龄、绝经年龄、子宫内膜厚度、孕次均无显著性差异(P>0.05)。与MSS组相比, MSI 组的血清CEA 和T 水平及BMI 均较高,差异显著(P<0.05)。见表1。
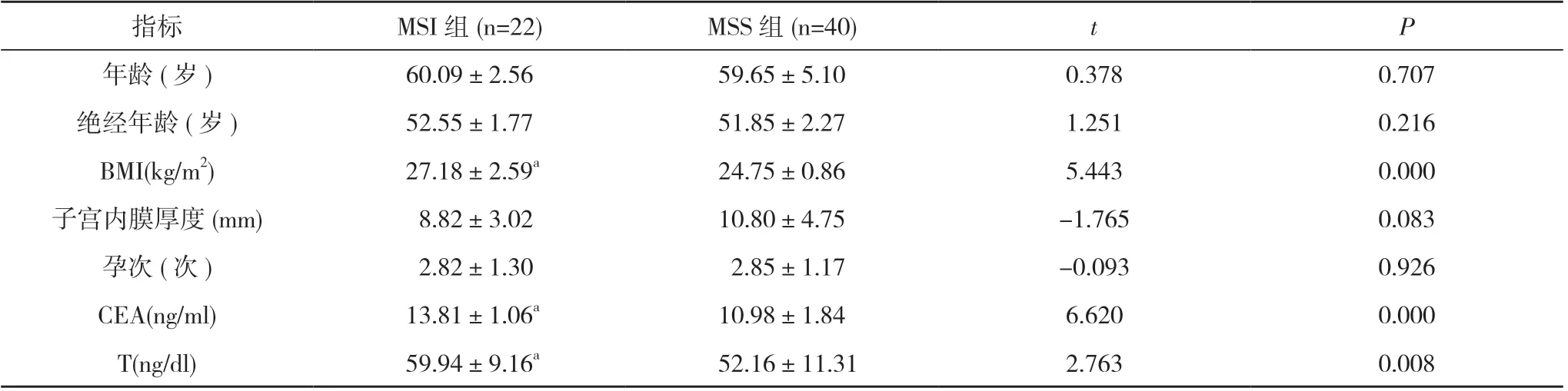
表1 两组临床资料比较( x-±s)
2.2 Logistic 回归分析 将绝经后子宫内膜癌患者血清CEA、T、BMI 水平分别作为协变量, 错误配对修复蛋白表达情况作为因变量(1=MSS, 0=MSI), 经Logistic回归分析结果显示, 血清CEA、T、BMI 水平升高是绝经后子宫内膜癌患者错误配对修复蛋白表达缺失的影响因素(P<0.05)。见表2。
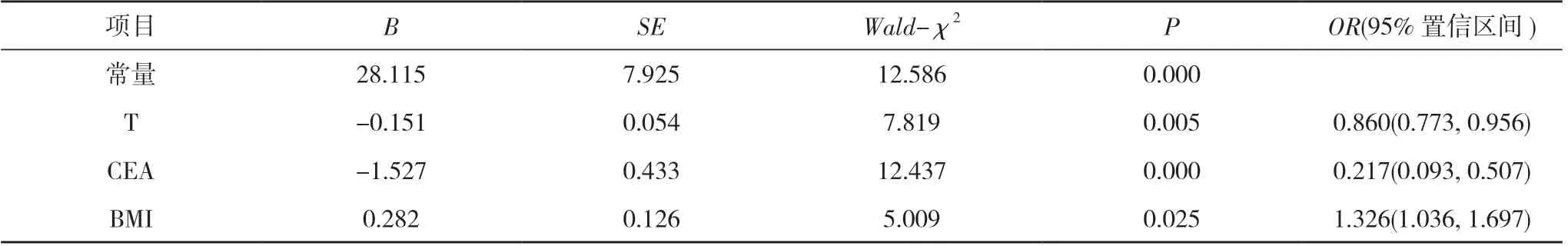
表2 Logistic 回归分析
2.3 血清T、CEA 水平对绝经后子宫内膜癌患者错误配对修复蛋白表达缺失的预测价值 将子宫内膜癌患者错误配对修复蛋白表达缺失作为状态变量, 血清T、CEA 水平作为检验变量, 绘制ROC 曲线, 结果示血清T、CEA 水平预测绝经后子宫内膜癌患者错误配对修复蛋白表达缺失的AUC 分别为0.750、0.893, 均具有预测价值。见图1。

图1 血清T、CEA 水平对绝经后子宫内膜癌患者错误配对修复蛋白表达缺失的预测价值
3 讨论
子宫内膜癌是女性生殖系统三大恶性肿瘤之一,其发病率正逐年上升。由于其早期临床症状隐匿, 患者多在出现异常的阴道出血时才被发现[10]。近年来,对子宫内膜癌中微卫星状态的研究逐渐增多。子宫内膜癌分子检测中国专家共识(2021 年版)、国际妇科病理学家协会以及曼彻斯特国际共识组[11]均推荐采用错误配对修复/MSI 检测对新发子宫内膜癌患者进行分析, 以明确错误配对修复/MSI 检测是否可用于林奇综合征的早期筛查, 并预估免疫检查点抑制剂的使用价值。但是, 分子生物学检测耗时长、费用高, 目前临床上多采用免疫组织化学检测的方法。多种血清学指标可用于疾病的检测, 且多种分子指标联合检测可提高对于早期小肿瘤的检测敏感度及特异度[12]。因此, 研究血清T 和CEA 水平对绝经后子宫内膜癌患者错误配对修复蛋白表达缺失的影响, 或许有助于预测Lynch相关子宫内膜癌高危患者及绝经后子宫内膜癌患者的预后及优化治疗方法。
既往研究显示, 绝经年龄较晚可能是子宫内膜癌发病的高危因素。52 岁后绝经的妇女患上子宫内膜癌的风险是49 岁绝经妇女的2.4 倍[10]。范晓慧等[13]研究显示子宫内膜癌患者年龄与错误配对修复蛋白缺失有关, 但患者呈现低龄化趋势。而Dashti 等[14]的研究显示绝经年龄与Lynch 相关的子宫内膜癌之间没有明显关联。为了进一步探究这一问题, 本研究比较了错误配对修复蛋白表达缺失和错误配对修复蛋白表达正常患者的年龄、绝经年龄、BMI、子宫内膜厚度和孕次等方面的差异。结果发现, 在绝经后患有子宫内膜癌的患者中, 两组的年龄、绝经年龄、子宫内膜厚度、孕次均无显著性差异(P>0.05)。与MSS 组相比,MSI 组的血清CEA 和T 水平及BMI 均较高, 差异显著(P<0.05)。
T 是一种雄性激素, 能够促进子宫内膜癌Ishikawa细胞增殖。本研究发现, 就绝经后子宫内膜癌患者的血清T 水平而言, MSI 组与MSS 组之间差异显著。与MSS 组相比, MSI 组血清T 水平较高(P<0.05)。此外,通过对ROC 曲线的分析可知, 对绝经后的子宫内膜癌患者来说, 错误配对修复蛋白表达缺失的情况可以通过血清T 水平来进行预测, 其AUC 为0.750, 具有一定的预测价值。一项研究还表明[15], 错误配对修复缺陷型前列腺癌对新型激素药物及标准雄激素阻断治疗均具有较强的敏感度。因此, 针对错误配对修复蛋白缺陷所致的子宫内膜癌, 联合应用芳香化酶抑制剂及雄激素阻断治疗有望获得较好的治疗效果, 具体还需要进一步实验研究予以证实。
CEA 是一种来源于胚胎组织的酸性糖蛋白, 是组织非特异性肿瘤标志物, 在恶性肿瘤细胞表面高度表达。有研究显示[8], CEA 在细胞粘附、抑制细胞凋亡等肿瘤的发生与发展阶段发挥了显著的促癌基因作用, 在免疫调节等与肿瘤相关因素中也起到了重要作用。CEA 的过表达可加速其与纤连蛋白的结合, 使肿瘤的侵袭能力大幅提升。最早的研究证实CEA 是结肠癌和直肠癌的特异性标志物, 后来的研究发现在子宫内膜癌患者中也呈现高表达[16]。在结肠癌中的研究表明, MSI 与血清CEA 水平升高之间存在显著相关性[17]。本研究同样发现, MSI 组血清CEA 水平高于MSS 组(P<0.05)。说明MSI 组的阳性状态与血清CEA 水平升高有关联性。绘制ROC 曲线结果显示, 血清CEA 水平可以预测绝经后子宫内膜癌患者多重重复不匹配蛋白错误配对修复表达缺失(AUC=0.893)。因此, 血清CEA水平升高在预测错误配对修复蛋白表达缺失方面具有一定的价值。
综上所述, 血清CEA 和T 水平与绝经后子宫内膜癌患者中错误配对修复蛋白的表达密切相关, CEA和T 水平高可能是导致患者错误配对修复蛋白缺失的重要影响因素。因此, 在临床实践中, 通过检测血清CEA 和T 水平, 可以评估是否存在错误配对修复蛋白缺失的可能性。这样的评估可以帮助监控Lynch 相关子宫内膜癌高危患者, 并协助治疗有错误配对修复蛋白缺陷的子宫内膜癌患者。
