表现为支气管内黑色素肿块的原发性肺恶性黑色素瘤1例
2024-05-10王建坤王汉生任涛刘岩周妍卉王梅芳
王建坤 王汉生 任涛 刘岩 周妍卉 王梅芳
恶性黑色素瘤(malignant melanoma,MM)是一种起源于黑色素细胞的恶性肿瘤,占所有恶性肿瘤的 1%~3%,通常起源于皮肤或粘膜。原发性肺恶性黑色素瘤(primary malignant melanoma of the lung, PMML)极为罕见,占所有肺部肿瘤的 0.01%[1]。在此,我们报告1例72 岁的女性PMML患者在支气管镜检查中发现支气管内色素肿块。术中行经支气管镜钳夹活检和EBUS-TBNA 检查时,快速现场评估(rapid on-site evaluation, ROSE)初步诊断为MM,后经组织病理学证实为PMML。
病例资料
患者,女性,72岁,因咳嗽、咳痰两周就诊于十堰市太和医院。患者否认既往有皮肤、 耳部或眼部黑色素痣病变史;同时否认家族恶性肿瘤病史及遗传病史。体格检查显示右上肺可闻及湿罗音;皮肤、眼睛、 肛周、外生殖器未见痣及色素沉着。实验室结果显示,患者CEA、 CYFRA、 NSE 和 SCC 水平分别为 1.79 μg/L(正常:0~5.0 μg/L)、 1.31 ng/mL(正常:0~3.3 ng/mL)、 10.8 ng/mL(正常:0~16.3 ng/mL)和 0.58 ng/mL (正常:0~2.7 ng/mL)。胸部X线示右肺上叶不规则肿块,边缘粗糙;胸部 CT 示右肺上叶一实性肿块,大小 2.1 cm× 3.9 cm× 3 cm;纵隔可见多处肿大淋巴结,短径 1.4 cm;此外,发现双侧胸腔积液,如(图1A)所示。
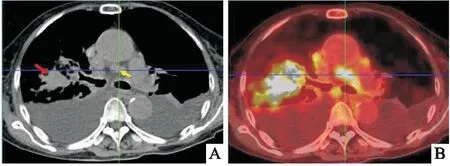
图1 胸部CT以及PET-CT图像 A:胸部CT显示右上肺叶肿块(红色箭头),伴纵隔淋巴结肿大(黄色箭头); B:PET-CT扫描显示肺肿块,18F-FDG最大标准化摄取值为24.7;纵隔淋巴结肿大,18F-FDG最大标准化摄取值为15.9
胸腔穿刺细胞学检查显示淋巴细胞和间皮细胞为主,未见恶性依据。纤维支气管镜检查示右主支气管内肿物(图2A),右上叶远端支气管局部黏膜粗糙、肥厚、呈灰黑色(图2B),经支气管镜钳夹活检肿块, ROSE 初步诊断为恶性黑色素瘤(图 3A、B)。

图2 纤维支气管镜镜下图像 A:支气管镜检查示右主支气管支气管内肿块;B:右上叶远端支气管局部黏膜粗糙、肥厚、呈灰黑色

图3 原发性肺恶性黑色素瘤的ROSE与组织病理特征 A、B:黑色素瘤细胞为浆细胞样,细胞核偏位,细胞质向细胞核一侧或另一侧移位,细胞核周围可见胞质,胞质内可见不透明的色素团块和颗粒(Diff-Quik染色, 放大倍数×100、×400);C、D:肿瘤细胞呈片状分布,浸润性生长,间质内伴少量炎性细胞。肿瘤细胞呈上皮样或组织细胞样改变,胞质丰富,细胞核圆形、卵圆形或不规则。部分细胞可见核仁或细胞内色素颗粒 (HE染色,放大倍数×200、×400)
根据ROSE的初步诊断,行经超声支气管镜引导下针吸活检(EBUS-TBNA, endobronchial ultra-sound-guided transbronchial needle aspiration) 进行肺恶性肿瘤分期。 组织病理学苏木精-伊红(H&E, Hematoxylin-Eosin )染色显示肿瘤细胞呈片状分布,浸润性生长,伴有间质内少量炎性细胞浸润;瘤细胞上皮样或组织细胞样改变,胞浆丰富、核圆形、卵圆形或者不规则形,部分细胞可见核仁,部分细胞的胞质内见色素颗粒(图 3C、D)。
免疫组织化学染色显示黑色素沉着以及恶性细胞中HMB-45、 Melan-A、 SOX-10、 S-100 和 Ki-67(20%+)呈阳性,而CKAE1/AE3、 CK5/6、TTF-1、CD-45和synaptophysin阴性(图4),免疫组织化学染色结果支持恶性黑色素瘤诊断。全身正电子发射断层扫描CT(PET-CT)显示右上肺肿块密度异常,伴氟代脱氧葡萄糖(18F-FDG)代谢升高,最大标准化摄取值(SUVmax)为 24.7,肺门/纵隔淋巴结18F-FDG代谢升高,SUVmax 值为15.9(图 1B)。

图4 免疫组织化学染色 A:恶性黑色素瘤细胞细胞质对HMB-45抗体强阳性反应,呈棕色颗粒(放大倍数×400);B:恶性黑色素瘤细胞细胞质中Melan-A蛋白阳性,呈棕黄色颗粒(放大倍数×400);C:恶性黑色素瘤细胞的细胞核和细胞质对S-100抗体均呈阳性,呈棕黄色颗粒(放大倍数×400);D:恶性黑色素瘤细胞核中SOX-10蛋白呈阳性,呈棕色颗粒(放大倍数×400)
考虑患者入院时已存在多发转移,无手术指征。
入院第10天于我院临床分子诊断中心对活检标本行恶性黑色素瘤相关遗传分子检测,包括NRAS、KIT 和 BRAF 基因。结果显示BRAF V600E突变。随后给予达拉非尼联合曲美替尼靶向药物治疗,具体用药如下:达拉非尼口服150mg,每日两次;曲美替尼口服2mg,每日1次。治疗2个月后,胸部增强CT扫描显示右肺恶性黑色素瘤肿块尺寸明显减小(图5 A、B)。患者已随访15个月,健康状况良好,无复发迹象。
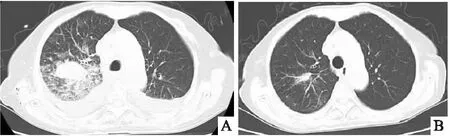
图5 治疗前后的胸部增强CT扫描结果 A:胸部增强CT扫描显示右上肺叶肿块;B:胸部CT增强扫描显示治疗后右上肺叶肿块几乎消失
讨 论
黑色素瘤通常发生在皮肤、粘膜和眼眶上,但很少发生在皮肤外。 在肺部 MM 的病例中,大多数情况是来自皮肤病变的转移性MM,而 PMML 极为罕见,仅占肺部肿瘤的 0.01%[1]。因此,在诊断肺部原发性黑色素瘤之前,我们必须证明在更常见的部位没有原发性病变[2]。本病例患者在详细体格检查及病史采集期间,在皮肤、粘膜、眼球、阴道未见明确的黑色素痣及色素沉积。然而PMML的发病机制尚不明确[3, 4],目前有 3 种假说: (1) 机体内存在的黑色素细胞在胚胎形成期向表皮或真皮层迁移的同时也可向机体内脏器官迁移,导致食管、 咽喉、脑、肺等处同样存在黑色素细胞,位于气管支气管、咽喉和食管残存的原始成黑色素细胞则均可以进一步分化为原发性肺恶性黑色素瘤。(2) 黏膜下支气管腺的黑色素细胞化生。(3) 起源于下呼吸道中的多潜能干细胞向黑色素细胞分化。
PMML发病率在性别上无显著差异,文献报道的平均诊断年龄为51岁(45~71岁)[1]。临床症状无特异性,以咳嗽、咳痰、胸痛等局部症状以及体重减轻、盗汗、发热等全身症状为特征。在本病例中,患者为老年女性、无明确家族史,因咳嗽两周而入院;患者胸部CT表现为右肺上叶不规则分叶状肿块,与肺癌影像难以区分。组织学上而言,肿瘤细胞部分呈腺泡状排列,部分呈团块状排列,细胞呈上皮样,异型性明显,胞质丰富,细胞核呈空泡状,常可见核仁。有丝分裂象常见,肿瘤细胞内常可见黑色素颗粒[1]。通常HMB45、S-100、vimentin、Melan-A免疫组化染色呈阳性。HMB45是恶性黑色素瘤的特异性抗原,HMB45阳性可以确定诊断[5, 6]。然而,一部分MM病例HMB45呈阴性,主要是在转移性情况下,并且该标记物并不完全特异性[7]。Melan-A和vimentin敏感度高,但特异性低于HMB45。到目前为止,这是唯一一个由ROSE实时诊断的病例。恶性黑色素瘤的细胞形态表现为高度多形性细胞的分散或固体聚集体,具有大核仁,通常含有黑色素[8];Ronchi等人指出,当出现在适当的形态学背景下,黑色素沉着是诊断MM的重要细胞形态学线索[9],本病例ROSE所呈现的黑色素瘤细胞形态符合以上特征。此外,组织病理学具有上皮样细胞形态的MM占所有病例的70%以上,其特征是细胞呈多边形形状,中等至丰富的颗粒状或透明的细胞质,细胞质边界不明显,轻度或中度深染的大细胞核具有颗粒状和团块的染色质[7, 10]。
Kamposioras 等人[3]的综述研究显示,约3.2% 恶性黑色素瘤在发生转移后未找到原发灶。因此,原发肺恶性黑色素瘤的诊断必须建立在临床、影像及病理综合考虑。根据Wilson等人提出的PMML的5项诊断标准[1]:孤立的肺肿块;免疫组织化学(S-100、HMB-45、Melan-A)和/或电子显微镜证实恶性黑色素瘤;无皮肤、粘膜或眼部黑色素瘤病史;黑色素瘤细胞侵袭支气管上皮;诊断期间未见其他肿瘤。以及Allen 和Jensen等人[5, 11]提出肺原发恶性黑色素瘤的诊断标准: 影像学提示单个肺实性结节或肿块; 典型的病理学改变,并经免疫组化( S-100、HMB-45、Melan-A) 或电镜证实存在肿瘤细胞内黑色素颗粒; 无皮肤、黏膜等处的黑色素瘤切除病史; 发病前无明显的黑色素痣; 支气管黏膜上皮下有散在或成巢的黑色素瘤细胞; 黑色素瘤细胞浸润的支气管黏膜无溃疡形成; 支气管黏膜下有明显的肿瘤细胞巢浸润。本病例符合上述学者所提出的诊断标准,因此建立了PMML的诊断。由于这种疾病的罕见性,它很容易被临床医生、放射科医生和病理学家所忽视。另外,显微镜下病理检查可能找不到细胞质中的黑色素颗粒,容易误诊为小细胞肺癌、低分化鳞状细胞癌或低分化腺癌。PMML需与肺恶性淋巴瘤、未分化癌、间质肉瘤、浆细胞肉瘤等鉴别。在临床实践中,对于一些疾病进展迅速且缺乏典型特征的患者,应常规进行免疫组化检测,以防止漏诊和误诊[10]。
PMML患者的最佳治疗方法仍有待确定。对于病变局限于肺的患者,肺叶切除术或肺切除术合并淋巴结清扫仍然是PMML患者的首选治疗方法[4]。在病人不可能或不希望手术的情况下,可以考虑化疗、放疗和免疫治疗。化疗药物是达卡巴嗪,通常与免疫疗法如白细胞介素-2或干扰素联合使用[12]。Robert 等人[13]进行了一项随机试验,发现在约三分之一的BRAF V600E或V600K突变的不可切除或转移性黑色素瘤患者中,达拉非尼联合曲美替尼可带来长期获益。此外,两项独立的3期临床试验(COMBI-d和COMBI-v)表明,BRAF抑制剂达拉非尼(150 mg, 2次/d)和MEK抑制剂曲美替尼(2 mg, 1次/d)治疗改善了BRAF V600E或V600K突变的不可切除或转移性黑色素瘤患者的总生存率[14, 15]。在我们的病例中,患者在诊断时已出现纵隔淋巴结转移,无手术指征。因此,在获得患者的书面知情同意后,给予口服达拉非尼和曲美替尼。经过两个月的治疗,患者右肺上叶肿物和纵隔淋巴结病变几乎消失,达拉非尼联合曲美替尼的治疗效果令人惊讶。PMML极为罕见,临床表现和影像学特征不明确,易误诊为肺癌。基于其形态学和免疫表型的可变性,PMML的诊断仍然具有挑战性。靶向药物治疗,比如达拉非尼联合曲美替尼对于BRAF V600E突变的晚期PMML患者是一个很好的选择。
