抗体偶联药物在非小细胞肺癌中的研究进展
2024-05-10曾天星田婵婵赵明栋夏伟
曾天星 田婵婵 赵明栋 夏伟
肺癌是我国及世界发病率和死亡率最高的恶性肿瘤,非小细胞肺癌(non-small cell lung cancer,NSCLC)占85%[1]。化疗是晚期肺癌的传统疗法,然而化疗药因非选择性的细胞毒性,易导致严重的系统毒性(如骨髓抑制),一些患者无法耐受。化疗的获益也是有限的,晚期NSCLC一线化疗的中位生存期(median overall survival,mOS)仅6.8个月[2]。靶向治疗可显著延长部分NSCLC的生存期,但其不可避免会耐药[3]。免疫检查点抑制剂在肺癌治疗中发挥了重要作用,可显著延长生存期[4]。然而,患者也会面临免疫相关不良反应,疾病进展等问题。在肺癌治疗领域,对特殊人群如缺乏驱动基因突变、化疗-免疫治疗后进展的患者,需要新的可供选择的治疗方案。
抗体偶联药物(antibody-drug conjugate,ADC)由单克隆抗体和细胞毒性化疗药组成,通过抗体与肿瘤细胞表面抗原结合,将细胞毒性载荷定向递送至肿瘤细胞。精准的药物递送可能减少系统毒性,提高治疗指数。ADC在多种实体瘤的治疗研究中取得重要进展, 显示出有潜力的疗效和有限的毒性。本文阐述了ADC的结构和作用机制, NSCLC有治疗潜力的靶抗原及相应ADC的研究进展。
一、ADC的结构
ADC由特异性单克隆抗体和细胞毒性化疗药组成,两者通过连接子结合[5](图1)。单克隆抗体:是ADC的主要结构,能特异性结合肿瘤细胞表面抗原。理想的单克隆抗体要求最小的免疫原性,最小的和正常组织的交叉反应。细胞毒性药:为ADC的“载荷”,是杀伤肿瘤细胞的主要部分。目前多数ADC的载荷是微管蛋白干扰剂或DNA损伤剂。连接子的作用为连接抗体和细胞毒性药物。理想的连接子需在循环中稳定,在肿瘤细胞内能被有效的断开,释放出细胞毒性药,细胞毒性药在循环中释放可导致系统毒性。
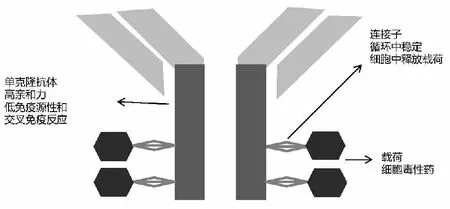
图1 ADC结构示意图
二、ADC的作用机制
ADC通过单克隆抗体与肿瘤细胞表面特异性抗原结合,将细胞毒性药定向递送至肿瘤组织,基本过程为:静脉给药后,循环中的ADC与肿瘤细胞表面靶抗原结合,然后细胞膜将ADC-抗原复合物内化,接着在溶酶体的参与下,裂解连接子,最后释放细胞毒性药[5](图2)。ADC对肿瘤细胞有三方面的杀伤作用[6]:第一,细胞毒性药的抗肿瘤活性。第二,单克隆抗体具有直接和间接的抗肿瘤作用。如抗人表皮生长因子受体2抗体有直接的抗肿瘤作用[7]。其它抗体可通过“抗体依赖的细胞毒作用”和“补体依赖的细胞毒作用”等机制发挥间接的抗肿瘤作用[8]。第三,旁观者效应:ADC也可杀死邻近的抗原阴性的肿瘤细胞,这种现象叫旁观者效应。当ADC的细胞毒性药从抗原阳性的肿瘤细胞释放出来后,被邻近的肿瘤细胞摄取,产生杀伤作用[9]。

图2 ADC作用机制示意图
三、NSCLC中的靶抗原及ADC
NSCLC中代表性的ADC靶抗原有间叶上皮转化抗原(Mesenchymal-to-epithelial transition,MET),人表皮生长因子受体2(Human epidermal growth factor receptor 2,HER2),人表皮生长因子受体3(HER3),表皮生长因子受体(Epidermal growth factor receptor,EGFR,又叫HER1),滋养层细胞表面抗原(Trophoblast cell-surface antigen,Trop-2)等。
1. 间叶上皮转化抗原
MET是跨膜酪氨酸激酶受体,其信号通路的激活促进细胞增殖、生存,与EGFR有协同作用[10]。MET通路的改变包括MET基因突变,基因扩增,受体蛋白过度表达[5]等。MET过度表达的原因有基因扩增,也有单纯基因转录水平的上调。MET基因突变和基因扩增在NSCLC中发生率均为3%[11,12],而MET基因扩增在EGFR酪氨酸激酶抑制剂(Tyrosine kinase inhibitors,TKI)继发耐药的肺癌中高达20%[13],是EGFR-TKI耐药的机制之一[14]。
Telisotuzumab vedotin (Teliso-V)的载荷为微管蛋白抑制剂。一些研究表明Teliso-V对MET过度表达的NSCLC有效。Camidge等的研究纳入治疗后进展、MET过度表达的NSCLC,予Teliso-V治疗,23%的患者获得疾病客观缓解(objective response rate ,ORR),中位无进展生存期(median progression free survival ,mPFS)为5.2个月[15]。
Camidge等接着探讨了Teliso-V在肺癌不同病理类型、EGFR突变状态以及不同MET表达水平中的疗效[16]。研究纳入既往治疗过、MET过度表达的晚期NSCLC,予Teliso-V 治疗。结果发现,EGFR野生型(无突变)的肺腺癌疗效最好(ORR达36.5%),EGFR突变阳性的肺腺癌、鳞癌疗效较差(ORR分别为11.6%和11.1%)。导致这一差异的原因可能是,同时存在MET过度表达和EGFR突变的肺癌具有两条肿瘤激活信号通路,Teliso-V只能阻断MET通路。而MET过度表达,但EGFR野生型的,少一条肿瘤激活通路,Teliso-V阻断MET通路后即可产生较好的抗肿瘤活性。该研究还发现,MET表达越高,Teliso-V疗效越好。EGFR野生型的肺腺癌组里,MET高表达患者的ORR几乎是MET中等表达患者的两倍(52.2%vs24.1%)。对于肺鳞癌疗效差的原因可能有:肺鳞癌的发生机制明显不同于腺癌。EGFR、MET等基因突变不是肺鳞癌发生的主要机制,至今也尚未发现可靶向治疗的肺鳞癌的驱动基因突变[17]。另外,该研究中肺鳞癌组的MET表达水平低于腺癌组,可能导致ADC阻断MET信号通路的效应存在差异(腺癌组MET过度表达定义为免疫组织化学染色法3+,而鳞癌组为1+)。
Camidge等还探讨了EGFR-TKI耐药后,Teliso-V联合靶向药厄洛替尼的疗效[18]。研究纳入EGFR- TKI继发耐药,MET过度表达的NSCLC,结果ORR达32.1%,mPFS为5.9个月,MET表达越高疗效越好(MET高度表达组的ORR为52.6%)。MET基因扩增是EGFR-TKI耐药的机制之一,联合以EGFR和MET通路为靶点的治疗可能有效,该研究表明Teliso-V联合靶向药可克服EGFR-TKI耐药。Teliso-V的安全性良好,最常见的治疗相关不良事件(treatment related adverse event,TRAE)为周围神经病、恶心呕吐、乏力等[15,16,18]。
2. 人表皮生长因子受体2
HER2属人表皮生长因子受体家族,在结构和功能上与EGFR高度同源[19]。HER2在高表达情况下,与EGFR、HER3或同源二聚体形成异二聚体,然后激活下游致癌信号通路[20]。HER2通路改变包括HER2基因突变,基因扩增,受体蛋白过度表达[5]。HER2基因突变在NSCLC中发生率约3%,HER2基因扩增在肺腺癌中发生率为2%~5%[21],在EGFR-TKI耐药的患者高达15%[22],HER2过度表达在NSCLC也占相当比例。HER2基因突变和扩增也是EGFR-TKI耐药的潜在机制[23]。
(1) Ado-trastuzumab ematansine(T-DM1)
T-DM1的载荷为微管蛋白抑制剂。Cretella等的体外试验发现,T-DM1能有效抑制HER2高表达NSCLC的细胞增殖,诱发细胞凋亡,能克服吉非替尼耐药[24]。一些临床研究表明,T-DM1对HER2基因突变或过度表达的NSCLC有效。
Peters等的研究纳入HER2过度表达、既往治疗过的晚期NSCLC,予T-DM1治疗,HER2高表达组20%的患者获得客观缓解,而中度表达组未观察到治疗反应[25]。Li等的研究纳入有HER2基因突变、既往治疗过的晚期肺腺癌,T-DM1治疗10个月,ORR达44%,mPFS为5个月[26]。Li等又探讨了同时存在HER2基因突变和扩增的情况,研究纳入有HER2基因突变或扩增或突变与扩增共存的晚期NSCLC,予T-DM1治疗, HER2基因突变和扩增共存的患者ORR为50%,疗效与只有一种改变的患者相似,总mPFS为5个月[27]。
上述研究发现,T-DM1对有HER2基因突变的肺癌疗效优于HER2过度表达的肺癌疗效。可能的机制是HER2基因突变能增强ADC-受体复合物的内化作用, 细胞能充分摄取ADC[28]。T-DM1的耐受性良好,不良反应多在3级以下[25-27]。
(2) Trastuzumab Deruxtecan (T-DXd)
T-DXd的载荷为拓扑异构酶I抑制剂。T-DXd在NSCLC中的研究取得了令人鼓舞的结果。DESTINY-Lung01试验探讨了T-DXd对HER2过度表达或HER2基因突变的晚期NSCLC的疗效,研究纳入既往治疗过的患者,予T-DXd治疗。HER2基因突变组ORR达54.9%, mPFS为8.2个月,mOS达18.6个月,优于HER2过度表达组(ORR为34.1%,mPFS为6.7个月,mOS为11.2个月)[28]。这个结果也符合HER2基因突变能增强ADC-受体复合物的内化作用的现象。
DESTINY-Lung02试验探讨了不同剂量的T-DXd对有HER2基因突变的肺癌疗效,纳入既往治疗过的晚期NSCLC,分为两个剂量组(6.4mg/kgvs5.4mg/kg),结果发现高剂量组疗效并不优于低剂量组,且不良反应更多。高剂量组ORR为42.9% ,低于低剂量组(53.8%)。高剂量组3级TRAE发生率为58%,高于低剂量组(31.7%)[29]。
T-DXd的安全性可控,最常见的TRAE为恶心呕吐、乏力,间质性肺病(Interstitial lung disease,ILD)发生率为4.9%[28,29]。因T-DXd治疗NSCLC的研究取得了重要进展,2022年8月11日,美国食品药品管理局批准其可用于既往治疗过的、HER2突变的不可切除或晚期NSCLC[30]。相比较同为靶向HER2的ADC药T-DM1,T-DXd的疗效似乎更好。可能的机制是,T-DXd在血浆中更稳定,直到被肿瘤细胞内化后才释放高效的载荷[31],药物递送更精准,同时T-DXd具有更高的细胞膜渗透性,有更好的旁观者效应[32]。
3. 人表皮生长因子受体3
HER3也属于人表皮生长因子受体家族,可在乳腺癌,胃癌,肺癌等表达[33]。约80%的NSCLC表达HER3[34]。HER3下游信号通路的激活,导致MET扩增,旁路信号通路的激活是肺癌对EGFR-TKI耐药的机制之一[35]。EGFR阳性突变与HER3高表达相关[36]。
Patritumab deruxtecan(HER3-DXd)的载荷为拓扑异构酶Ⅰ抑制剂。Steuer等探讨了HER3-DXd对EGFR野生型的晚期NSCLC的疗效,研究纳入既往治疗过的患者,予HER3-DXd治疗,ORR为28%,中位缓解持续时间(median duration of response,mDOR)和mPFS分别为5.7和5.4个月[37]。而Janne等探讨了HER3-DXd对EGFR突变阳性的晚期NSCLC的疗效,研究纳入TKI继发耐药的患者,予HER3-DXd治疗,ORR达39%, mDOR和mPFS分别为6.9个月和8.2个月[38],疗效优于EGFR野生型。HER3-DXd的耐受性良好,≥3级TRAE最常见为粒细胞减少、血小板减少、乏力等,ILD发生率为7%~9%,绝大多数≤2级[37,38]。
4. 滋养层细胞表面抗原
滋养层细胞表面抗原(Trophoblast cell-surface antigen,Trop-2)是细胞表面的糖蛋白,在滋养层细胞和多种组织器官中表达[39],在许多肿瘤如肺癌、乳腺癌、直肠癌等过度表达[40]。Trop-2信号通路可能促进肿瘤细胞的增殖、生存、迁移、侵袭[41]。
(1) Sacituzumab govitecan(SG)
SG的载荷为拓扑异构酶Ⅰ抑制剂。Gilead等探讨了SG对既往治疗过的晚期NSCLC的疗效,显示一定的效果,ORR为19%,mDOR和mPFS分别为6个月和5.2个月,mOS达9.5个月[42]。对平均已接受过3种治疗方案的晚期肺癌来说,这一结果也是令人鼓舞的。
(2) Datopotamab deruxtecan(Dato-DXd)
Dato-DXd的载荷为拓扑异构酶Ⅰ抑制剂。TROPION-Lung01探讨了Dato-DXd对比多西他赛治疗局部晚期或转移性NSCLC的疗效,研究纳入的患者无EGFR、ALK等基因突变,已接受过标准的一线治疗。相比多西他赛,Dato-Dxd能减少25%的疾病进展和死亡的风险,疗效优于化疗,两组mDOR分别为7.1个月和5.6个月,mPFS分别为4.4个月和3.7个月[43]。而TROPION-Lung05探讨了有EGFR、ALK等基因突变的,局部晚期或转移性NSCLC的情况。研究纳入的患者接受过标准的一线治疗(TKI或化疗),Dato-DXd治疗后,ORR达35.8%,mDOR为7个月[44]。这两项研究提示,无论是否存在EGFR、ALK等基因突变,Dato-DXd均有效。
TROPION-Lung02探讨了Dato-DXd联合免疫治疗和铂类化疗在晚期NSCLC的作用[45]。研究纳入120例患者,包括部分从未治疗过的患者。两联用药方案为Dato-DXd+帕博利珠单抗,三联方案为Dato-DXd+帕博利珠单抗+铂类。结果显示,两联和三联治疗都取得一定疗效,两联方案组mPFS更长(10.8个月vs7.8个月),三联方案组ORR更高(47%vs38%)。更重要的是,对一线治疗的患者,含Dato-DXd的联合治疗均取得了令人鼓舞的效果(ORR:两联60% ,三联55%)。无论PD-L1表达水平如何,对Dato-DXd治疗均有反应。值得注意的是,上述研究中,Dato-DXd的TRAE发生率相对较高,≥3级TRAE发生率为25%~47%,最常见为口腔炎、贫血、乏力等,≥3级ILD发生率为3%[43,44]。这可能与Trop-2也在多种正常组织表达有关,导致正常组织细胞摄取ADC。
5. 酪氨酸蛋白激酶7
酪氨酸蛋白激酶7(Protein tyrosine kinase 7,PTK7)是高度保守的跨膜蛋白,参与Wnt信号通路,而Wnt信号的失调与肿瘤的发生有关[46]。PTK7在多种类型的肿瘤过度表达,包括晚期NSCLC、卵巢癌、乳腺癌等,PTK7的过度表达与肿瘤转移和更差的预后相关[47]。PTK7在肿瘤启动细胞(又肿瘤干细胞)中表达丰富[48]。
Cofetuzumab pelidotin(又PF-06647020)的载荷为微管蛋白抑制剂。动物试验已发现,该药能使肿瘤持续性消退,优于化疗,还可抑制肿瘤启动细胞的形成。另外,该药抗肿瘤的机制还有抑制血管生成、刺激免疫细胞[49]。Maitland等的临床试验探讨了Cofetuzumab pelidotin治疗一些实体瘤的疗效,包括31例经标准治疗失败的NSCLC,接受三周方案治疗的NSCLC组ORR为16%,mDOR和mPFS分别为5.7和2.9个月,有一定的疗效[47]。基于这些有前景的结果,正在进行的试验NCT04189614将进一步评价Cofetuzumab pelidotin对复发性、表达PTK7的NSCLC的疗效, 主要观察指标是ORR[50]。
6. 粘连蛋白4
粘连蛋白4(Nectin4)是跨膜细胞粘附蛋白,在细胞粘附中起重要作用。它在正常组织的表达有限,而在肺癌、尿路上皮癌、乳腺癌等高度表达。Nectin4与细胞增殖、生长、迁移有关,还可能促进肿瘤的进展[51]。靶向Nectin4的ADC有Enfortumab vedotin(EV)。在人类肿瘤异种移植动物模型中,表达Nectin4的尿路上皮癌和乳腺癌接受EV治疗后,出现肿瘤消退[52]。正在进行的临床试验NCT04225117,将探讨EV对一些实体瘤的疗效,包括NSCLC,主要观察指标为ORR[53]。
7. 组织因子
组织因子(Tissue factor,TF)又叫促凝血酶原激酶,是一种跨膜糖蛋白。TF可过度表达于多种肿瘤,包括NSCLC,与肿瘤不良预后相关[54]。靶向TF的ADC有Tisotumab vedotin。一项Ⅰ期临床试验初步探讨了Tisotumab vedotin治疗晚期实体瘤的疗效,包括15例NSCLC。结果显示对NSCLC有一定的疗效,ORR为13.3%[55]。
其它ADC的靶向抗原还有:癌胚抗原相关黏附分子5(CEACAM5), 间皮素(Mesothelin),EGFR,LIV1,B7-H3,AXL等。总体来说,这些靶抗原的ADC在NSCLC的临床研究中显示出一定的抗肿瘤活性[5]。
四、ADC面临的问题
尽管作为新型抗肿瘤药,ADC的研究已取得许多进展,但也面临一些问题和挑战。药物抗体比(drug-to-antibody ratio,DAR)代表抗体偶联小分子毒性药物的平均数量,是影响ADC疗效的重要指标。低DAR可能导致抗肿瘤活性不足,过高的DAR又可能影响药代动力学和增加脱靶毒性[5]。改善偶联技术,如使毒性载荷偶联至更稳定的位点,是精准控制DAR的方法之一。
ADC理论上能将毒性载荷定向至靶细胞,将副作用降至最小,然而它的不良反应仍然是临床上的挑战。一些副作用影响生活质量,可能导致并发症、治疗中断,甚至死亡。如DESTINY-Lung01研究中,25%的患者因TARE中断治疗,14%的患者出现5级TRAE[28]。导致不良反应的原因有:毒性载荷固有的毒性;载荷在循环中释放;靶抗原在正常组织也有相当表达;毒性载荷被肿瘤细胞摄取后再次释放出来。另外,ADC中的单克隆抗体也可能介导免疫毒性。
就像其它治疗一样,肿瘤对ADC也会出现获得性耐药。考虑到ADC复杂的作用机制,耐药的原因可能有:肿瘤细胞靶抗原表达下调,内化途径缺失,药物主动外排泵表达增加等[56]。针对这些耐药机制,开发新型的ADC,研究ADC联合其它治疗(如化疗、靶向治疗、免疫治疗)是提高疗效的途径。(表1)列举了代表性的ADC联合其它方法治疗NSCLC的研究[56]。

表1 ADC联合治疗的研究
五、总结
ADC联合了靶向治疗和细胞毒性药的优点,许多NSCLC的抗体偶联药的临床试验已经取得有令人满意的结果,这些试验纳入的患者绝大多数已接受了2线及以上治疗。对需要后线治疗的NSCLC,ADC是可考虑的治疗方案。
在Dato-DXd研究中,接受Dato-DXd作为一线治疗的肺癌患者也取得了有前景的结果,ORR达到50%~60%。这提示ADC也有潜力进入NSCLC的一线治疗。对于无驱动基因突变,不适合免疫治疗的患者,可进行ADC一线治疗的研究。为克服单一抗肿瘤药物效力不足或出现的耐药问题,ADC联合靶向治疗、化疗、免疫等也是未来重要的研究方面。
ADC相关的研究中,也有很多失败试验,有的是疗效不足,有的是毒性较大。针对这些问题,需要从ADC的各部分进行优化,选择更合理的靶抗原,开发新型抗体、更高效的载荷、更稳定的和易裂解的连接子等。就如靶向药、免疫检查点抑制剂的发展一样,随着科学技术的进步,ADC也一定能取得更大的进步。
