慢阻肺合并骨质疏松患者血清IL-31、IL-33水平与OPG/RANK/RANKL系统相关性研究
2024-05-10张海婷徐丽敏
张海婷 徐丽敏
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种常见的以气道慢性炎症为核心、持续气流受限为特征的可预防及可治疗的全身性疾病[1],气道炎症反应除主要累及肺脏外,也可引起肺外各器官的损害,其中骨质疏松是常见的肺外合并症之一[2-3]。目前COPD并发骨质疏松的机制尚未完全明确,骨保护素(OPG)/核因子κB受体活化因子(RANK)/RANK配体(RANKL)系统是调节破骨细胞分化、活化及功能的关键信号通路[4]。研究发现炎症细胞因子白细胞介素31(interleukins-31,IL-31)及白细胞介素33(interleukins-33,IL-33)具有调节骨代谢作用且与骨质疏松的发生发展密切相关[5],但其在COPD并骨质疏松患者中的研究较少。本研究拟通过检测COPD并骨质疏松患者血清IL-31、IL-33、OPG及RANKL的水平,旨在探讨IL-31、IL-33在COPD骨量丢失中的作用。
资料与方法
一、研究对象
收集2019年6月~2023年1月在惠州市第一人民医院就诊的90例男性稳定期COPD患者为COPD组,并随机纳入同期男性健康体检者45例为对照组。COPD诊断参考中华医学会呼吸病学分会制定的《慢性阻塞性肺疾病诊治指南(2013年修订版)》[6],病例组患者年龄50~72岁,平均(58.3±10.2)岁,排除使用抗骨质疏松治疗及合并有恶性肿瘤、内分泌代谢性疾病、风湿性疾病等病史者,所有研究对象入组前常规行骨密度检测,COPD组患者根据骨量丢失情况分为骨质疏松组(n=41)和非骨质疏松组(n=49),骨质疏松诊断参考《原发性骨质疏松症诊疗指南(2017)》[7]。对照组年龄48~69岁,平均(57.1±11.8)岁,COPD组、对照组年龄差异无统计学意义。该研究已通过惠州市第一人民医院伦理委员会批准(2020107)。
二、肺功能检查及骨密度检测
肺功能检查由经验丰富的技术人员使用意大利科时迈肺功能测试仪进行,并根据美国胸科学会发布的标准进行质量控制。在进行肺功能之前,需停止使用短效吸入支气管扩张剂6小时及长效支气管扩张剂24小时以上。所有受试者的1秒用力呼气量(FEV1)、用力肺活量(FVC)及其比例(FEV1/FVC)均通过三次有效测试中最佳结果确定。
用双能X射线骨密度仪(美国NORLAND公司)测量腰椎(L1~L4)及双侧股骨颈的骨密度(bone mineral density,BMD),腰椎BMD、股骨颈BMD分别为L1~L4、双侧股骨颈BMD的平均值,BMD结果以g/cm2和T值表示,参照世界卫生组织制定的骨质疏松的断标准:T≤-2.5为骨质疏松,T>-2.5为非骨质疏松[7]。
三、标本收集及指标检测
留取所有研究对象入组当天外周静脉血2 ~ 4mL,室温下以转速2000 r/min离心5min,留取上层血清,保存于-80℃冰箱中。采用酶联免疫吸附测定法检测血清中的IL-31、IL-33、OPG及RANKL,严格按照试剂盒说明书上的操作步骤进行,试剂盒均由武汉华美生物有限公司提供。
四、统计学分析
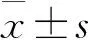
结 果
一、COPD组、对照组基线资料、细胞因子、骨代谢及肺功能指标的比较
90例COPD患者中41例并发骨质疏松,占比45.6%。相比正常对照组,COPD组患者血清IL-31、RANKL水平及RANKL/OPG比值明显升高,而血清IL-33水平及FEV1%、FEV1/FVC明显下降,差异有统计学意义(均P<0.05),两组间的OPG水平差异不显著。两组吸烟指数、体重指数(BMI)无统计学差异(P>0.05)(见表1)。

表1 COPD组、对照组基线资料、细胞因子、骨代谢及肺功能指标的比较
二、COPD非骨质疏松、骨质疏松组患者细胞因子、骨代谢及肺功能指标的比较
与COPD非骨质疏松组患者相比,骨质疏松组血清IL-31、RANKL水平及RANKL/OPG比值显著升高,而血清IL-33水平、BMI、骨密度及肺功能相关指标FEV1%、FEV1/FVC明显降低,差异有统计学意义(均P<0.05)。骨质疏松组OPG水平高于非骨质疏松组,但差异不显著(见表2)。
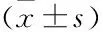
表2 COPD非骨质疏松、骨质疏松组患者细胞因子、骨代谢及肺功能指标的比较
三、COPD组患者各指标之间相关性分析
股骨颈、腰椎BMD与血清IL-33水平、FEV1%、BMI均呈正相关,而与RANKL/OPG比值及血清IL-31、RANKL水平均呈负相关,与OPG水平则无相关性(见表3)。血清IL-31水平与FEV1(%)呈负相关,与RANKL水平、RANKL/OPG比值呈正相关,血清IL-33水平与FEV1(%)呈正相关,与RANKL水平、RANKL/OPG比值呈负相关(见表4)。
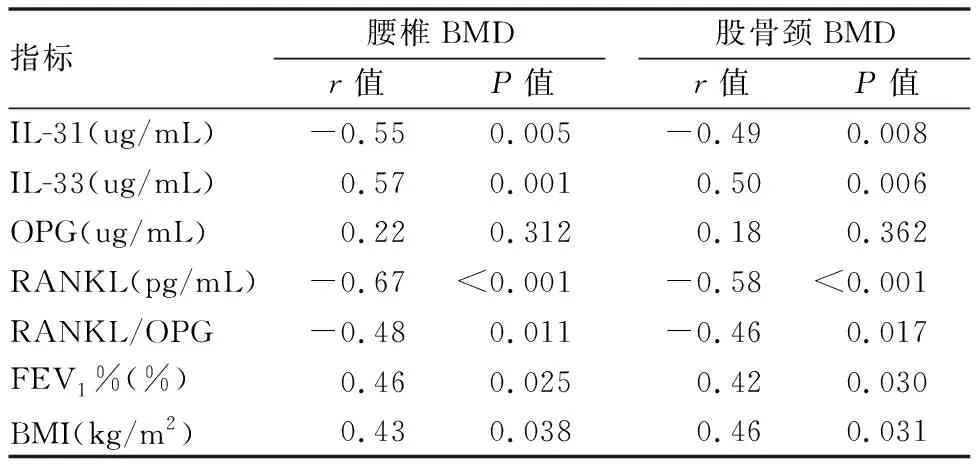
表3 COPD组患者骨密度与细胞因子、BMI、骨代谢及肺功能指标的相关性分析
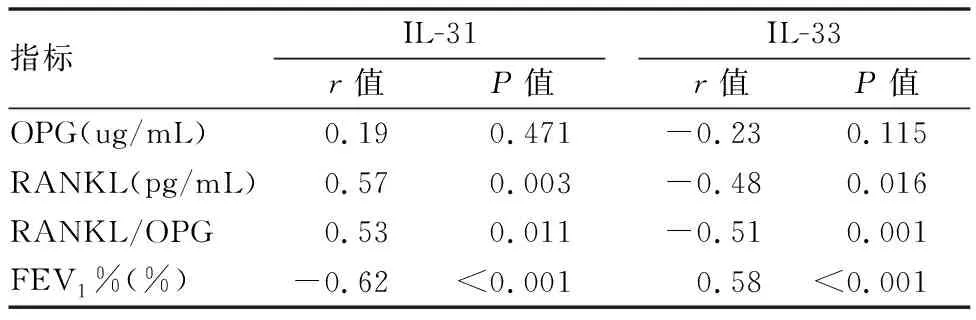
表4 COPD组患者细胞因子与骨代谢指标及肺功能的相关性分析
讨 论
COPD是一种常见的慢性肺部疾病,具有较高的患病率及常继发多种肺外并发症,包括骨质疏松、营养不良、代谢综合征等[2,4]。研究发现COPD患者骨质疏松患病率比年龄匹配的健康者高2~5倍[4],荟萃分析显示COPD患者中骨质疏松患病率为14%~66%,明显高于健康者[8]。本研究纳入的COPD患者中,45.6%继发骨质疏松,与文献报道相符[8],均表现为较高的患病率。故对于COPD尤其肺功能较差的患者,应常规进行骨密度检查,以早期识别骨质疏松。
目前COPD继发骨质疏松的机制尚未明确,研究认为全身性炎症反应是导致COPD骨量丢失的关键机制之一,由多种炎症细胞及细胞因子参与的气道炎症反应除引起肺脏病变外,也可累及骨骼系统,影响骨重建及矿物质代谢,最终导致骨质疏松[4,9,10]。研究发现OPG/RANK/RANKL信号系统在骨代谢动态平衡中起着重要的调控作用,OPG具有促进骨形成及抑制破骨细胞活性的作用,而RANKL表达增高则会促进破骨细胞活化,导致骨吸收增强,当OPG、RANKL表达失衡时,则会引起骨形成、骨吸收的失衡[11-13]。本研究结果显示COPD并骨质疏松患者RANKL表达升高及RANKL/OPG表达失衡,提示COPD骨量丢失以骨吸收增强为主,与Zhang P.F.等[14]的研究结果基本一致。IL-31主要由活化的CD4+T 淋巴细胞产生,研究发现IL-31可诱导巨噬细胞及单核细胞活化,使得IL-6、IL-1β等促炎细胞因子基因转录增加,IL-6、IL-1β等促炎因子表达增加进一步刺激RANKL的分泌,导致骨吸收增强、骨量丢失。IL-33与IL-31同为Th2细胞因子,主要由基质细胞受促炎症介质刺激后产生,其主要通过抗破骨细胞基因来抑制RANKL诱导的破骨细胞形成,抑制骨吸收,起到骨保护作用。临床及实验研究均表明IL-33/IL-31轴在骨质疏松中发挥重要作用,骨质疏松患者中,IL-33减少,而IL-31升高[15-17]。杜娇娇等[18]报道绝经后骨质疏松患者中IL-31明显升高,与骨密度呈负相关,而IL-33显著下降,与骨密度呈正相关。目前IL-31、IL-33在COPD并骨质疏松中变化的研究较少,本研究发现COPD并骨质疏松患者IL-31显著升高,而IL-33明显下降,且IL-31、IL-33水平与RANKL水平、RANKL/OPG比值显著相关,提示IL-31为COPD骨质疏松症的危险因素,而IL-33为骨保护因子,可抑制骨吸收。
综上所述,本研究结果表明,IL-31在COPD骨质疏松症中表达升高,而IL-33表达下降,提示IL-31为COPD骨质疏松症的可能危险因素,而IL-33为可能保护因素。由于本研究为单中心且病例数相对较少,希望能够多中心及大样本量来验证。
