基于PI3K/AKT/mTOR信号通路激活自噬通路研究荜茇改善小鼠肺纤维化的机制
2024-05-10菅若男甄华郭晶晶
菅若男 甄华 郭晶晶
肺纤维化(pulmonary fibrosis ,PF)是一种慢性进行性间质纤维化疾病,可致不可逆的瘢痕形成和肺血管重塑[1],其中位生存时间为2-4年[2]。然而,具体的发病机制尚不完全清楚。有报道显示,在小鼠[3, 4]和人[5]PF中,上皮-间充质转化(epithelial-mesenchymal transition,EMT)与肺纤维化过程之间存在密切关系。研究表明,PI3K/Akt/mTOR信号通路与肺纤维化的发生密切相关。PI3K/Akt/mTOR信号通路的激活和自噬不足促进EMT,从而引起肺纤维化的发生和发展[6, 7]。荜茇是蒙古族常用的草药,现证明该药具有抗肿瘤、改善心脑血管疾病、抗衰老和抗炎等生物活性[8]。本课题组前期研究已证实荜茇可以减轻博来霉素引起小鼠肺部炎症来改善肺纤维化[9]。基于此,本实验探讨荜茇调控PI3K/Akt/mTOR自噬相关信号通路对小鼠肺纤维化的影响,为科学治疗PF提供理论支撑。
资料与方法
一、实验材料
1. 实验动物
SPF级雄性KM小鼠(共50只),购自SPF生物技术有限公司(北京),批号SCXK(北京)2016-0002。到达时,小鼠体重为(30±2)g。饲养条件:室温(22±3)℃、湿度(45±5)%。本研究使用的动物经包头医学院伦理委员会批准(NO.2023079)。
2. 药品
荜茇购于内蒙古腾翔中药饮片有限公司,批号:170701。荜茇20g,加水500mL浸泡30min,煎煮3次,每次30min,合并滤液浓缩,制成含生药1.5g/mL的干浸膏;注射用盐酸博来霉素,规格:8mg,国药准字号:H20123357,吉林敖东药业集团有限公司;雷帕霉素(rapamycin,RAPA)购于Abcam:规格50ug,编号:53123-88-9,加DMSO溶解、分装后置于-20℃冰箱保存。
3. 试剂
苏木素-伊红(hematoxylin eosin stain,HE)染色液(Biosharp,货号:BL700A);马松(Masson)染色试剂盒(Solarbio,G1340)、Trizol试剂、SYBR Green Real Time PCR Master Mix、BCA蛋白检测试剂盒(上海碧云天生物,货号:R0016、D7260、P0010);反转录试剂盒(百迈克生物科技,货号:RK02002);qRT-PCR所需引物购于上海生工生物工程公司;α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、转化生长因子-β1(transforming growth factor-β1,TGF-β1)、磷酸化磷酯酰肌醇-3-激酶(phosphorylated phosphatidylinositol-3-kinase,p-PI3K)、磷酸化蛋白激酶(phosphorylated serine-threonine protein kinases,p-AKT) 和磷酸化哺乳动物雷帕霉素靶蛋白(phosphorylated mammalian target of rapamycin,p-mTOR)、自噬相关蛋白1轻链3(autophagy-related protein 1 light chain 3,LC3)、自噬效应蛋白(autophagy effector proteins,Beclin1)单克隆抗体(Abcam,货号:ab108531、ab169771、ab151549、ab38449、ab109268、ab192890、ab210498)、羊抗兔二抗(Thermo Fisher,A-11034)。
4. 仪器
金华科迪KD-202/202A 病理石蜡切片机(科迪仪器设备有限公司);JB-P5包埋机(武汉俊杰);Nikon DS-U3成像系统(日本尼康);Power PacTM基础电泳仪(美国Biorad伯乐);小型电泳槽(美国Biorad伯乐);TG16.5低速高速离心机(卢湘)。
二、方法
1. 动物分组及方法
将50只KM小鼠适应新环境(饲养2周)后,40只气管内滴注生理盐水配置BLM(5mg/kg)建立PF模型,余下10只为空白组,采取随机数字表法分为空白组;模型组(BLM组);荜茇低剂量组(LD组)、高剂量(HD组)组;雷帕霉素组(RAPA组)(见表1)。

表1 小鼠分组及处理
2. 肺功能(FVC、Cdyn)测定
将小鼠用戊巴比妥钠(100mg/kg)进行麻醉,气管插管,调整流量阈,使小鼠呼吸平稳,即潮气量为6~8mL/kg时记录数据。使用Anires2005系统(中国北京)测量FVC和Cdyn。
肺组织:测定完肺功能后,麻醉处死小鼠(腹腔注射戊巴比妥钠150mg/kg),手术暴露肺部,无菌完整剥离肺组织,用于肺部HYP、病理学变化检测和蛋白检测
3. HYP测定
根据羟脯氨酸检测试剂盒说明准确称量右肺组织,制作成匀浆,测定HYP含量。结果表示为羟脯氨酸μg/蛋白质g。
4. HE和Masson染色
将不同组小鼠分离的肺组织在4%多聚甲醛中固定24小时,用乙醇梯度脱水,二甲苯透明化后包埋于石蜡中,切成4μm厚度。切片脱蜡和脱水后,用苏木精染色6min,自来水蓝化10min,视核染深浅进行盐酸乙醇分化,伊红染色3 min,乙醇梯度脱水,二甲苯透明,中性树胶封片。Masson染色是使用染色试剂盒说明进行操作。显微镜下拍照。
5. RT-qPCR技术
使用TRIzol试剂按照说明书要求裂解肺组织,提取总RNA。使用紫外分光光度计测定总RNA浓度。按照Prime ScriptTMRT预混试剂盒要求逆转录成cDNA。加入引物进行基因序列扩增。以GAPDH为内参,计算相对表达量。以上实验重复3次。采用下列公式计算:目的基因mRNA的相对表达=2-ΔΔCT,其中CT为循环数。(表2)为引物序列。

表2 引物序列
6. 免疫组化
组织切片方法与HE染色一致,固定,包埋,切片和脱蜡后,置于柠檬酸pH 6.0缓冲液中微波修复。PBS清洗,3% BSA封闭30 min。每张切片加入约50μL稀释的α-SMA和TGF-β1一抗覆盖组织,4℃过夜孵育。PBS清洗,加二抗,常温孵育50min后,加50μL新鲜配制DAB溶液,显色完全后,蒸馏水冲洗,苏木素复染,1%盐酸酒精分化(约1s),自来水冲洗,氨水返蓝,流水冲洗。无水乙醇脱水、二甲苯透明、中性树胶封固。应用Image-Pro Plus 6.0软件分析得出每张照片阳性的累积光密度值(integrated optical density,IOD)以及组织的像素面积(The pixel area of the tissue,AREA)。并求出平均光密度值IOD/AREA(Mean Density),此值反映了目标蛋白的单位面积浓度。
7. Western Blot
RIPA缓冲液裂解小鼠肺组织,并在4°C下10000×g离心以获得上清液。BCA法测量蛋白质浓度。电泳、转膜、5%BSA封闭2h,加入一抗(LC3、Beclin-1、p-PI3K、p-AKT、p-mTOR)4°C孵育过夜。第二天,回收一抗溶液。用TBST洗膜3次,每次6min。洗涤后加入二抗,室温孵育1h。将薄膜洗涤6次,然后用ECL发光试剂盒显色和曝光,使用Image J软件进行灰度值分析,计算蛋白相对表达量。用下列公式计算:目的蛋白相对表达量=目的蛋白灰度值/内参GAPDH灰度值。
三、统计学分析
所有实验数据均通过SPSS 21.0进行统计分析。通过单因素方差分析进行多组间比较,多组间两两比较采用SNK-q检验的方法;以P<0.05为差异具有统计学意义。条形图由GraphPad 8.0软件绘制。
结 果
一、荜茇对肺组织病理变化影响
HE染色结果显示:与 BLM组相比,LD组肺泡萎缩塌陷程度、肺泡壁增厚程度和肺实质化减轻,炎症细胞浸润减少,损伤程度有所改善。HD组和RAPA组与BLM组相比,肺泡结构较为清晰,上皮细胞数量减少并且肺泡壁增厚程度明显得到改善(见图1)。

图1 PF小鼠肺组织HE染色(×200)A:空白组肺组织结构正常,肺泡结构清晰,上皮细胞数量未见增多,肺泡壁较薄,组织未见明显炎症细胞浸润;B:BLM组肺组织重度异常,大量肺泡萎缩塌陷,上皮细胞数量增多,肺实质化,肺实质内可见炎症细胞浸润,粉红色纤维组织增生;C: LD组部分肺泡萎缩塌陷,肺泡壁增厚,肺轻度实质化,少量炎症细胞浸润;D-E:HD组和RAPA组肺泡结构较为清晰,少量区域上皮细胞增多,肺泡壁增厚,炎症细胞数量明显减少(红色箭头表示炎症细胞浸润程度;黑色箭头表示纤维组织增生程度)
Masson染色发现:与 BLM组相比,LD组纤维化程度有所减轻,而HD组和RAPA组与其他组相比纤维化程度最小,与HE结果保持一致(见图2)。

图2 PF小鼠肺组织Masson染色(×200)A:空白组未见明显纤维化;B:BLM组纤维化最严重,蓝色胶原纤维最多;C:LD组纤维化程度有所减轻;D-E:HD组和RAPA组纤维化程度最小(蓝色胶原纤维越多表示纤维化越严重,相反则表示纤维化程度越小)
二、荜茇对肺功能、HYP影响
与空白组相比,BLM组FVC(P<0.01)和Cdyn(P<0.01)明显降低,HYP(P<0.01)显著增多,提示小鼠呼吸功能发生障碍,HYP积累,胶原蛋白在肺组织中过量沉积。而与BLM组相比,荜茇处理后,LD组FVC和Cdyn显著提升(P<0.05),HYP显著降低(P<0.01),HD组和RAPA组FVC和Cdyn得到明显改善(P<0.01),HYP明显降低(P<0.01)(见图3)。
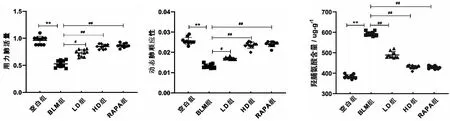
图3 各组小鼠肺功能和HYP情况注:与空白组相比,**P<0.01;与BLM组相比,#P<0.05,##P<0.01
三、 荜茇对肺纤维化相关蛋白和mRNA表达的影响
与空白组比较,BLM组小鼠α-SMA、TGF-β1蛋白和mRNA表达明显上升(P<0.01);与BLM组相比,荜茇各剂量组和RAPA组α-SMA、TGF-β1蛋白和mRNA表达明显下降,且存在显著差异(P<0.01)(见图4、5、6)。
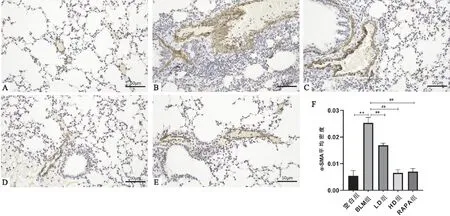
图4 荜茇对小鼠肺组织α-SMA蛋白表达的影响(免疫组化×200)注:与空白组相比,**P<0.01;与BLM组相比,##P<0.01

图5 荜茇对小鼠肺组织TGF-β1蛋白表达的影响(免疫组化×200)注:与空白组相比,**P<0.01;与BLM组相比,##P<0.01

图6 荜茇对α-SMA和TGF-β1 mRNA表达的影响注:与空白组相比,**P<0.01;与BLM组相比,##P<0.01
四、荜茇对肺组织自噬相关蛋白表达影响
通过自噬标志性LC3Ⅱ和Beclin1蛋白指标发现,与空白组相比,BLM组小鼠肺组织中,Beclin1蛋白表达无显著性差异,荜茇治疗4周后,与BLM组相比,LC3Ⅱ、Beclin1蛋白表达显著升高(P<0.01)。说明荜茇可能通过激活自噬干预PF进程(见图7)。
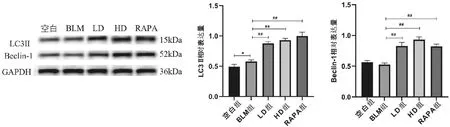
图7 荜茇对自噬相关蛋白LC3Ⅱ、Beclin1表达的影响注:与空白组相比,*P<0.05;与BLM组相比,##P<0.01
五、荜茇对肺组织P13K/AKT/mTOR信号通路的影响
P13K/AKT/mTOR信号通路的激活对PF产生至关重要的作用,与空白组相比,BLM组小鼠肺组织中PI3K、p-AKT、mTOR蛋白磷酸化水平显著升高(P<0.01);与BLM组相比,荜茇各剂量组和RAPA组 p-PI3K、p-AKT、p-mTOR蛋白磷酸化水平明显降低,说明荜茇通过抑制PI3K/AKT/mTOR信号通路干预PF(见图8)。
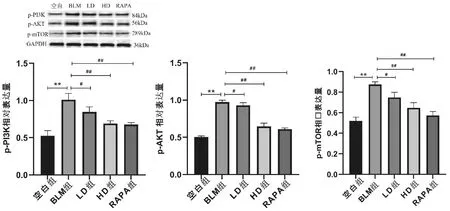
图8 荜茇对p-PI3K、p-AKT、p-mTOR蛋白表达的影响注:与空白组相比,**P<0.01;与BLM组相比,#P<0.05,##P<0.01
讨 论
PF是一类肺部疾病的终末表现,其临床特征是肺功能下降和进行性呼吸困难[10]。且病因尚不清楚。肺纤维化的发病率逐年增加,尚无有效治疗方法,预后极差[11]。因此,寻找新的治疗药物具有重要的临床意义。
BLM在短时间内可诱发肺部炎症和PF,而BLM通过气管内给药上调纤维化因子水平,如IL-1β,IL-6,TNF-α和TGF-β等[12]。本实验观察到BLM处理后,肺组织HYP含量和炎症细胞显著增加,肺泡隔明显增厚,肺功能下降。而荜茇治疗后减少小鼠肺部内胶原蛋白的沉积和炎症细胞的浸润,肺功能得到改善。TGF-β1是肺纤维化细胞因子网络的关键因素。它具有吸引单核巨噬细胞和中性粒细胞的能力,增强与肺纤维化相关的细胞因子的表达,并加快纤维化过程。ɑ-SMA是指示成纤维细胞活化的标志物,其水平导致成纤维细胞转化为肌成纤维细胞[13]。BLM处理后,肺组织TGF-β1和ɑ-SMA表达增加,荜茇治疗后,ɑ-SMA和TGF-β1蛋白表达降低。
自噬是一种生理过程,通过降解受损的细胞器或蛋白质来维持细胞稳态。在PF患者的肺组织中观察到自噬不足[14]。自噬缺乏可促进肺成纤维细胞的活化来加速BLM诱导的肺纤维化的进展[15]。在TGF-β1调节成纤维细胞-肌成纤维细胞分化期间,自噬受到抑制,并且自噬的激活可能阻断分化过程并减轻纤维化[16, 17]。这表明,活化的自噬在肺纤维化的发展中具有保护作用。Beclin-1 是自噬的关键因子,参与着自噬体膜的伸展与封闭;LC3 是自噬的标志性蛋白,是评价自噬水平的重要指标[18, 19]。本实验,我们发现荜茇可激活自噬。BLM诱导的肺纤维化小鼠的肺组织中观察到Beclin-1、LC3Ⅱ降低。而荜茇上调Beclin-1、LC3Ⅱ的表达水平,来减弱BLM诱导的肺纤维化,抑制肺成纤维细胞活化。因此,荜茇可能通过激活自噬来抑制肺成纤维细胞分化并缓解肺纤维化。
mTOR 的活化可抑制细胞内自噬的发生,被认作为自噬的负性中心调节点[20]。mTOR的上游调节剂之一是PI3K/AKT信号通路。增加的PI3K激活AKT,AKT通过激活mTOR抑制自噬[21]。PI3K/AKT/mTOR信号通路是细胞内重要的信号转导通路,作用于细胞的生长、存活、增殖、凋亡、蛋白质合成、反转录和自噬等。研究发现,在BLM诱导的PF动物模型中,通过抑制PI3K/AKT/mTOR信号通路,可以减轻肺纤维化[6,22]。有证据表明PI3K/AKT途径参与TGF-β1诱导的纤维化和胶原Ⅰ基因表达[23]。本研究评估了PI3K/AKT/mTOR途径在荜茇诱导的自噬中的作用。结果显示,荜茇可降低p-PI3K、p-AKT、p-mTOR蛋白表达。说明荜茇可能通过抑制PI3K/AKT/mTOR通路并且激活自噬来减少肺纤维化。
综上所述,荜茇可通过下调PI3K/AKT/mTOR信号通路、激活自噬,抑制炎症反应并改善肺组织纤维化。本实验揭示了荜茇对PF的保护作用及其相关机制,这为荜茇应用于PF的临床治疗提供了实验依据和指导意义。
