非粒细胞缺乏的慢阻肺合并侵袭性肺曲霉菌病诊断及预后分析
2024-05-10马芳孙傲许亚朋范菲菲王红民
马芳 孙傲 许亚朋 范菲菲 王红民
侵袭性肺曲霉菌病(invasive pulmonary aspergillus,IPA)的主要病原菌为烟曲霉菌[1]。此前,IPA被认为是一种机会性感染,主要发生于粒细胞缺乏的患者中[2-3]。近年来,据文献报道,ICU中患侵袭性肺曲霉菌病的主要危险因素是既往激素治疗史和慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD),据统计,超过10%的COPD患者有IPA,其中死亡率超过60%[4]。研究表明IL-8升高见于感染、创伤和某些自身免疫性疾病[5]。因此,IL-8水平的检测可用于炎症性疾病的诊断、鉴别诊断和预后[6]。肺活检具有侵入性和风险性,如气胸、呼吸道出血、麻醉风险等。诊断IPA的标准基于特有的组织病理学,针对部分危重病患者组织学标本难以获得[7]。本文拟研究非中性粒细胞缺乏的COPD患IPA的危险因素及探讨外周血淋巴细胞、IL-8、半乳甘露聚糖试验为临床诊治IPA提供参考。
资料与方法
一、一般资料
收集2018年1月~2022年2月郑州大学第一附属医院非粒细胞缺乏的COPD患者108例,其中IPA组32例,非IPA组76例。将32例IPA患者,根据预后情况分为存活组22例,死亡组10例。本研究经医院医学伦理委员会批准 (2023-KY-1150-002),所有患者在入院时均签署了知情同意书。
纳入标准:根据欧洲癌症/真菌病研究组织的标准[8],确诊的IPA组为行气管镜或CT引导下肺穿刺活检病理可见真菌菌丝,形态学符合曲霉菌属。临床诊断IPA为包括(1)连续2次以上在下呼吸道痰液或BALF中培养出曲霉菌或真菌荧光染色可见隔菌丝,呈45°角分支,提示曲霉菌。(2)连续两次血/BALF GM试验≥0.5。(3)胸部CT表现为空洞、空气新月征、晕征、浸润影。满足以上(1)或(2)及(3)。非IPA组由无IPA证据的患者组成(不满足上述任一个条件)。
排除标准如下:(1)血液系统恶性肿瘤。(2)既往有造血干细胞或实体器官移植或中性粒细胞减少症。(3)慢性肾功能不全患者。 (4)有免疫缺陷相关疾病患者。 (5)生命体征不稳定的危重患者。(6)严重心脏病患者。(7)不能耐受支气管镜检查的患者。研究对象分为确诊/临床诊断IPA组及非IPA组。
二、研究方法
收集治疗前每位患者血浆及肺泡灌洗液标本,记录患者基础疾病、COPD严重程度、临床表现、激素使用史、胸部CT、实验室检查结果。
三、统计学方法
采用SPSS 26.0软件统计。正态分布计量资料采用均数±标准差表示,偏态分布的计量资料用中位数(四分位间距)表示,计量资料组间比较采用单因素方差分析(正态分布)或Mann-WhitneyU检验(非正态分布)。计数资料用例(百分比)表示,组间比较采用卡方检验或Fisher确切概率法,使用受试者工作特征曲线分析其可靠性和最佳临界值。使用Cox回归分析寻找不良预后危险因素,P<0.05被认为具有统计学意义。
结 果
一、一般资料分析
108例非粒细胞缺乏的COPD患者中,IPA组32例,非IPA组76例。IPA组的中位年龄为(57.5,45.25,68.00)岁。IPA组男性(62.7%)略高于女性(37.5%)。两组在年龄、性别、激素使用史方面差异无统计意义(P>0.05)。与非IPA组相比,IPA组糖尿病的发生率更高,肺功能严重程度分级更高,差异有统计学意义(均P<0.05)(见表1)。
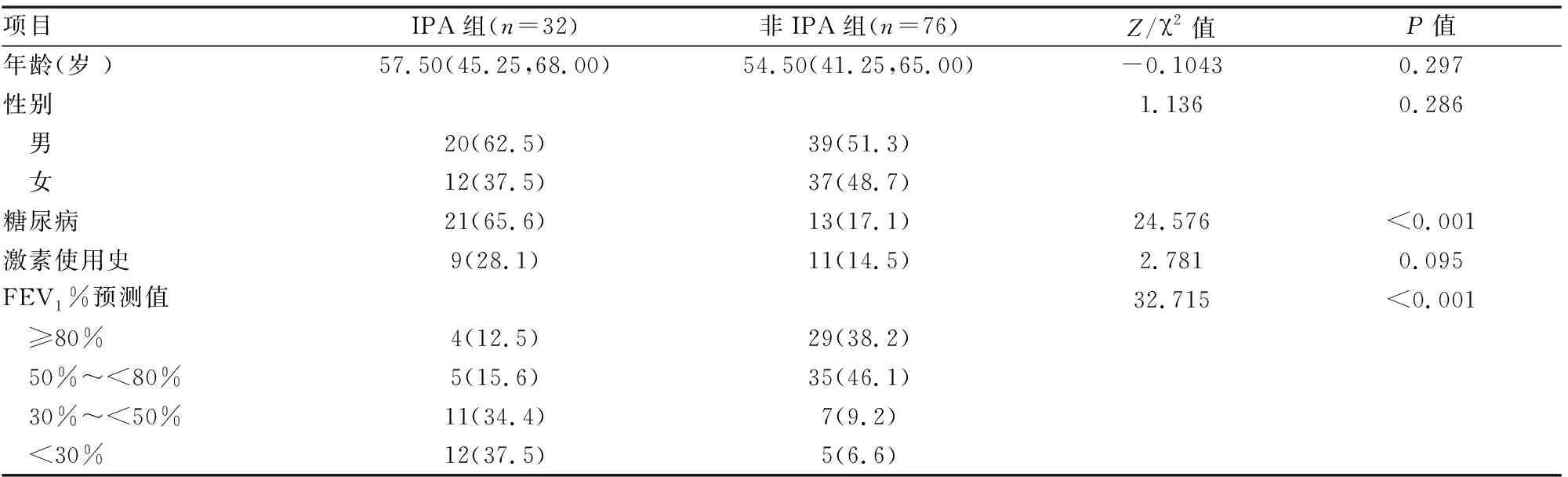
表1 IPA组与非IPA组一般临床资料比较
二、IPA组与非IPA组相关实验室检查分析
两组在实验室检查方面,在血红蛋白、中性粒细胞绝对值、淋巴细胞计数、白蛋白、血IL-8、BALF GM试验、BALF IL-8水平存在统计学差异(P<0.05)。在白细胞计数、血GM试验方面未见统计学差异(P>0.05)(见表2)。

表2 IPA组与非IPA组相关实验室检查比较
三、血清淋巴细胞计数、IL-8和半乳甘露聚糖水平诊断COPD合并IPA的ROC分析
根据结果二中单因素分析结果及临床知识,对外周血淋巴细胞计数、血清和肺泡灌洗液中IL-8和半乳甘露聚糖水平行ROC分析,结果示:淋巴细胞绝对值的最佳临界值为1.180×109/L,灵敏度为0.688,特异度为0.882,AUC值为0.817。血清IL-8的最佳临界值为5.170 pg/mL,灵敏度为0.625,特异度为0.934,AUC值为0.742。血清GM水平的最佳界值为0.715 μg/mL,敏感度为0.250,特异度为0.934,AUC为0.561。BLAF IL-8的最佳临界值为19.775 pg/mL,灵敏度为0.594,特异度为0.974,AUC为0.837。BALF GM水平的最佳临界值为0.475 μg/mL,灵敏度为0.594,特异度为0.776,AUC为0.706。外周血淋巴细胞计数、BLAF GM联合BALF IL-8 ,AUC为0.918(见图1)。
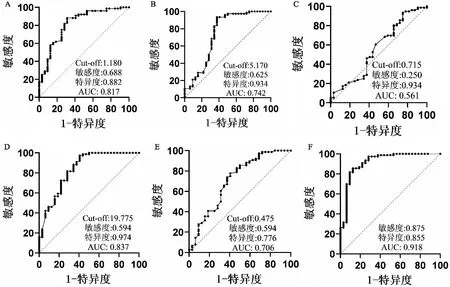
图1 外周血淋巴细胞绝对值、IL-8、GM试验ROC曲线外周血淋巴细胞绝对值(A)、血清IL-8(B)、血清GM (C)、BALF IL-8(D)、BALF GM(E)及外周血淋巴细胞计数、BALF IL-8联合BALF GM(F)的ROC分析
四、存活组与死亡组单因素及多因素Cox回归分析
单因素生存分析提示淋巴细胞计数水平、白蛋白水平降低,血红蛋白、C-反应蛋白、降钙素原、血IL-8、BALF IL-8水平升高可能为COPD患IPA的预后不良因素。多因素生存分析结果提示低白蛋白水平是COPD患IPA预后不良的独立危险因素[HR=0.808 (95%CI:0.706~0.925)](见表3)。
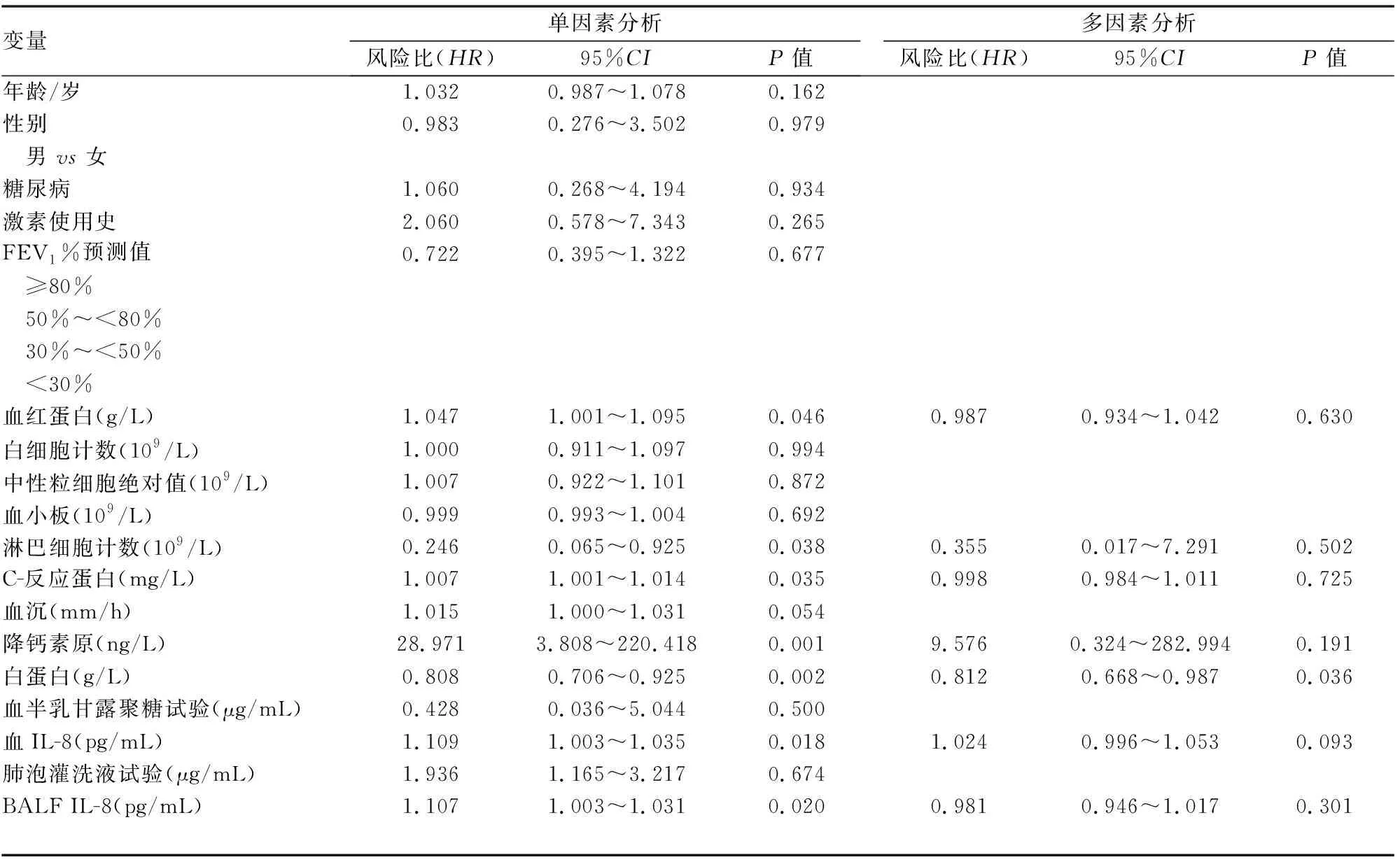
表3 存活组、死亡组单因素及多因素分析
讨 论
IPA是一种机会性感染,既往常见于持续性中性粒细胞缺乏(粒细胞缺乏症)患者[9]。近年来,IPA在COPD患者中的发病率也逐年上升,在有基础疾病/健康的非中性粒细胞减少的人群中IPA并不少见,但其流行病学、临床特征、转归和预后尚不清楚[10],它与粒细胞缺乏症和正常患者的IPA有很大的不同,包括临床表现、实验室检查、影像检查[11]。因此,迫切需要更多的病例和更多的研究来了解非中性粒细胞减少的COPD患者IPA的临床表现,以便为该病的诊断和治疗提供更多的参考和线索[12]。
GM(曲霉半乳甘露聚糖)抗原是侵袭性曲霉菌病(IA)阶段释放的一种曲霉菌特异性抗原[13]。GM试验通过检测样本(包括血液、痰、无菌肺泡灌洗液、胸腔积液等)中的曲霉菌特异性抗原,被认为是诊断IPA的特异性标志,尤其是在血液系统恶性肿瘤或造血干细胞移植患者中[14]。然而,最近的多项回顾性研究表明,血清GM检测非中性粒细胞缺乏的患者诊断IPA的敏感度和特异度并不理想[15],本研究表明血清GM的敏感度为0.250,敏感度低疾病漏诊率会增加,综上所述,血 GM检查主要用于临床诊断粒细胞缺乏患者的IPA,而IPA对非中性粒细胞缺乏患者的诊断阳性率太低,不能满足临床需要[16]。此前,有研究表明BALF GM试验诊断阳性率高于血GM试验[17],本研究结果显示与血清GM试验相比,BLAF GM试验对非粒细胞缺乏的COPD合并IPA的诊断效能更高。然而,ROC分析显示BALF IL-8诊断非中性粒细胞缺乏的COPD患者合并IPA的敏感度、特异度和AUC显著高于血液GM检测。曲霉菌感染可导致许多细胞因子水平升高,这可能是由于曲霉菌属分泌的蛋白水解酶诱导上皮细胞产生细胞因子,包括IL-6和IL-8[18-19]。据报道,暴露于烟曲霉衍生的蛋白酶后,IL-6和IL-8基因表达上调,导致IL-6与IL-8升高[20]。在一项研究中,IPA血液病患者血清和BALF中的IL-6和IL-8水平显著升高,并与半乳甘露聚糖水平呈正相关[21-22]。本研究显示IPA患者血清和BALF中IL-8水平明显高于非IPA患者。当结合淋巴细胞绝对值和BLAF GM试验时,它也具有高度的特异度和敏感度。在另一项研究中,赫尔特等人分析了IPA血液病患者血清和BALF中IL-6、IL-8的水平。他们发现IL-6和IL-8与血清和BALF中的IPA显著相关[23],这与我们的研究一致。
目前尚无COPD患者淋巴细胞绝对计数或免疫淋巴细胞水平与IPA关系的研究。国内外的外周血淋巴细胞绝对值研究通常将其作为免疫炎症指标[24],外周血淋巴细胞计数下降提示机体免疫功能下降,导致抗炎性感染能力显著下降[25-26]。目前,很少有学者研究淋巴细胞绝对值与IPA的关系,本研究的病例组为非中性粒细胞减少症和排除免疫缺陷疾病的患者,结果显示外周血淋巴细胞绝对值明显低于对照组,差异有统计学意义,提示这些患者可能存在免疫功能低下,易发生曲霉感染,因此淋巴细胞绝对值降低结合其他相关指标对IPA的诊断有一定的参考价值。
本研究为单中心回顾性队列研究,纳入患者数目相对较少,存在一定局限性。
