叉头框转录因子C1在结肠癌中表达情况及临床意义
2024-05-10张永国邵晓冬高艳红邹德莉
张永国, 刘 婕, 邵晓冬, 高艳红, 邹德莉
1.北部战区总医院 消化内科,辽宁 沈阳 110016;2.沈阳药科大学 药剂实验中心,辽宁 沈阳 110016
叉头框转录因子(forkhead box,FOX)C1隶属于叉头框转录因子家族,在多种生理和病理过程中发挥重要调节作用。FOXC1基因突变常与神经系统、眼睛、肾等发育异常相关[1-2]。有研究发现,FOXC1在多种肿瘤中表达异常增高,且与患者不良预后相关[3-5]。FOXC1有望成为新的肿瘤分子标志物及潜在的治疗靶点。结肠癌是常见的消化系统恶性肿瘤[6-13]。近年来,结肠癌的早期内镜诊治、免疫治疗、靶向治疗取得了可观进展,改善了结肠癌患者的预后,但是,我国仍有不少结肠癌患者在发现时已属晚期[14]。本研究采用免疫组化染色的方法观察了FOXC1在结肠癌组织中的表达情况,探讨分析了FOXC1的表达水平与性别、年龄、组织学分化程度、TNM分期、淋巴结转移情况、肿瘤部位等临床参数之间的相关性,旨在阐明FOXC1在结肠癌中的表达特点及潜在的临床价值。现报道如下。
1 对象与方法
1.1 研究对象 收集北部战区总医院自2009年1月至2010年6月收治的150例确诊结肠癌患者的病理组织切片。通过EMR系统调阅病历获取相关的临床病理学数据资料,电话随访获取患者的生存状态和生存时间。150例患者中,男性102例,女性48例;高、中、低分化腺癌分别为33例、80例、37例;TNM分期Ⅰ和Ⅱ期72例,Ⅲ和Ⅳ期为78例;淋巴结转移78例。患者及其家属均签署知情同意书。本研究经医院伦理委员会批准。
1.2 试剂及材料 FOXC1单克隆抗体购自abcam公司;SP免疫组化试剂盒、防脱挂胶玻片、苏木素染色液、DAB试剂盒、中性树胶购自中杉金桥生物公司;光学显微镜为奥林巴斯(Olympus)公司。
1.3 免疫组化染色及评分 病理组织切片放置于烤片机60℃烤片30 min后,依次进行二甲苯脱蜡、梯度乙醇(浓度梯度依次为100%、100%、95%、85%、75%)水化;病理组织切片滴加0.3%过氧化氢溶液后室温下放置30 min灭活内源性过氧化酶,随后于柠檬酸盐溶液中煮沸2 min行抗原修复;滴加一抗FOXC1抗体(浓度1∶100)放置于4℃冰箱中过夜,复温30 min后滴加二抗于室温下孵育放置30 min,采用DAB试剂显色,苏木精复染,滴加少许中性树胶盖玻片封片,显微镜下观察结果[15]。病理组织切片经2名高年资病理科医师进行阅片评分:(1)染色强度。无阳性染色评为0分;浅黄色评为1分;深黄色评为3分;介于浅黄色和深黄色之间评为2分。(2)阳性细胞数比率。无阳性细胞着色评为0分;1%~25%、26%~50%、51%~75%、大于75%的细胞阳性着色分别评为1、2、3、4分。最终评分为染色强度和染色阳性细胞数比率两者的评分相乘,阴性(-,0分)、弱阳性(+,1~6分)、强阳性(++,7~12分)。
1.4 统计学方法 采用SPSS 23.0统计学软件对数据进行处理。采用方差分析(ANOVA)统计分析FOXC1在结肠癌组织和相应癌旁组织中的表达差异;采用Kruskal-Wallis H检验和Mann-Whitney U检验统计分析FOXC1表达水平与结肠癌患者临床参数之间的相关性;采用Kaplan-Meier和COX回归统计分析FOXC1表达水平与结肠癌患者生存预后之间的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 FOXC1在结肠癌组织和相应癌旁组织中的表达差异 在结肠癌组织的细胞核和细胞浆中,FOXC1呈浅黄色或深黄色着色。见图1。在纳入的150例患者的结肠癌组织中,112例(74.7%)FOXC1染色呈阳性;而在相应癌旁组织中,仅有34例(22.7%)FOXC1染色呈阳性。FOXC1在结肠癌组织中的表达阳性率高于相应癌旁组织,差异有统计学意义(P<0.05)。
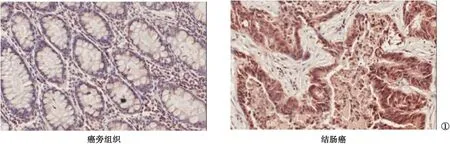
图1 FOXC1在结肠癌组织和相应癌旁组织中的表达差异(200倍)
2.2 FOXC1表达水平与结肠癌患者临床参数之间的相关性 与TNM分期Ⅰ和Ⅱ期比较,Ⅲ和Ⅳ期的FOXC1表达水平更高(P<0.05);与高分化比较,低分化、中分化的FOXC1表达水平更高(P<0.05);与未发生淋巴结转移比较,发生淋巴结转移的FOXC1表达水平更高(P<0.05)。FOXC1表达水平与TNM分期、组织学分化程度、淋巴结转移密切相关(P<0.05)。见表1。
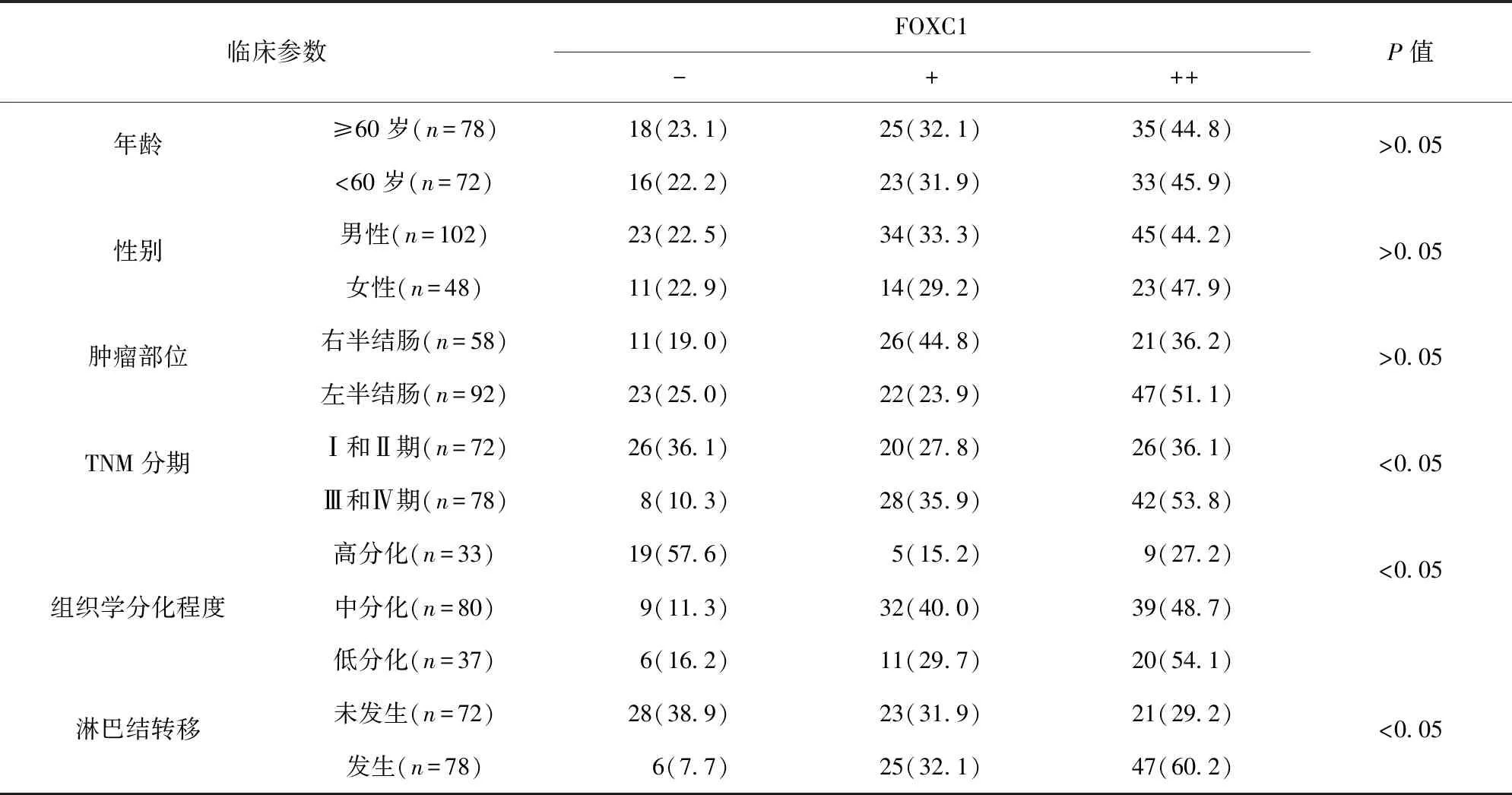
表1 FOXC1表达水平与结肠癌患者临床参数之间的相关性/例(百分率/%)
2.3 FOXC1表达水平与结肠癌患者生存预后之间的相关性 电话随访患者的生存状态和生存时间,随访5年后,98例患者死于结肠癌及肿瘤相关并发症,5年总体存活率为34.7%(52/150),中位生存期为34个月。分层分析后发现,FOXC1(-)、FOXC1(+)、FOXC1(++)患者的5年存活率分别为52.9%、35.4%、25.0%,中位生存期分别为60、34、20个月。Kaplan-Meier生存曲线显示,FOXC1表达水平越高的结肠癌患者,病死率越高,总体存活率越低,生存期越短(P<0.05)。见图2。COX回归分析显示,FOXC1在结肠癌患者中的表达水平与存活率密切相关(危险比2.84,95%可信区间1.61~4.59,P<0.05)。见表2。

表2 FOXC1表达水平与结肠癌患者生存预后之间的相关性

图2 FOXC1表达与结肠癌患者生存预后之间的相关性Kaplan-Meier曲线
3 讨论
结肠癌是发病率和病死率均较高的消化系统恶性肿瘤[16-17]。随着临床内镜技术、靶向药物、免疫药物的不断发展研发,结肠癌的治疗效果取得了很大的进步,较大程度地改善了结肠癌患者的生存预后。但由于国民健康意识普及不强、城乡医疗水平差距较大等因素,我国仍有不少结肠癌患者发现时已属中晚期[14,17]。有研究报道,一些基因分子的变化修饰可以更准确地反映肿瘤特性,预测患者的生存预后,指导肿瘤的靶向和免疫治疗[18]。
FOX是生物界一种高度保守的、极其重要的转录因子,不但拥有高度保守的DNA结合区和转录调节区,还拥有磷酸化区域、核定位信号区域等结构。FOXC1是FOX家族的重要成员之一,编码基因位于人类染色体6p25.3,结构包含DNA结合结构域、氨基端转录激活结构域、羧基端转录激活结构域及转录抑制结构域[19]。有研究报道,FOXC1在胰腺癌、原发性肝癌、乳腺癌、子宫内膜癌中表达异常,其可影响肿瘤细胞的增殖和侵袭转移[1,20]。本研究中,FOXC1在结肠癌组织中的表达阳性率高于相应癌旁组织(74.7%比22.7%),差异有统计学意义(P<0.05)。这表明,FOXC1在结肠癌中异常高表达,提示FOXC1可能参与了结肠癌的发生发展。
FOXC1通过调节一系列靶基因的表达参与调控肿瘤细胞凋亡和上皮间质转化,进而影响肿瘤细胞的迁移和侵袭能力。有学者发现,FOXC1主要通过促进细胞外基质降解和上皮间质转化、上调基质金属蛋白酶家族表达等多种分子机制促进肿瘤的侵袭和转移[21-23]。FOXC1在原发性肝细胞肝癌中通过上调snail的表达、下调E-cadherin的表达来促进肝癌细胞上皮间充质转化,增强肝细胞癌的侵袭能力及远处转移[5,19,24]。本研究结果显示:与TNM分期Ⅰ和Ⅱ期比较,Ⅲ和Ⅳ期的FOXC1表达水平更高(P<0.05);与高分化比较,低分化、中分化的FOXC1表达水平更高(P<0.05);与未发生淋巴结转移比较,发生淋巴结转移的FOXC1表达水平更高(P<0.05)。这提示,FOXC1在结肠癌侵袭转移中发挥重要作用,其可影响肿瘤细胞的迁移和侵袭能力。
综上所述,FOXC1在结肠癌中高表达且与患者的生存预后密切相关,其可作为预测结肠癌生存预后的潜在分子标志物。
