地舒单抗治疗非小细胞肺癌骨转移临床疗效
2024-05-10段登科白智龙温振涛孙邦建
段登科, 白智龙, 温振涛, 王 岩, 陈 松, 孙邦建
1.邯郸市第一医院 骨肿瘤科,河北 邯郸 056002;2.河北工程大学附属医院 骨科,河北 邯郸 056002
近年来,肺癌的发病率和病死率居高不下[1]。非小细胞肺癌(non-small cell lung cancer,NSCLC)作为主要的肺癌类型,5年存活率仅为5%[2]。晚期NSCLC患者预后不良,约1/3的Ⅳ期NSCLC患者会出现骨转移,中位生存期<9个月[3-5]。NSCLC伴骨转移患者常发生疼痛和骨相关事件(skeletal related event,SREs)。目前,临床治疗骨转移的主要策略是预防或延迟SREs的发生。地舒单抗是一种靶向核因子k-B配体受体激活剂(receptor activator of nuclear factor kappa B ligand,RANKL)的单克隆抗体,可抑制其活性,从而减少破骨细胞的形成和激活[6]。目前,地舒单抗越来越多地用于骨巨细胞瘤和实体瘤骨转移的治疗[7],但其在NSCLC伴骨转移患者中的治疗效果及安全性少见报道。本研究旨在探讨地舒单抗治疗非小细胞肺癌骨转移的有效性和安全性。现报道如下。
1 资料与方法
1.1 一般资料 回顾性分析自2016年1月至2021年12月邯郸市第一医院骨肿瘤科收治的80例NSCLC伴骨转移患者的临床资料。纳入标准:(1)年龄18~80岁;(2)经病理确诊为NSCLC;(3)接受系统治疗,化疗、靶向治疗或免疫治疗。排除标准:(1)合并其他器官的原发肿瘤;(2)地舒单抗治疗<3个周期;(3)临床资料或随访数据缺失。按治疗方式将患者分为唑来膦酸组(n=40)与地舒单抗组(n=40)。唑来膦酸组中,男性6例,女性34例;平均年龄(63.82±8.32)岁;平均体质量指数(24.13±3.68)kg/m2;吸烟史8例,饮酒史5例,高血压17例,糖尿病14例,冠心病19例;病理类型:腺癌25例,鳞癌8例,其他7例;脑转移10例;骨转移:单处5例,多处35例;美国东部肿瘤协作组评分:0分14例,1分22例,2分4例;NSCLC治疗:化疗29例,靶向治疗6例,免疫治疗5例。地舒单抗组中,男性10例,女性30例;平均年龄(65.66±7.13)岁;平均体质量指数(25.81±4.25)kg/m2;吸烟史11例,饮酒史7例,高血压12例,糖尿病16例,冠心病13例;病理类型:腺癌27例,鳞癌7例,其他6例;脑转移9例;骨转移:单处8例,多处32例;美国东部肿瘤协作组评分:0分8例,1分26例,2分6例;NSCLC治疗:化疗31例,靶向治疗5例,免疫治疗4例。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会审核批准(伦理号:2023-K-020)。所有患者均签署知情同意书。
1.2 研究方法 唑来膦酸组接受唑来膦酸注射液治疗,5 mg,每28 d静脉滴注1次。地舒单抗组接受地舒单抗注射液治疗,120 mg,每28 d皮下注射1次。
1.3 观察指标 收集患者临床资料。SREs主要包括病理性骨折、脊髓压迫、高钙血症、骨手术、骨放疗等。不良反应主要包括发热、贫血、全身乏力、四肢麻木、关节痛、肌肉痛、牙痛等。通过随访系统进行电话随访或门诊随访。电话随访每个月进行1次,主要关注患者的一般状况,对治疗的反应。门诊随访每8周1次,主要评估治疗反应性。随访时间1年。总生存期(overall survival,OS)是指从治疗开始到以任何原因所致死亡的时间。疾病特异性生存期(disease-specific survival,DSS)是指从开始到由NSCLC死亡的时间。无进展间隔期(progress-free interval,PFI)是指从开始到疾病未进一步恶化的间期。

2 结果
2.1 两组OS、DSS、PFI比较 地舒单抗组和唑来膦酸组的中位OS分别为20.3个月和14.5个月,中位DSS分别为18.0个月和13.6个月,中位PFI分别为16.9个月和12.8个月。地舒单抗组患者OS、DSS、PFI均显著优于唑来膦酸组,差异有统计学意义(P<0.05)。见图1。

图1 两组患者预后比较(a.OS;b.DSS;c.PFI)
2.2 两组SREs比较 两组病理性骨折、脊髓压迫、高钙血症、骨手术、骨放疗比较,差异无统计学意义(P>0.05)。地舒单抗组SREs总发生率低于唑来膦酸组,差异有统计学意义(P<0.05)。见表1。

表1 两组SREs比较/例(百分率/%)
2.3 两组不良反应发生情况比较 两组患者发热、贫血、全身乏力、四肢麻木、关节痛、肌肉痛、牙痛,以及不良反应总发生率比较,差异无统计学意义(P>0.05)。见表2。
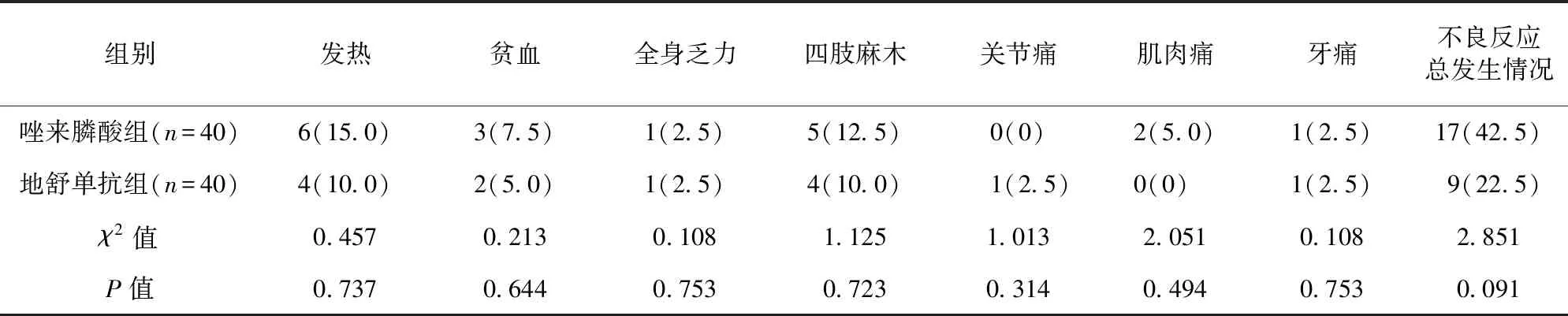
表2 两组不良反应发生情况比较/例(百分率/%)
3 讨论
大部分晚期实体癌(包括NSCLC)患者可能发生骨转移。骨转移会破坏破骨细胞和成骨细胞之间的稳态,进而损害骨骼结构的完整性[8]。RANKL是肿瘤坏死因子超家族成员,也是RANK和骨保护素(osteoprotegerin,OPG)的配体[9]。RANK-RANKL-OPG轴对生理性骨吸收和骨破坏至关重要,其在骨转移灶的骨质疏松和骨破坏等病理状态中也发挥着重要作用[2,10]。骨骼肿瘤细胞中RANKL的表达水平增加,RANKL是破骨细胞形成、生理功能、存活和随后转移过程中发生骨破坏的主要驱动因素[11]。成骨细胞/破骨细胞活动失调和骨破坏导致SREs的风险增加,包括脊髓压迫、病理性骨折和对骨骼的放射治疗或手术等。SREs的发生引起疼痛增加,OS降低和生活质量降低[12]。在骨转移的NSCLC小鼠模型中,RANKL的抑制降低了骨骼肿瘤的负担并延长了其生存期[13]。地舒单抗是一种单克隆抗体,可结合并抑制RANKL活动,减少破骨细胞的形成、激活[14]。这种效应同时减少了骨量的损失,从而降低了骨折和其他严重骨并发症发生的可能性[9,15]。另有研究报道,地舒单抗治疗也可以防止肿瘤的进一步生长[10]。
本研究发现,地舒单抗组OS、DSS和PFS均优于唑来膦酸组,提示地舒单抗可显著改善患者预后。在一项探索性亚组分析中发现,与接受唑来膦酸治疗的患者比较,使用地舒单抗治疗的NSCLC患者OS更佳[16]。另有研究报道,地舒单抗的应用可有效改善NSCLC患者的OS[17]。但目前,地舒单抗有助于延长患者生存期的潜在机制尚未明确。临床普遍认为,抑制RANKL除了具有骨重塑的效应外,还可能具有直接和间接的抗肿瘤作用[18]。另一种可能的解释是地舒单抗可减少SREs的发生,从而防止肿瘤的恶化并延长生存期[13]。本研究结果进一步支持了地舒单抗可改善NSCLC伴骨转移患者的预后这一观点。但另有研究报道,地舒单抗在接受化疗和免疫治疗的NSCLC患者中并无优势[5,17],未来仍需要更多的研究挖掘对地舒单抗获益的患者亚群。
在合并有骨转移的前列腺癌患者中,超过50%的患者具有SREs表现[19]。有研究报道,SREs的发生与患者的低存活率有关[20]。部分患者在初诊为伴骨转移的NSCLC时已经出现SREs[25]。一项纳入多种晚期实体癌症(包括NSCLC)患者的随机、双盲对照试验中,地舒单抗被证明在延迟患者出现SREs方面的效果不劣于唑来膦酸[22]。本研究发现,两组各单项SRE发生率比较无显著差异,这可能与本研究样本量较小、样本来源单一等有关;地舒单抗组SREs总发生率低于唑来膦酸组,提示其对于降低SREs具有一定的效应;最后,本研究比较两组患者不良反应发生情况发现,地舒单抗组与唑来膦酸组之间无显著差异,提示地舒单抗具有较好的安全性。
综上所述,地舒单抗可显著改善NSCLC伴骨转移患者的预后,降低SREs发生风险,具有较好的安全性。
