外周血嗜酸性粒细胞与慢性阻塞性肺疾病患者并发阻塞性睡眠呼吸暂停综合征关系研究
2024-05-10吴海珍舒红梅孙泽丽丁国正
吴海珍, 舒红梅, 孙泽丽, 何 贝, 王 玲, 丁国正
安庆市立医院 呼吸与危重症医学科,安徽 安庆 246000
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)以不完全可逆的气流受限为主要病理特征,随疾病进展,患者可出现慢性持续低氧状况,并会因此产生多种合并症,其中,以阻塞性睡眠呼吸暂停综合征(obstructive sleep apnea-hypopnea syndrome,OSAHS)较为常见[1]。有研究报道,COPD与OSAHS具有相似的病理生理基础,包括炎症反应及氧化应激反应[2]。外周血嗜酸性粒细胞(eosinophils,EOS)是一种在免疫反应与过敏反应中有着极为重要作用的免疫炎症细胞,可促进炎症介质释放,加重组织细胞炎症性损伤[3]。然而,目前关于外周血EOS的研究多集中于其与COPD发病、急性加重及预后的关系[4-5]。关于外周血EOS与COPD患者并发OSAHS关系的研究相对较少。本研究旨在探讨外周血EOS与COPD患者并发OSAHS的关系,为临床早期识别OSAHS高危人群并指导干预方案的制定提供参考。现报道如下。
1 对象与方法
1.1 研究对象 回顾性分析自2020年1月至2022年12月安庆市立医院收治的103例COPD患者的临床资料。其中,男性62例,女性41例;年龄51~81岁,平均年龄(63.17±5.68)岁;COPD病程2~7年,中位病程4.00(4.00,5.00)年。纳入标准:符合COPD相关诊断标准[6];入院时意识清晰,精神正常,可配合完成研究检查与调查;临床资料完整。排除标准:上气道多水平解剖结构异常、脑部肿瘤、神经肌肉性疾病等所致的OSAHS;伴有支气管哮喘、血吸虫病等可能影响外周血EOS水平的疾病;合并其他呼吸道疾病,如支气管扩张、肺结核等。本研究经医院伦理委员会批准。所有研究对象均对本研究知情同意。
1.2 研究方法 记录患者入院后24 h内首次外周血EOS检测水平,并依据中位数将患者分为低EOS组和高EOS组。OSAHS判定符合《阻塞性睡眠呼吸暂停低通气综合征诊治指南(基层版)》[7]中相关诊断标准。记录患者的年龄、性别、COPD病程、体质量指数(body mass index,BMI)、慢性阻塞性肺疾病全球倡议(global initiative for chronic obstructive lung disease,GOLD)分级、合并症、过去1年急性加重次数、外周血白细胞、红细胞、血红蛋白、血清C反应蛋白水平等资料。其中,实验室指标均为患者入院24 h内首次抽血检测所得。

2 结果
2.1 不同外周血EOS水平患者一般资料及实验室指标比较 103例COPD患者外周血EOS水平平均为(0.53±0.11)×109个/L,以中位外周血EOS水平(0.53×109个/L)为截点进行分组,将外周血EOS水平≥0.53×109个/L的56例患者纳入高EOS组,将外周血EOS水平<0.53×109个/L的47例患者纳入低EOS组。高EOS组患者的BMI、C反应蛋白水平,以及GOLD分级3、4级比例均高于低EOS组,GOLD分级1、2级比例均低于低EOS组,差异有统计学意义(P<0.05);两组其他资料比较,差异无统计学意义(P>0.05)。见表1。

表1 不同外周血EOS水平患者一般资料及实验室指标比较/例(百分率/%)
2.2 不同外周血EOS水平患者OSAHS发生情况 103例患者中57例并发OSAHS,占55.34%(57/103)。其中,高EOS组39例,OSAHS发生率为69.64%(39/56);低EOS组18例,OSAHS发生率38.30%(18/47)。高EOS组OSAHS发生率高于低EOS组,差异有统计学意义(χ2=10.158,P=0.001)。
2.3 外周血EOS水平与COPD患者并发OSAHS的关系分析 点二列相关性分析显示,外周血EOS水平与COPD患者并发OSAHS密切相关(r=0.351,P<0.001)。
2.4 COPD患者并发OSAHS影响因素的Logistic回归分析 将COPD患者并发OSAHS情况作为因变量,将表1中差异有统计学意义的变量作为自变量进行多因素Logistic回归分析,结果显示,外周血EOS水平、GOLD分级(2、3级)是COPD患者并发OSAHS的影响因素(P<0.05)。见表2。
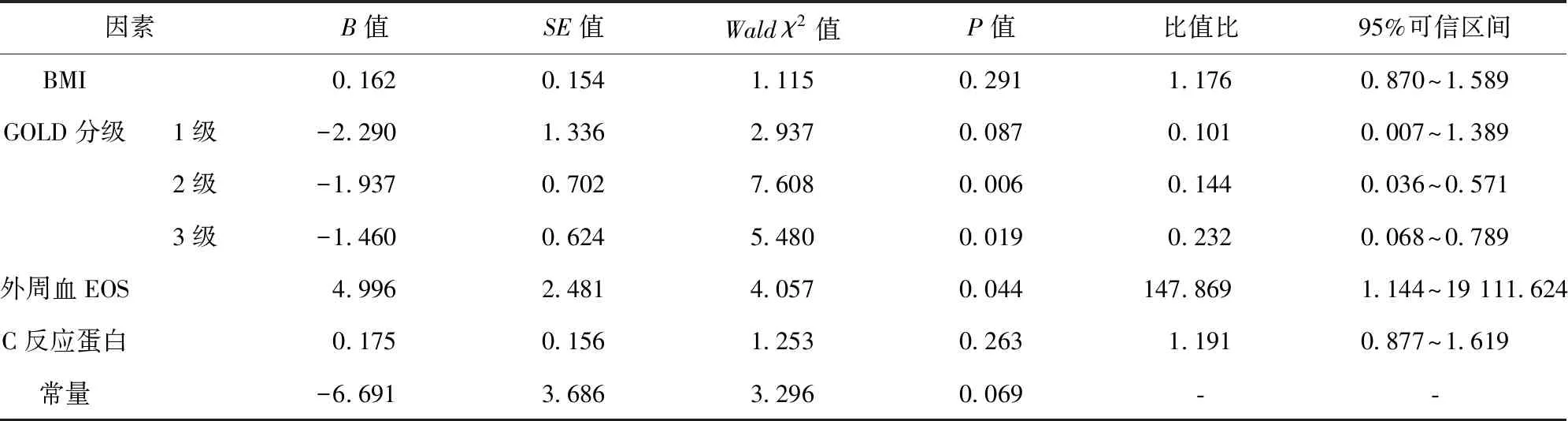
表2 COPD患者并发OSAHS影响因素的Logistic回归分析
2.5 外周血EOS评估COPD患者并发OSAHS的价值分析 ROC曲线分析显示,外周血EOS评估COPD患者并发OSAHS的曲线下面积为0.721(95%可信区间:0.622~0.820,P<0.001),具有一定评估价值。当外周血EOS取0.545×109个/L时,其敏感度、特异度分别为61.40%、78.30%,约登指数为0.397。见图1。
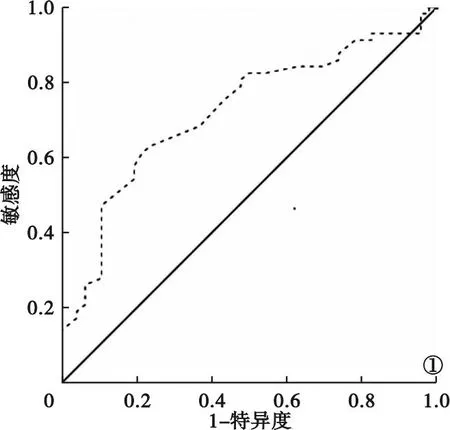
图1 外周血EOS评估COPD患者并发OSAHS的ROC曲线
3 讨论
有研究报道,OSAHS是COPD常见的共患病之一,会导致患者睡眠结构出现紊乱,引起夜间高碳酸血症、低血氧症等严重症状,增加其病死风险[8]。流行病学研究报道,普通人群中OSAHS的患病率为9%~38%,而COPD患者中OSAHS的发病率较普通人高2~10倍[9]。本研究中,COPD患者OSAHS发生率为55.34%,提示COPD患者并发OSAHS风险较高。
临床研究已经证实,以EOS为代表的多种炎症细胞均可参与COPD的发病中,其可引起气道上皮细胞炎症性损伤,降低气道通气功能[10]。李亚洲等[11]研究结果显示,与健康志愿者比较,外周血EOS水平在稳定期COPD、急性加重COPD患者中显著上升,且在急性加重COPD患者中升高更多,EOS高水平者诱导痰中炎性因子水平高于EOS低水平者,提示外周血EOS在COPD的发生与发展中具有重要作用,且外周血EOS水平与患者气道炎症反应有关。而OSAHS又与COPD有着相同病理基础,因此,外周血EOS可能与COPD患者并发OSAHS也存在一定关系。
本研究结果发现,高EOS组患者OSAHS发生率高于低EOS组(P<0.05),提示外周血EOS与COPD患者并发OSAHS密切相关,且经点二列相关性结果证实。分析原因为,EOS主要在骨髓造血干细胞中生成,可通过血液进行全身迁移,并能在创伤、病菌感染等特定条件刺激下被招募到肺部,参与肺部免疫炎症反应[12]。当COPD患者外周血EOS水平较高时,可增加其迁移并积聚于肺部、气道等部位的含量,并刺激细胞因子、趋化因子等炎症介质的合成与释放,介导免疫炎症反应,损伤气道上皮细胞,增加气道高反应性及气道黏液产物,引起气道阻塞,降低气道通气功能,从而增加OSAHS发生风险[13]。同时,EOS水平过高还可释放嗜酸粒细胞阳离子蛋白、嗜酸细胞源神经毒素等蛋白,这些蛋白对气道上皮细胞有一定细胞毒性,可导致气道黏膜分泌物增加,并减少纤毛运动,降低气道平滑肌收缩功能,最终引起气道持续性受阻,降低气道通气功能,引发OSAHS[14]。此外,刘虎等[15]对哮喘-慢性阻塞性肺气肿重叠患者相关资料进行分析发现,外周血EOS升高患者外周血C反应蛋白水平较正常患者高,肺功能指标较正常患者差。而本研究也发现,高EOS组患者C反应蛋白水平,以及GOLD分级3级、4级比例均高于低EOS组(P<0.05),这也与刘虎等[15]研究结果相似。这提示,外周血EOS会增加呼吸道疾病患者炎症反应程度,促进疾病加重,降低机体肺功能。而患者肺功能的降低会进一步影响气道通气功能,增加OSAHS发生风险。
本研究进一步进行ROC曲线分析发现,外周血EOS评估COPD患者并发OSAHS的曲线下面积为0.721,具有一定评估价值,提示临床可通过外周血EOS水平初步筛选COPD患者中并发OSAHS的高风险人群。
综上所述,外周血EOS与COPD患者并发OSAHS密切相关,其水平升高会增加患者OSAHS发生风险,临床可据此早期评估预测患者OSAHS发生风险。
