肢体毁损伤体外循环氧合支持系统的研发思考
2024-05-10杨晓江综述包倪荣审校
袁 涛,杨晓江综述,包倪荣审校
0 引 言
1985年,Gregory等[1]指出同一肢体的血管、神经、骨及覆盖的软组织4个重要结构中有3种或3种以上受到明显损伤会对肢体存活造成严重威胁。临床上普遍认为肢体毁损伤是由高能量、高速度、强暴力因素造成的切割、撕裂或挤压等损伤,如交通伤、爆炸伤、碾压伤等,多伴有血管、神经、肌肉严重损伤和粉碎性骨折,可合并其他危及生命的多发伤,甚至可能需要截肢[2-4]。20世纪之前,肢体毁损伤几乎都是由战创伤引起,而随着城镇化建设和机械化生产的推广以及交通运输业的发展,肢体毁损性伤发病率逐渐增加,但其仍然是战时伤员死亡和残疾的重要原因之一[5]。本文主要对肢体毁损伤体外循环氧合支持系统的研发涉及的相关基础研究现状进行汇总分析,旨在为研究提供切实可行的思路,证实该项目的可行性。
1 肢体毁损伤体外循环氧合支持系统的研究现状
1.1 血管损伤是肢体毁损伤保肢失败的重要原因无论是战创伤还是平时创伤,血管损伤导致的出血或肢体缺血是导致肢体毁损伤伤员死亡或截肢的重要原因[6]。而血管损伤的程度和肢体缺血的时间也是毁损伤伤员能否保肢的重要影响因素,Korompilias等[7]回顾性分析了1996年至2005年9年间院其治疗的63例高能量肢体毁损伤患者的临床资料,发现其中62例均伴有大血管损伤和肢体缺血,对其中10例保肢失败的大面积肢体创伤患者进行分析,结果显示3例患者死亡,其余7例患者在术后15天内截肢,截肢的主要原因包括脓毒血症、动静脉血栓等。在开放性毁损伤中,由于创面引起的动脉断裂和静脉血管血栓形成都会造成肢体的血供减少,从而引起肢体组织缺血坏死。而闭合性毁损伤多见于高能量的挤压伤、钝器伤等,由于骨筋膜室内压力过大而导致室内血流灌注减少引起骨筋膜室综合征(acute compartment syndrome,ACS),如果未及时诊断和治疗,缺血时间越长,细胞代谢的紊乱可能会引起永久性肌肉、神经损伤和缺血再灌注综合征。
1.2肢体毁损伤保肢的关键在于伤后早期血供的维持肢体缺血尤其是温血缺血时间,是影响患肢预后的重要因素之一[8]。在伴有动脉损伤的毁损伤患者中,伤后6~8 h动脉重建手术往往可取得较好结果,而伤后8 h进行血运重建则会大大增加截肢的风险,为保证伤者患肢的功能,血管重建应尽量在伤后6 h进行[9-10]。从结扎损伤的血管到初级修复的转变导致相应的毁损伤患者的截肢率从“二战”时的50%下降到平民的不到2%[11]。但在早期战争中,由于战场环境,伤员转运到基地医院的时间延长,错过修复的最佳时间,加之肢体缺血时间较长,由此导致的截肢也不在少数。尽管现代战争如伊拉克战争和阿富汗战争中武器的杀伤力显著增加,但保肢率却似乎不协调地上升,这其中除了防护装备和医疗技术的升级外,另一重大原因是在伤员从战场转运到后方第一梯队医院的过程中院前治疗的提升,这个过程中采取的一系列措施可大大提高患者的生存率及肢体存活率[12-13]。
1.3肢体毁损伤需要完整的损伤控制系统经过海湾战争、阿富汗战争后发现,现代战争条件下,参战人员伤情更重,伤情更为复杂,对现场救治、后方转运和伤员后期康复的理论技术均要求更高。而在渡海登岛条件下,肢体毁损伤的救治需要更完整的损伤控制系统。针对闭合性毁损伤,ACS的早期诊断和及时减压是避免伤员患肢缺血坏死的重要环节。对于开放性毁损伤,损伤血管快速定位、超声引导下穿刺溶栓、保证患肢血液循环通常是控制伤员肢体损伤的完整链条,而其中的关键在于创伤肢体血液循环的维持。
目前,ACS的诊断是以临床症状和体征为主,经典的临床症状是5P,即疼痛(Pain)、苍白(Pallor),感觉异常(Paresthesias),无脉(Pulseless),瘫痪(Paralysis)[14]。但是这些症状缺乏特异性和敏感性,依赖医师的经验。压力监测通过客观地评估每个筋膜室内的压力成为一种辅助诊断的方法,但是因假阳性率稍高且观测者之间的测量差异较为明显,在常规使用过程中仍存在争议[15-17]。近红外光谱(near-infrared spectroscopy, NIRS)是一种用于评估氧化性肌肉血红蛋白和肌红蛋白水平的非侵入性方法。NIRS测量血流的原理是基于身体对创伤的反应会增加流向受伤部位的血流,当血流量减少时,可以看到局部血氧饱和度和肌肉血氧张力降低,类似于测量皮下组织中的氧饱和度。但是Schmidt等[18]的研究发现不仅在受伤的肢体中,甚至在对照组肢体中,获取连续NIRS数据的可靠性均很差,其诊断价值有待进一步研究。近年来,超声在骨筋膜室综合征的诊断中得到广泛的关注,一系列试验表明超声具有很好的前景。Toyoshima等[19]发现剪切波的传播速度随着筋膜室内压力的增加成线性比例增加,存在很强的相关性。这种非侵入性技术可能帮助外科医师早期检测、监测和预测筋膜室内压。在超声诊断基础伤研发适合渡海登岛环境骨筋膜室压力无创监测系统可以早期诊断早期治疗,避免肌肉坏死甚至截肢的发生。
目前对于患者血管的处理有血管结扎和临时性血管分流等,血管结扎虽能止血,但同样无法解决肢体血供不足的问题[20]。临时性血管分流这种创伤较大的手术操作不太适合在复杂战场转运环境中进行[21-22]。我们拟提出一种创伤肢体体外氧合血液净化技术,通过提高创伤肢端氧供,改善微循环,清除局部代谢废物,实现早期综合性损伤控制,确保危重伤员转运途中治疗的连续性,为基地医院成功救治打下坚实基础,避免患肢坏死、截肢,减少潜在可存活伤亡或致残。组合式CVVH-体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)技术可实现心、肺、肾功能支持,用于救治心胸损伤术后、重症肺部感染和多器官功能障碍等危重症伤员[23]。ECMO治疗期间可出现炎症风暴,联合RRT可清除炎症介质和细胞因子,降低单核巨噬细胞活性,并促使循环中促凋亡因子活性,有助于机体免疫稳态重建,同时可精确控制容量负荷,有效改善心肺功能和临床预后。而创伤肢体体外氧合血液净化技术在组合式CVVH-ECMO技术的基础上创新,提高下肢损伤组织氧供,同时清除肌红蛋白、炎症介质和细胞因子,改善下肢微循环,稳定内环境,避免伤员后送期间肢体坏死。根据下肢血液循环特点,选用婴儿型中空纤维膜式氧合器作为氧合器[24],静态预充量仅55 mL,氧合材料为聚甲基戊烯,氧合面积0.32 m2,在氧流量3L/min时,可满足下肢氧供需求;同时选用儿童透析器作为血滤器。应用甲磺酸萘莫司他抗凝,体外循环开始前20 mg萘莫司他溶于500 mL等渗盐水预充血液回路,体外循环开始后,以20~50 mg/h剂量持续泵入抗凝。氧合器预充排气后使用红细胞替换预充基础液,填充体外循环管路、氧合器和血滤器,避免伤员治疗过程中血流动力学波动。治疗穿刺针选择套管针,穿刺位点根据创伤部位选择,动脉端为股静脉、大隐静脉或腘静脉,静脉端为腘动脉、胫前动脉、胫后动脉或腓动脉。静脉端为下肢动脉,需要血泵提供回输动力,促进下肢血液循环。需要动物实验明确血流量和氧流量治疗剂量。
2 创伤肢体体外氧合血液净化装置设计
采用套管针直接穿刺下肢动脉和静脉为血管通路,体外循环采用甲磺酸萘莫司他或联合局部枸橼酸抗凝,维持APTT在60~80 s或全血活化凝血时间160~180 s。血液净化装置均为便携式连续性血液净化装置。在等渗盐水预冲滤器和管路后,再应用浓缩红细胞预充体外循环管路。全血流经中空纤维膜式氧合器,氧浓度为100%,氧流量为3 L/min,血流速度为40~60 mL/min,再经血滤器滤过,超滤率为20 mL/min,氧合后的血液回输下肢动脉,工作流程图见图1。治疗时间8~12 h。
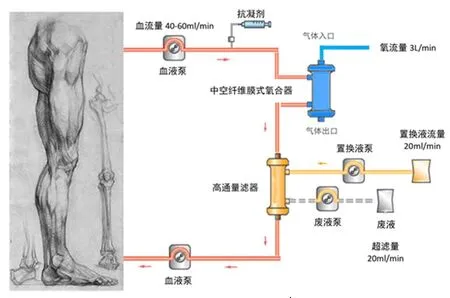
图1 创伤肢体体外氧合血液净化技术工作流程图
在转运过程中给予伤员患肢有效的处理是肢体毁损伤保肢成功的关键环节。对于闭合性肢体毁损伤,通过建立骨筋膜室压力无创监测系统,早发现早诊断,避免骨筋膜室综合征的发生及恶化。如发现筋膜室压力增高,及时通过微创切口减压技术进行减压,防止肌肉缺血坏死,并缩短伤口愈合时间。对于开放性肢体毁损伤,通过肢体节段划分体外定位研究快速定位损伤血管,利用超声探查确认血管损伤平面,并在超声引导下进行穿刺溶栓,研发创伤肢体体外氧合血液净化技术,建立人工体外循环通道,提高创伤肢端氧供,改善微循环,清除局部代谢废物,为基地医院成功救治打下坚实基础。
3 展 望
肢体毁损伤体外循环氧合支持系统研发研究的提出有待通过实践验证,并且需要大量的理论基础做支撑,目前仅处于构思阶段,需要进一步规划设计和深入研究。肢体毁损伤体外循环氧合支持系统的研发,在理论上可行性,技术上可行性较高,其不足之处是在战场恶劣环境下可操作性的局限性非常明显,但是经过多学科的协作,如肾内科、心胸外科在当前治疗设备的基础上进行优化升级,并简化循环系统的操作程序,优化其改善微循环系统设备的效率,最终使其操作上学习曲线短,方便战场单兵携带或者救援人员的紧急救治使用,从而有效提高毁损伤肢体的存活时间。该项目开展的同时还可开发骨筋膜室压力无创检测系统,单次/持续检测骨筋膜室压力,提前预防骨筋膜室综合征,并做到早发现、早诊断,并且可研发骨筋膜室微创减压技术,治疗的同时促进伤口早期愈合。在研究该系统的过程中,还需要探索肢体节段划分体外定位研究体系,从而快速定位损伤血管。可借助超声技术,在超声的引导下对肢体血管损伤平面穿刺溶栓技术,恢复损伤血管的通畅。总之,研发肢体毁损伤体外循环氧合支持系统的研发,在理论上有心脏体外循环和肾脏透析技术做为基础,技术上可行性较高,其应用价值广泛,可改善离断肢体或毁损肢体的血液循环,为伤残肢体的存活保留提供机会,可有效降低肢体毁损伤的伤残率,极大改善伤员的生活质量。
