X射线对胃癌细胞和人脐静脉内皮细胞LOX家族成员的不同影响
2024-05-10王欣怡牛海亚杨新燕刘一凡王凯博徐传皓
王欣怡,牛海亚,邓 红,杨新燕,刘一凡,王凯博,徐传皓,韩 梅
0 引 言
X射线在放射治疗、生物医学成像及临床医疗设备中均得到了广泛的应用[1]。在临床诊疗中,X射线导致细胞毒性的同时,也造成细胞基因组不稳定,某些基因发生变异、异常表达等[2-3]。由于X射线不能区分正常细胞与肿瘤细胞,其影响可能波及肿瘤周围其他细胞,如血管内皮细胞。如果血管内皮细胞损伤,直接影响辐射区域内的血供,对肿瘤细胞可抑制其生长发育,但对正常细胞则会产生不利影响。因此研究X射线辐射区域肿瘤细胞和血管内皮细胞基因和蛋白的改变,对X射线应用具有重要意义。
赖氨酰氧化酶(lysyl oxidase, LOX)家族包括LOX和赖氨酰氧化酶样蛋白1~4 (lysyl oxidase-like protein 1~4, LOXL1~4),是一类铜依赖性单胺氧化酶,能够稳定细胞外基质,保持其结构的完整性,参与发育、组织修复和重塑、癌症和肿瘤转移等多种生理病理过程[4-6]。本课题组前期的研究表明LOX可促进胃癌细胞的迁移、异质黏附、血管生成,以促进胃癌的转移[7-8];同时发现丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路中的两个分支 p38MAPK 和 ERK1/2 MAPK可调节胃癌细胞LOX表达[9]。现已公认LOX是肿瘤治疗和预防转移的新靶点。但辐射,尤其是X射线对不同细胞LOX及其家族成员的影响及其机制尚未完全阐明。本研究采用不同剂量X射线分别辐射人低分化黏液样胃腺癌细胞MGC-803和HUVEC,比较细胞LOX及其家族成员基因、胞内蛋白、分泌蛋白和酶活性的变化,并初步探讨其机制,为胃癌放疗后转移机制、转移相关标志物的研究提供新线索。
1 材料与方法
1.1 细胞和主要试剂MGC-803和HUVE(中科院上海细胞库),细胞裂解液试剂盒(上海江莱生物有限公司),2×SYBR Green qPCR Master Mix(G3321,Servicebio),LOX ELISA 试剂盒(CK-E10984,江莱生物公司),LOXL1 ELISA 试剂盒(CK-E18380,江莱生物公司),LOXL2 ELISA 试剂盒(CK-E16044,江莱生物公司),LOXL3 ELISA 试剂盒(CK-E16108,江莱生物公司),LOXL4 ELISA 试剂盒(CK-E18381,江莱生物公司),Cell-Based ERK1/2(Thr202/Tyr204) ELISA kit(6209,RayBio),Cell-Based p38MAPK(T180/Y182) ELISA kit(6214,RayBio),兔抗人LOX多克隆抗体(Ab31238,Abcam公司/美国),兔抗人LOXL1多克隆抗体(Ab81488,Abcam公司/美国),兔抗人LOXL2多克隆抗体(Ab179810 ,Abcam公司/美国),兔抗人LOXL3多克隆抗体(sc-377216,Abcam公司/美国),兔抗人LOXL4多克隆抗体(Ab88186,Abcam公司/美国)。
1.2细胞培养将MGC-803和HUVEC细胞培养于含10%胎牛血清、50 μL/100 mL青霉素、125 μL/100 mL庆大霉素的 DMEM培养液中,置于 37 ℃、5% CO2的孵箱中生长。待细胞生长密度达80%~90%进行细胞传代。
1.3X射线辐射及LD50的测定准备96孔板,每孔加入细胞悬液100 μL,含1×104个/孔。细胞贴壁后换无血清培养基暴露于X射线,辐射剂量分别为0、2、4、6、8和10 Gy,每个剂量设置3个复孔。辐射后23 h,每孔加入CCK-8溶液继续培养1 h,酶标仪在450 nm测量A值。按公式计算细胞致死率,以细胞致死率为纵轴,辐射剂量为横轴,绘制曲线,用SPSS 21.0 Biss法计算LD50。致死率公式如下:
致死率=(对照组A值-辐射组A值)/对照组A值×100%
1.4Realtime PCR检测LOX家族成员 mRNA 丰度X射线辐射后的细胞,用 RNA提取试剂盒提取细胞的总RNA,采用2×SYBR Green qPCR试剂盒,按照反转录反应体系设计、合成引物。PCR扩增 95℃ 10 min;95 ℃ 15 s ,60 ℃ 30 s,40个循环。以GAPDH为内参,目的基因的相对表达量=2-△△CT,公式如下:
△CT =CT(目的基因)-CT(内参基因)
△△CT =△CT(实验组)- △CT(对照组)
目的基因引物序列:LOX上游引物5'-TGGATGAGTTTAGCCACTATGACC-3',下游引物5'-TAACAGCCAGGACTCAATCCC-3';LOXL1 上游引物5'-GTACCCGCCCTACGCCAACCC-3',下游引物5'-ACTCGTCCATGCTGTGGTAATGCT-3';LOXL2 上游引物5'-ATGTACCGCCA TGACATCGACT-3',下游引物5'-ATCGGATTCTGCAACCTCGAAG-3';LOXL3 上游引物5'-GTCTGTGACCGCAAGTGGG-3',下游引物5'-AATCCTGGCTATGTGAACAATCC-3';LOXL4 上游引物5'-CTGCCTCTCCAAGTCTGCGGAT-3',下游引物5'-CAAACCCAGCTATCG CGTCCAGT-3';GAPDH上游引物5'-GGAAGCTTGTCATCAATGGAAATC-3',下游引物5'-TGATGACCCTTTTGGCTCCC-3'。
1.5Western blot 检测细胞中LOX家族成员蛋白相对含量按照细胞裂解液试剂盒说明裂解X射线辐射后的细胞并提取细胞总蛋白,测定蛋白浓度。配制SDS-PAGE 浓缩胶和分离胶,每孔蛋白上样量和体积相同。电泳后,转移至 PVDF 膜上,用脱脂奶粉封闭3 h后分别加入相应抗体。LOX、LOXL1、LOXL2、LOXL3、p-p38抗体稀释比例均为1∶1000,LOXL4抗体稀释比例为1∶3000,p-Erk1/2抗体稀释比例为1∶2000,β-actin抗体稀释比例为1∶5000。室温孵育1 h后4 ℃过夜。洗膜后分别加入相应二抗,室温孵育2 h。洗膜后按照显影曝光试剂盒说明书曝光。将膜置于凝胶图像分析系统进行扫描,用Image J测灰度值,蛋白相对表达量=目的蛋白表达强度/内参(β-actin) 强度。
1.6ELISA检测细胞培养上清中LOX家族成员分泌量按照ELISA试剂盒说明书操作。空白孔不加样品及酶标试剂,待测样品孔每孔加5倍稀释后的细胞上清50 μL和酶标试剂100 μL。置于37 ℃温箱孵育60 min,加入显色剂后再次避光孵育15 min,加终止液终止反应,在450 nm波长测A值。以A值为纵坐标,标准品浓度为横坐标,绘标准曲线。根据标准曲线计算样品中LOX家族酶浓度,再乘以稀释倍数,即为细胞上清中LOX家族酶的实际浓度。
1.7Amplex Red荧光法检测LOX酶活性按照LOX 活性试剂盒说明配制反应混合物和标准品。用Assay Buffer将3%H2O2稀释为不同浓度梯度作为标准品,具体浓度为0.6、0.5、0.4、0.3、0.2和0.1 μg/μL。准备96孔板,加样分为空白孔、标准孔、样本孔。空白孔加入50 μL Assay Buffe,标准孔加入不同浓度的H2O2标准品,每孔50 μL。样本孔加入X射线辐射后的细胞上清,每孔50 μL。加入反应混合物50 μL/孔,充分摇匀,37 ℃避光孵育30 min。用酶标仪在波长576 nm测A值,用H2O2标准品A值为纵坐标,浓度为横坐标,绘标准曲线。根据标准曲线计算各样本孔LOX相对氧化酶活性。

2 结 果
2.1 X射线辐射LD50的确定0、2、4、6、8和10 Gy剂量X射线辐射分别辐射 MGC-803和HUVEC细胞,细胞致死率随X射线剂量增大而增加,见图1。结果提示MGC-803的LD50为8.2 Gy,HUVEC的LD50为6 Gy。后续实验样品选用X射线辐射0、2、4和6 Gy剂量组的MGC-803和HUVEC细胞进行测试。
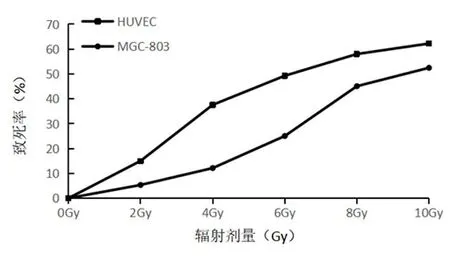
图1 不同剂量X射线辐射后两种细胞致死率比较
2.2暴露于X射线后两种细胞LOX家族成员mRNA变化MGC-803细胞经2、4、6 Gy X射线辐射后,LOX mRNA的相对丰度均高于0 Gy组 (P<0.05), LOXL1、LOXL2和LOXL4 mRNA的相对丰度均低于0 Gy组(P<0.05)。见表1。

表1 MGC-803暴露于X射线后LOX家族mRNA相对丰度比较
HUVEC的各剂量组LOX mRNA的相对丰度均高于0 Gy组 (P<0.05);2 Gy组LOXL1、LOXL2和LOXL3 mRNA的相对丰度高于0 Gy组 (P<0.05);4 Gy组LOXL1、LOXL3和LOXL4 mRNA的相对丰度高于0 Gy组(P<0.05); 6 Gy组LOXL2和LOXL4 mRNA的相对丰度高于0 Gy 组(P<0.05)。见表2。

表2 HUVEC暴露于X射线后LOX家族成员mRNA相对丰度比较
2.3X射线辐射后两种细胞中LOX家族成员蛋白相对表达量比较MGC-803细胞的各剂量组LOX、 LOXL4蛋白相对表达量均低于0 Gy组(P<0.05);4 Gy组、6 Gy组LOXL1和LOXL3蛋白相对表达量较0 Gy组低(P<0.05);2 Gy组、4 Gy组LOXL2蛋白相对表达量较0 Gy组低(P<0.05);但2 Gy 组LOXL1和LOXL3蛋白相对表达量较0 Gy组高。见图2。
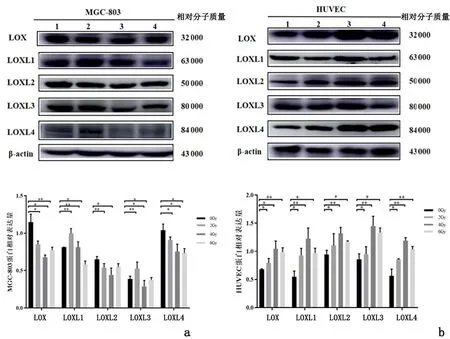
1:0 Gy组;2:2 Gy组;3:4 Gy组;4:6 Gy组
HUVEC细胞的2 Gy组、4 Gy组和6 Gy组LOX、LOXL1、LOXL2、LOXL3和LOXL4蛋白相对表达量均较0 Gy组高(P<0.05)。见图2。
2.4暴露于X射线后两种细胞LOX家族成员酶分泌量比较MGC-803细胞的2 Gy组、4 Gy组LOX和LOXL4分泌量较0 Gy组少(P<0.05);2 Gy组、4 Gy组、6 Gy 组LOXL1分泌量较0Gy组少(P<0.05);2 Gy组LOXL2分泌量较0 Gy组多(P<0.05),而4 Gy组较0 Gy组少(P<0.05);2 Gy组LOXL3分泌量较0 Gy组多(P<0.05)。见表3。HUVEC细胞的4 Gy 组LOX分泌量高于0 Gy组(P<0.05);各剂量组X射线辐射后LOXL1和LOXL3分泌量较0 Gy组高(P<0.05),LOXL3随辐射剂量增大而增高;4 Gy组和6 Gy X组LOXL2和LOXL4分泌量高于0 Gy组(P<0.05)。见表4。

表3 MGC-803暴露于X射线后LOX家族成员酶分泌量的变化

表4 HUVEC暴露于X射线后LOX家族成员酶分泌量的变化
2.5暴露于X射线后两种细胞LOX酶活性的变化MGC-803细胞 LOX酶活性在X射线辐射前后差异无统计学意义(P<0.05)。HUVEC的LOX酶活性,2 Gy组和6 Gy组高于0 Gy组(P<0.05)。见表5。

表5 X射线辐射MGC-803和HUVEC后LOX酶活性变化
2.6暴露于X射线后两种细胞p38MAPK和Erk1/2 MAPK变化MGC-803细胞的2 Gy组、6 Gy组p-p38、p-p42、p-p44均较0 Gy组上调(P<0.05);4 Gy组p-p38较0 Gy组上调(P<0.05)。HUVEC细胞的2、4、6 Gy 组p-p38、 p-p42、 p-p44均较0 Gy组上调(P<0.05),见图3。
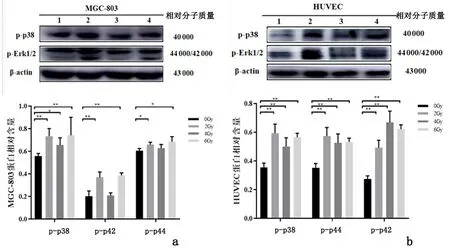
1:0 Gy组;2:2 Gy组;3:4 Gy组;4:6 Gy组
3 讨 论
不同器官、组织和细胞对于X射线辐射的敏感性不同,甚至同一肿瘤中不同细胞的敏感性也不同[10-11]。本研究发现,HUVEC暴露于X射线的 LD50较胃癌细胞MGC-803更低,提示在相同剂量时血管内皮细胞可能对X射线辐射更敏感,更容易被损伤。
X射线对机体的作用是多方面且复杂的,既可直接作用于DNA、蛋白质及酶类等生物大分子引起电离激发,使化学键断裂、分子变性和细胞结构破坏;又可作用于机体内水分子,使其发生水解并产生大量自由基,间接使组织细胞发生变性和坏死,以致整个机体出现多系统功能障碍[12]。受辐射细胞还可表现为基因组不稳定,某些基因变异、异常表达等[3],造成细胞生物学特性的改变。本研究观察了X射线辐射对胃癌细胞MGC-803和血管内皮细胞HUVEC产生LOX家族成员的影响。结果表明,X射线辐射对两种细胞的LOX家族成员产生的影响不同,对胃癌细胞MGC-803的LOX、LOXL1、LOXL2、LOXL4的蛋白产生和分泌有不同程度抑制作用,而对HUVEC的LOX、LOXL1、LOXL2、LOXL3和LOXL4的蛋白产生和分泌均有不同程度的诱导作用。由此推测X射线可以通过对两种细胞LOX家族成员的不同影响而使其生物学功能发生不同变化。
LOX家族成员是一组单胺氧化酶,除相似的基本功能外,五种成员在分布和生物学作用上的差异尚未完全阐明。在恶性肿瘤中,有研究发现LOX家族成员的表达与患者肿瘤转移和总生存率相关,尤其是LOX和LOXL2可促进体内肿瘤生长和进展,癌细胞侵袭,促进远处转移[13]。Kasashima 等[14]研究发现LOXL1、LOXL3、LOXL4的表达与原发性胃癌浸润、淋巴结转移有关,LOXL1阳性的胃癌患者的总生存期显著低于LOXL1阴性表达患者。LOXL3在人体正常组织中差异表达,在胃癌细胞中定位于胞核,与胃癌的侵袭和预后不良相关,促进肿瘤侵袭和转移。本研究显示,胃癌细胞MGC-803经X射线辐射后,LOX、LOXL1、LOXL2和LOXL4表达以下调趋势为主,尤其是4 Gy组,但LOX酶活性的变化无统计学意义。提示一定剂量X射线辐射可能通过抑制这几种酶的产生和分泌抑制胃癌细胞的侵袭转移等特性,而酶活性无明显改变。同时,LOX及其家族成员的产生和分泌并未出现辐射剂量依赖性改变,可能是因为辐射对细胞的影响较复杂,不是单一作用。Shen等[15]报道LOX在肺癌、结直肠癌、胶质瘤、表皮样癌等多种癌细胞中X射线辐射后表达增加,与本文结果不一致,可能与辐射剂量和细胞种类不同有关。此外,本研究结果中LOX的mRNA在各剂量X射线辐射后上调,与细胞蛋白表达与分泌不一致,可能是因为辐射后细胞的转录和翻译不同步所致;而LOXL3在2 Gy X射线辐射下mRNA、蛋白和分泌均上调,其意义还有待进一步研究。
LOX及其家族成员也参与血管生成。有研究发现LOX通过激活血小板衍生生长因子受体信号驱动血管内皮生长因子的表达和肿瘤的血管生成[16]。LOX、LOXL1、LOXL2和LOXL4可通过上调血管内皮生长因子或其受体而促进血管生成[17-18]。本研究中,HUVEC经X射线辐射后LOX家族成员的转录、合成和分泌均表现为上调,以4 Gy组明显,LOX酶活性也增强。LOX及其家族成员的产生和分泌同样未出现辐射剂量依赖性改变。提示X射线辐射可能通过增加LOX家族成员的产生和酶活性促进血管生成,增加血管弹性,修复并维持血管完整性。但LOX家族各成员之间的差异还需要更深入的研究。
丝裂原活化蛋白激酶(mitogen-activated protein kinas ses,MAPK)共分为4个亚族:ERK、p38、JNK 和 ERK5[19],该信号通路是研究较多的经典信号通路,已知有表皮样生长因子、血管生成素、血管内皮生长因子、成纤维细胞生长因子、基质金属蛋白酶等的作用与此信号通路相关[20]。本课题组前期的研究也发现MAPK信号通路中的两个分支p38MAPK和Erk1/2 MAPK可调节胃癌细胞LOX表达[9]。本研究结果证实,X射线辐射可使两种细胞p-Erk1/2、p-p38不同程度上调。提示一定剂量X射线辐射可激活Erk1/2 MAPK和p38 MAPK通路,但与两种细胞的LOX家族成员相反的表达趋势无法对应,可能与LOX家族成员表达还受其他信号通路的影响有关,仍需进一步研究。
本研究结果展示了胃癌细胞和血管内皮细胞在X射线辐射下LOX家族成员的不同表达模式,为了解不同细胞对于X射线辐射的反应,为急性电离辐射损伤、辐射防护及剂量研究提供了依据。
