抗CCL20单克隆抗体对血清淀粉样蛋白A相关的结节病中促炎性细胞因子的抑制作用
2024-05-10马成星那雨琪丁晶晶
魏 佳,马成星,郑 颖,那雨琪,丁晶晶
0 引 言
结节病是一种病因不明的系统性炎症性疾病,可累及体内几乎所有的器官,其典型病理特征是非干酪样肉芽肿的形成[1]。结节病以中青年发病为主,平均发病年龄约为50岁,女性发病率略高于男性,约有10%~30%的患者表现为慢性、进展性病程,最终发生不可逆的肺纤维化[2-3]。目前,临床上尚缺乏结节病的特异性检验标志物和有针对性的治疗方法,这使得对结节病的管理仍然具有挑战性[4]。血清淀粉样蛋白A(serumamyloid A, SAA)是一种由肝脏合成的急性时相反应蛋白,在结节病的肉芽肿组织和外周血中异常增高[5-6]。SAA可以上调趋化因子配体20(C-C motif chemokine ligand 20,CCL20)的表达,CCL20是一种趋化因子,可选择性地吸引树突状细胞、效应/记忆T淋巴细胞和幼稚B细胞,其通过结合和激活趋化因子受体6(chemokine receptor 6,CCR6),诱导Treg细胞和Th17细胞的迁移[7-8]。结节病中存在CCR6/CCL20趋化因子轴异常激活,CCR6在结节病肺组织中的Th17淋巴细胞上高表达,并通过其与配体CCL20的相互作用而调节Th17细胞的功能[9-10]。抗CCL20单克隆抗体可通过与淋巴细胞中的CCR6结合,纠正失衡的Th1/Th2与Th17/Treg细胞反应[11]。但抗CCL20单克隆抗体对结节病外周血单个核细胞(peripheral blood mononuclear cells, PBMC)中Th17相关的免疫紊乱是否有作用,其作用机制是否与SAA的高表达相关,目前尚不明确。本研究旨在探讨抗CCL20单克隆抗体是否能缓解结节病PBMC中Th17相关的的促炎性细胞因子的表达,且其作用是否与高水平的SAA作用相关,以便于更深入地了解结节病的发病机制,为其治疗提供支持。
1 材料与方法
1.1 主要仪器与试剂人淋巴细胞分离液(索莱宝,P8900-200),SAA(SIGMA,SRP4324),BAY11-7082(BAY),CCL20单抗(RD,AF360-SP),地塞米松(凯基,KGP11100)。人TGF-β1ELISA试剂盒(批号:EH010-48),人IL-23ELISA试剂盒(批号:EH035-48),人IL-6ELISA试剂盒(批号:EH004-48),人IL-17A ELISA试剂盒(批号:EHC170.48),人CCL20 ELISA试剂盒(批号:HM10367),人HMGB1 ELISA试剂盒(批号:SEA399Hu)。Trizol(Aidlab, 252250AX),HiScriptⅡ Q RT SuperMix for qPCR(Q223-01),ChamQ Universal SYBR qPCR Master Mix(Q711-02)购于南京诺唯赞生物科技股份有限公司。RORγt Antibody(Abcam, ab113434),p-STAT3 Antibody(Abcam, ab76315),p-p85 Antibody(CST, 4228T),β-actin Antibody(Abcam, ab8226),HRP标记二抗(碧云天),RIPA细胞快速裂解液(Solarbio, R0010),BCA蛋白定量试剂盒(Thermos, PICPI23223),蛋白预染Marker(Fermentas, SM1811)。引物序列见表1。

表1 RT-PCR所用引物序列
1.2细胞分组与培养
1.2.1 PBMC的提取取正常人与结节病患者静脉血各6份,每份20 mL置于抗凝管内,于2 h内分离获取PBMC,步骤如下:①将20 mL全血置于50 mL无菌离心管内,加入等体积的1×PBS,混匀。②取15 mL无菌离心管8支,各管内加入5 mL淋巴细胞分离液。③分别取5 mL稀释的全血缓慢加入各管淋巴细胞分离液中,切勿破坏液面。④室温下以离心半径10 cm、2000 r/min离心20 min。⑤离心后管内分成上中下4层,小心吸取上中层界面中间的白色云雾层,即为PBMC。⑥吸取PBMC至灭菌离心管中,使用1×PBS洗涤,以离心半径10 cm、室温下1000 r/min离心10 min后弃去上清,重复清洗两次。正常人与结节病患者PBMC由南京鼓楼医院提供,伦理号(2016-138-01)。
1.2.2PBMC的分组与处理将所提取的PBMC以每孔1×105/cm2接种于6孔板中,并进行如下分组(n=6):①空白对照组:即正常人PBMC;②PBMC对照组:即患者PBMC;③PBMC+SAA刺激组:患者PBMC中加入5 μg/mL SAA进行共培养;④PBMC+SAA+NF-κB抑制剂BAY11-7082组:患者PBMC中加入5 μg/mL SAA和1 ng/mL BAY11-7082进行共培养;⑤PBMC+SAA+抗CCL20单抗组:患者PBMC中加入5 μg/mL SAA和0.5 ng/mL抗CCL20单抗进行共培养;⑥PBMC+地塞米松干预组:患者PBMC中加入1 μmol/L地塞米松进行共培养。各组细胞置于含有1%的青霉素链霉素以及20%胎牛血清(FBS)的DMEM培养基中,37 ℃、5% CO2的培养箱中分别培养48 h。
1.3酶联免疫吸附实验检测IL-17A、IL-6、IL-23、CCL20及TGF-β1水平收集各组细胞上清培养液,随后按照试剂盒说明书分别检测与Th17细胞相关的促炎性细胞因子IL-17A、IL-6、IL-23、CCL20及TGF-β1的水平,使用多功能酶标仪于450nm处测定吸光度,实验重复进行3次。
1.4逆转录定量PCR(RT-qPCR)使用Trizol(Aidlab)从各组细胞中提取总RNA。按反转录试剂盒说明书,以总RNA为模板,将mRNA反转录为cDNA,反应条件为50 ℃ 15 min,85 ℃ 5s。以cDNA为模板构建PT-PCR反应体系,95 ℃ 30 s,95 ℃ 10 s,60 ℃ 30 s,40个循环,引物序列见表1。用GAPDH作为内参,采用2-ΔΔct法计算mRNA的表达量。
1.5蛋白质免疫印迹检测收集培养48 h后的各组细胞,用含有1%PMSF的RIPA裂解缓冲液裂解细胞,提取蛋白。使用BCA试剂盒测定蛋白浓度。进行上样,电泳,转膜,封闭,一抗孵育过夜(p-NF-κB-p65稀释比为1∶1000,β-actin稀释比例为1∶5000),TBST缓冲液洗涤3次,每次5 min;与HRP标记的二抗(1∶5000)室温孵育1 h,TBST洗涤3次后,用ECL发光液进行曝光,用ImageJ软件分析条带的灰度值。实验重复进行3次。

2 结 果
2.1 SAA对结节病PBMC中Th17/Treg相关细胞因子水平的影响各组PBMC在48 h培养后的上清液中,PBMC对照组的IL-17A、IL-23和CCL20的水平较空白对照组显著升高(P<0.01)。而PBMC+SAA组的IL-17A、IL-23、IL-6和CCL20的水平较PBMC对照组显著升高(均P<0.01)。此外,PBMC对照组中与Treg相关的TGF-β1浓度较空白对照组下降(P<0.05),而PBMC+SAA组中的TGF-β1浓度较PBMC对照组下降(P<0.01)。见图1。PBMC对照组中CCR6、IL-17A、ROR-γt和Foxp3的转录水平与空白对照组差异无统计学意义(均P>0.05)。PBMC+SAA组的CCR6、IL-17A、ROR-γt的转录水平较PBMC对照组显著升高(均P<0.01),而Foxp3的转录水平较PBMC对照组显著降低(P<0.01)。见图2。

1:空白对照组;2:PBMC对照组;3:PBMC+SAA组;4:PBMC+SAA+NF-κB抑制剂BAY11-7082组;5:PBMC+SAA+抗CCL20单抗组;6:PBMC+地塞米松干预组
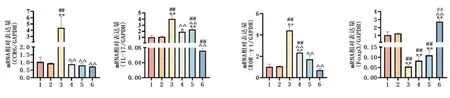
1:空白对照组;2:PBMC对照组;3:PBMC+SAA组;4:PBMC+SAA+NF-κB抑制剂BAY11-7082组;5:PBMC+SAA+抗CCL20单抗组;6:PBMC+地塞米松干预组
2.2抗CCL20单克隆抗体对高水平SAA相关的结节病PBMC中促炎性细胞因子的影响各组PBMC在48 h培养后的上清液中,PBMC+SAA+抗CCL20单抗组的IL-17A、IL-23和IL-6的水平较PBMC对照组显著增加(均P<0.01),TGF-β1的水平较PBMC对照组显著下降(P<0.01)。其IL-17A、IL-23和IL-6的水平较PBMC+SAA组显著下降(均P<0.01),而TGF-β1的含量显著增加(P<0.01)。PBMC+SAA+BAY11-7082组的IL-17A、IL-23、IL-6和CCL20的水平较PBMC对照组和PBMC+SAA组均显著降低(均P<0.01),TGF-β1的浓度相对于PBMC对照组和PBMC+SAA组有不同程度的升高(P<0.05,P<0.01)。PBMC+地塞米松组相比于PBMC对照组和PBMC+SAA组,其IL-17A、IL-23和IL-6的含量显著降低(均P<0.01),TGF-β1的含量显著升高(均P<0.01);地塞米松对IL-17A和IL-6的抑制作用优于抗CCL20单抗,低于BAY11-7082,其对于IL-23的抑制作用与BAY-11-7082类似。见图1。
PBMC+SAA+抗CCL20单抗组的IL-17 mRNA水平较PBMC对照组升高(P<0.01),而Foxp3 mRNA水平较PBMC对照组降低(P<0.01),而CCR6和ROR-γt mRNA差异无统计学意义(P>0.05)。PBMC+SAA+抗CCL20单抗组相较于PBMC+SAA组,细胞中CCR6、IL-17A、ROR-γt的转录水平显著降低(均P<0.01),而Foxp3的转录水平差异无统计学意义(P>0.05)。PBMC+SAA+BAY11-7082组ROR-γt mRNA较PBMC对照组升高(P<0.01),而IL-17 mRNA水平差异无统计学意义(P>0.05)。PBMC+地塞米松组中IL-17A的表达水平较PBMC对照组和PBMC+SAA组显著降低(均P<0.01),CCR6和ROR-γt mRNA水平与PBMC对照组无明显统计学差异(均P>0.05),较PBMC+SAA组明显下降(均P<0.01),而Foxp3 mRNA水平较PBMC对照组和PBMC+SAA组均显著增高(P<0.01)。见图2。
2.3抗CCL20单克隆抗体对NF-κB信号通路及其由高水平SAA所致的结节病PBMC中促炎性细胞因子的影响PBMC对照组中p-NF-κB蛋白表达水平较空白对照组增高(P<0.01),明显低于PBCM+SAA组中(P<0.01)。PBMC+SAA+抗CCL20单抗组中p-NF-κB蛋白表达水平较PBMC对照组增高(P<0.01),而较PBMC+SAA组明显降低(P<0.01)。PBMC+SAA+BAY11-7082组中p-NF-κB蛋白表达水平明显低于PBMC+SAA组(P<0.01)。PBMC+地塞米松组中p-NF-κB的表达水平显著低于PBMC对照组和PBMC+SAA组(P<0.01)。各组间NF-κB蛋白表达水平差异无统计学意义(P>0.05)。见图3。
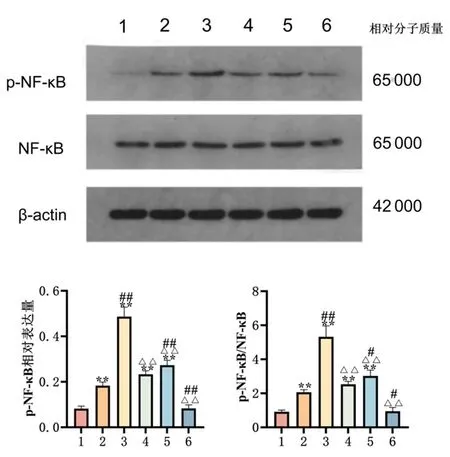
1:空白对照组;2:PBMC对照组;3:PBMC+SAA组;4:PBMC+SAA+NF-κB抑制剂BAY11-7082组;5:PBMC+SAA+抗CCL20单抗组;6:PBMC+地塞米松干预组
3 讨 论
结节病是一种全身性炎症性疾病,其免疫学特征为固有免疫系统的激活,表现为活化的巨噬细胞分化为类上皮样细胞并融合形成巨细胞;以及适应性免疫系统的激活,尤其是Th1和Th17细胞的活化[12]。SAA作为一种调节固有免疫反应的效应因子,与多种慢性炎症性疾病有关[13]。与健康人相比,结节病患者的血清SAA水平升高,且发生肺纤维化的结节病患者的血清SAA水平明显高于未发生纤维化的患者[14]。SAA通过激活Toll-2受体而刺激结节病中巨噬细胞对NF-κB的高表达,并促进结节病肉芽肿的形成[15-16]。本课题组之前的研究表明,SAA通过促进结节病肺泡灌洗液和血清中CCL20和IL-17A的产生与释放,在Th17细胞相关的免疫反应中发挥促炎作用[17]。在结节病中,由巨噬细胞产生的CCL20是一种促炎性趋化因子,直接受到转录因子NF-κB的调控。CCL20可诱导结节病肺组织中的炎症反应,加剧病情的进展[9];同时,CCL20招募的CCR6+Th17细胞在结节病肺组织中引发炎症反应并参与了肉芽肿的形成[18]。
在本研究中,高水平的SAA除了导致结节病PBMC中CCR6/CCL20趋化因子轴异常活化,还促使Th17细胞相关的促炎性细胞因子IL-17、IL-6、IL-23和ROR-γt高度表达,同时抑制了与Treg相关的TGF-β、Foxp3的表达。NK-κB抑制剂BAY11-7082特异性阻断由SAA刺激所致的结节病PBMC中CCR6/CCL20趋化因子轴的异常活化,抑制Th17细胞相关的促炎性细胞因子的生成,并促进Treg细胞功能恢复。抗CCL20单克隆抗体对结节病PBMC的作用与BAY11-7082类似,可部分抑制由高水平SAA引起的结节病PBMC中Th17相关的促炎性细胞因子的表达,促进Treg细胞的免疫抑制能力恢复,但其效果低于BAY11-7082。在结节病小鼠肺组织中,抗CCL20单克隆抗体可改善肺部肉芽肿中SAA的高表达,并纠正结节病肺组织和淋巴结中失衡的Th1/Th2与Th17/Treg细胞反应[17]。在本研究中,CCL20单克隆抗体虽能抑制由SAA刺激所造成的结节病PBMC中Th17细胞相关的促炎性细胞因子的高表达,但并未抑制结节病PBMC中Th17细胞相关的炎症反应。对于抗CCL20单克隆抗体在结节病Th17细胞中的作用,需要体内实验进一步验证。在体外实验中,由痤疮分枝杆菌(MAB)细胞壁微粒刺激形成的结节病肉芽肿较结节病PBMC中的NF-κB与p-NF-κB水平均显著升高并且与高度活化的T细胞免疫相关[19];而在本研究中,抗CCL20单克隆抗体可抑制SAA高表达所造成的结节病PBMC中异常活化的NF-κB信号通路,从而改善由SAA造成的结节病中促炎性细胞因子的高表达,但抗CCL20单克隆抗体并未抑制结节病PBMC中NF-κB的磷酸化水平,这可能与本研究中的实验对象仅为结节病PBMC,其促炎性细胞因子水平低于结节病肺组织和由结节病PBMC诱导形成体外肉芽肿有关[19-20]。
总之,本研究表明,抗CCL20单克隆抗体可改善SAA高表达所致的结节病PBMC中的Th17/Treg细胞紊乱,但未能纠正结节病PBMC中的Th17/Treg失衡,这可能与抗CCL20单克隆抗体对结节病不同病变部位的作用效果不同有关。
