基于FGF23/Klotho稳态观察口服糖皮质激素致生长障碍的临床研究
2024-05-10唐帅杨扬李湘别炳阳张建
唐帅 杨扬 李湘 别炳阳 张建,2
(1.河南中医药大学儿科医学院,河南郑州 450000;2.河南中医药大学第一附属医院儿科医院,河南郑州 450000)
长期口服糖皮质激素(glucocorticosteroid, GC)是原发性肾病综合征(primary nephrotic syndrome,PNS)的一线治疗方案,然而一些儿童长期使用GC可能导致终身高降低[1]。研究表明,在GC初始治疗的前12 个月,平均泼尼松剂量每日增加10 mg/m2,儿童身高Z 评分降低0.26,尤其在治疗开始的前6 个月,GC 对身高的影响最显著[2]。Delucchi 等[3]的大鼠研究阐述了GC 抑制生长的新机制:GC通过刺激骨和血浆中成纤维细胞因子23(fibroblast growth factor 23, FGF23)过表达,过度激活FGF23/Klotho/成纤维细胞生长因子受体(fibroblast growth factor receptor, FGFR)3 通路,进而抑制纵向骨生长。然而随后Feger等[4]发现,无论在小鼠体内或体外,GC均显著下调FGF23水平,这与Delucchi等[3]研究结论相悖。FGF23是在骨骼和肾脏中发挥重要调节作用的蛋白质激素,需依赖辅因子Klotho与FGFRs 结合[5]。Klotho与不同亚型的FGFRs 亲和力存在差异[6],同时不同亚型FGFRs 对生长的调控作用相反,其中FGFR1 和FGFR3 为生长板软骨形成的负向调控因子,FGFR2和FGFR4则为正向调控因子[7-8]。然而,未有研究关注FGF23/Klotho 稳态在GC 抑制生长中的调控作用,并且当前研究关于GC 如何调控FGF23水平亦存在争议[3-4]。本研究旨在观察长期口服GC抑制PNS儿童生长与FGF23/Klotho比值变化的相关性,为后续研究提供参考。
1 资料与方法
1.1 研究对象
前瞻性选取已停用GC 3 个月以上,于2022 年6—12月至河南中医药大学第一附属医院儿科医院复查的56 例激素敏感-非频复发/未复发的PNS 儿童为研究对象,所有PNS 儿童按照《儿童激素敏感、 复发/依赖肾病综合征诊治循证指南(2016)》[9](以下简称“指南”)中激素敏感型的GC 方案治疗并规范完成疗程,停用GC 中位时长为9.7个月。入院后所有研究对象均进行抗感染及抗凝治疗,同时监测尿蛋白定性及定量。经抗感染及抗凝治疗后,尿蛋白水平仍高于“指南”中复发标准者,按照“指南”中非频复发PNS 的GC治疗方案重新诱导缓解,为GC组;经抗感染及抗凝治疗后,尿蛋白水平低于“指南”中复发标准者,不加用GC 治疗,为无GC 组。纳入标准:符合:“指南”[9]中激素敏感-非频复发/未复发的PNS 诊断标准。排除标准:(1)入院时正在口服GC治疗或近3个月内停用GC者;(2)年龄<3岁或男性>12岁或女性>10岁者。
另选取同期于河南中医药大学第一附属医院儿科医院体检的29 例3 岁至青春期前的健康儿童作为对照组。纳入标准:(1) 尿蛋白阴性;(2) 血白蛋白(albumin, ALB) 在正常范围内;(3)既往不曾口服GC。排除标准:(1)患心、肺、肝、肾等疾病;(2)生化检查提示谷丙转氨酶、谷草转氨酶、尿素氮或肌酐任意一项异常。
本研究经河南中医药大学第一附属医院伦理委员会批准(2023HL-343)。
1.2 临床资料收集
收集所有研究对象入组时的数据,包括年龄、性别、尿蛋白定性、ALB、碱性磷酸酶(alkaline phosphatase, ALP)、估算肾小球滤过率(estimated glomerular filtration rate, eGFR)、FGF23、Klotho、身高和骨龄等。另外收集无GC组和GC组治疗1个月后的ALP、FGF23、Klotho 水平,以及半年后的身高和骨龄等数据,计算半年内的身高增长速度和骨龄增长速度。
1.3 检测方法
尿蛋白定性、ALB、ALP的测定由我院检验科进行。
身高测量均由同一操作人员在固定时间段使用同一量具(TZG 型身高坐高计-江苏苏宏医疗器械有限公司制造) 进行,单位为cm,精确至0.1 cm。身高百分位数参照《中国0~18岁儿童、青少年身高、体重的标准化生长曲线》[10],使用中国儿童生长曲线图计算器计算。
骨龄判定方法:使用杭州沧澜医疗科技有限公司提供的X射线骨龄仪(型号:YTJ-01)拍摄左手正位X线骨龄片并计算骨龄;该X射线骨龄仪的判定方法参照中华05 RUS-CHN法手腕骨等级得分表和骨成熟度评价图[11],依第50百分位数曲线计算骨成熟度得分和相应骨龄(单位:岁,保留1位小数),按照每年12 个月将骨龄(岁)换算为骨龄(月)。
eGFR 参考Tang 等[12]提出的中国儿童肾小球滤过率评估公式进行估算:eGFR [mL/(min·1.73 m2)] =89.674× [身 高(m)/肌 酐(mg/dL)/2.7]0.579×1.007(男性,如为女性则无需×1.007)×[身高(m)/1.4]0.187。
FGF23、Klotho 浓度检测:全血样本采集当日离心分离血清,所有血清样本均存储于-80℃低温冻存,避免反复冻融。采用双抗夹心酶联免疫吸附法进行FGF23 及Klotho 测定,试剂盒购于Elabscience 公司,该试剂盒FGF23 测定范围为15.63~1 000 pg/mL, Klotho 测 定 范 围 为0.31~20 ng/mL。检测过程严格按照试剂盒说明书进行,结果由标准品的浓度和光密度值绘制的标准曲线图及直线回归方程得出。
1.4 统计学分析
采用SPSS 26.0 统计软件对数据进行统计学分析。正态分布的计量资料用均数±标准差(±s)表示,两组间比较采用两样本t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验;非正态分布的计量资料用中位数(四分位数间距)[M(P25,P75)]表示,两组间比较采用Mann-WhitneyU检验,多组间比较采用Kruskal-WallisH检验。计数资料以例数和百分率(%)表示,组间比较采用卡方检验,组间两两比较采用卡方分割检验,采用Bonferroni 法校正检验水准。双变量正态分布资料相关性分析采用Pearson 法,双变量非正态分布资料相关性分析采用Spearman秩相关。Bonferroni法以P<0.017为差异有统计学意义,余P<0.05表示差异有统计学意义。
2 结果
2.1 三组儿童基线特征和临床指标比较
GC组、无GC组和对照组三组儿童入组年龄比较差异无统计学意义(P>0.05)。GC 组、无GC 组男性比例差异无统计学意义(P>0.017),无GC 组男性比例高于对照组(P<0.017)。GC 组第2 次晨尿蛋白阳性率、24 h 尿蛋白定高于无GC 组(P<0.05)。GC 组ALB 水平低于无GC 组(P<0.05),GC组、无GC组ALB水平均低于对照组(P<0.05)。GC 组、无GC 组eGFR 水平差异无统计学意义(P>0.05),但均高于对照组(P<0.05)。GC组、无GC组身高百分位数比较差异无统计学意义(P>0.05),但均低于对照组(P<0.05)。三组ALP、FGF23、Klotho 和FGF23/Klotho 比值比较差异均无统计学意义(P>0.05)。各组中FGF23/Klotho 比值的变异系数均小于FGF23和Klotho的变异系数。见表1。
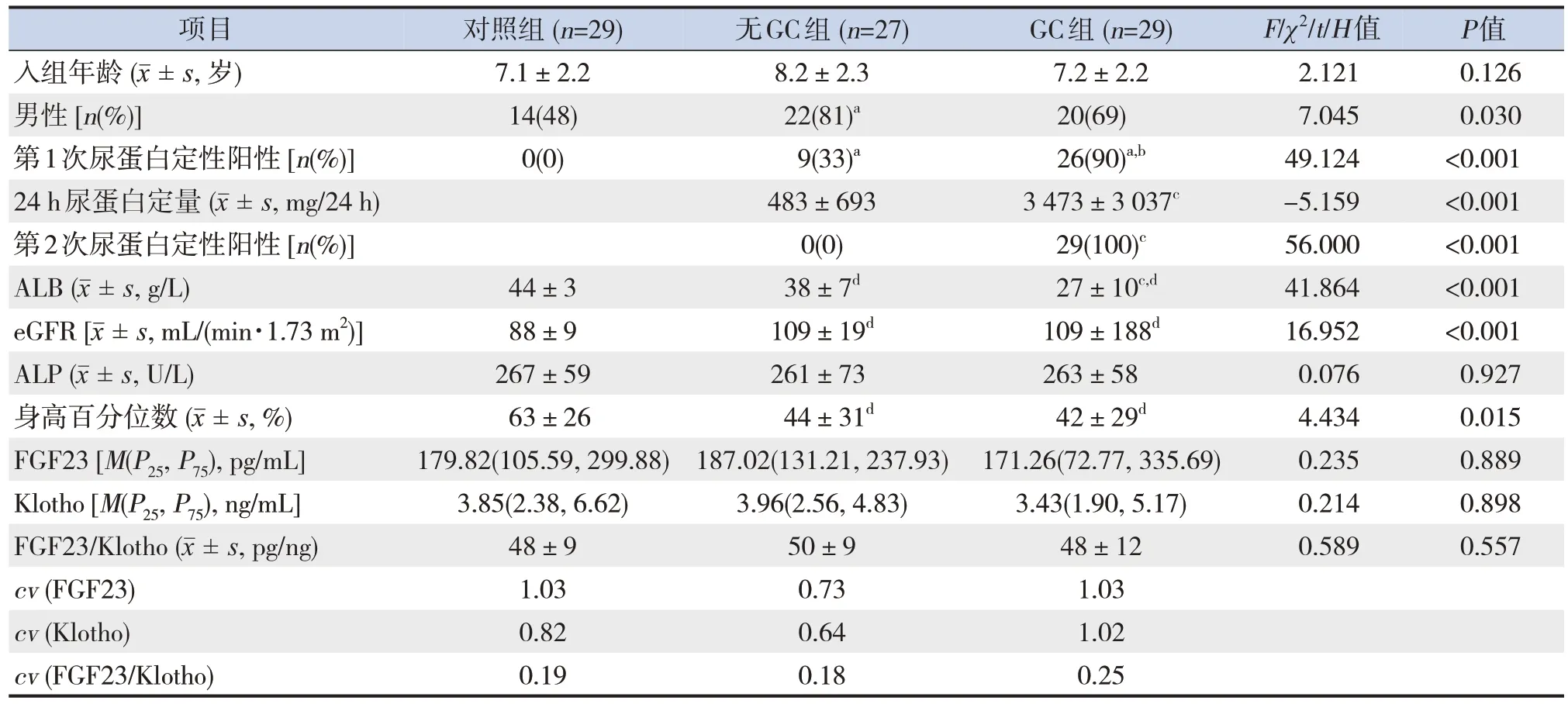
表1 三组入组时资料比较
2.2 GC组和无GC组治疗1个月和半年后的相关指标比较
治 疗1 个 月 后,GC 组 的FGF23、Klotho 及FGF23/Klotho 比值均高于无GC 组(P<0.05),血清ALP 低于无GC 组(P<0.05)。随访半年,GC 组骨龄增长速度和身高增长速度低于无GC 组(P<0.05),GC组半年后的身高百分位数明显下降(P<0.05)。见表2。

表2 GC组和无GC组治疗1个月和半年后的相关指标比较
2.3 PNS儿童治疗1个月后的FGF23/Klotho比值与临床指标的关系
Pearson相关分析显示,PNS儿童治疗1个月后的FGF23/Klotho比值与治疗半年内的身高和骨龄增长速度均呈负相关(分别r=-0.356、-0.436,均P<0.05),见图1~2;而年龄与FGF23/Klotho 比值无相关性(r=0.045,P=0.743)。Spearman秩相关分析显示,性别(rs=0.176,P=0.194)、尿蛋白(rs=-0.147,P=0.28)与FGF23/Klotho比值无相关性。
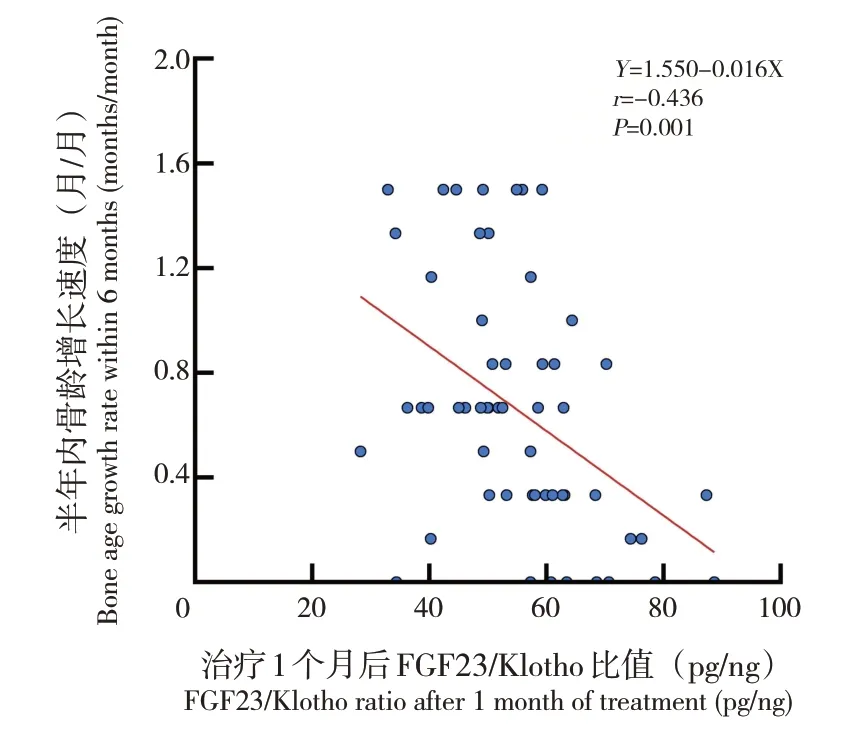
图2 FGF23/Klotho与骨龄增长速度的相关性分析
3 讨论
长期口服GC导致的生长障碍一直是临床关注的重点,然而其作用机制尚待明确。FGF23、Klotho和FGFRs等因子在生长板中的存在已得到确认[13-14]。Klotho作为FGF23的共受体,辅助其与生长板软骨细胞外结构中的FGFRs 结合。这一结合使得细胞内的FGFRs 结构域被磷酸化,进而激活细胞内的下游信号通路,调控生长板软骨细胞的增殖、分化等生理活动[15]。然而长期口服GC是否通过扰乱儿童血清FGF23/Klotho稳态导致生长障碍尚不清楚。因此,本研究旨在观察长期口服GC的PNS儿童的生长情况,并探究其血清FGF23/Klotho稳态的变化,以提供新的视角来理解GC对生长的抑制。
Delucchi 等[3]研究发现GC 导致青春期前大鼠生长障碍与FGF23表达增加相关。此外GC处理还增加了小鼠胫骨外植体中FGFR3 的表达,这表明GC 导致生长障碍的机制与FGF23/Klotho/FGFR3 信号通路相关。然而,Feger等[4]研究中,无论在小鼠体内还是体外,单次GC 治疗均显著降低FGF23的浓度。这两项研究出现差异的原因可能是后者仅测量了单次应用GC 后12 h 内FGF23 水平的变化。本研究结果显示,GC 组加用GC 1 个月后的FGF23 和Klotho 水平均显著高于无GC 组,与Delucchi 等[3]的结论一致。然而,生长板中的FGF23 除了激活FGFR3 外,还可激活其他同类型受体,并表现出相反的生长调控作用[7-8]。作为辅因子的Klotho对不同类型的受体表现出不同的亲和力,调控着FGF23 与不同受体的结合能力[6]。Delucchi 等[3]可能忽略了FGF23/Klotho 稳态才是GC 抑制生长的关键靶点,这比单一FGF23 水平更具有观测价值。本研究中,GC组患儿再次加用GC后,其身高增长速度和骨龄增长速度较无GC组均显著降低,同时其FGF23/Klotho 比值较无GC 组显著升高。这些结果支持了FGF23/Klotho 稳态与GC抑制生长的关联。相关性分析显示,PNS儿童入组1 个月后的FGF23/Klotho 比值与其后半年内的身高增长速度、骨龄增长速度呈显著负相关,表明FGF23/Klotho 稳态失衡是长期口服GC 导致生长障碍的机制之一。
关于FGF23/Klotho 稳态是否受GC 以外其他因素的影响而造成本研究的偏差,多项研究显示FGF23 和Klotho 水平不受年龄、性别影响[16]。然而有研究显示,FGF23和Klotho蛋白水平与慢性肾脏病严重程度具有一定相关性,随着疾病进展,肾小球滤过率与Klotho水平逐渐降低,而FGF23水平逐渐升高[17]。另外,分子质量较小的FGF23 蛋白(32 kDa)理论上可能受尿蛋白的影响,但并无相关研究证明。本研究中无GC 组和GC 组的eGFR水平均显著高于对照组,这可能是由于PNS 儿童的肾小球滤过膜通透性增加引起的[18]。关于为何不同尿蛋白程度的GC组、无GC组之间的eGFR水平不具有差异,可能是由于抽样误差导致的。尽管三组儿童的尿蛋白定性、定量及eGFR比较差异均有统计学意义,但其FGF23/Klotho比值差异无统计学意义,反向证明了FGF23/Klotho稳态不受以上因素影响。另外,本研究中FGF23/Klotho比值的变异系数在不同组中均远小于FGF23及Klotho的变异系数,其良好的稳定性从另一角度亦支持着FGF23/Klotho稳态的观测价值。
综上所述,GC 至少部分通过扰乱FGF23/Klotho稳态这一机制导致PNS儿童生长障碍,并且其稳态是一个稳定指标,不受GC外其他已知因素的影响。因此,无论是寻找新的治疗靶点或是预测GC 抑制生长的强度,FGF23/Klotho 稳态均为一个新的有效指标。然而,本研究也存在一些局限性:(1)目前国内外尚未就FGF23和Klotho的正常浓度范围达成一致,而且测量试剂盒的种类繁多,本研究使用的是Elabscience 公司的ELISA 试剂盒,未能评估不同检测方法的差异;(2)影响FGF23、Klotho因素众多,未来可行多重线性回归分析,减少其他混杂因素带来的偏倚。鉴于这些局限性,需要在更大的样本中进行前瞻性、多中心研究。
作者贡献声明:唐帅参与选题与设计,负责数据统计分析及论文撰写;杨扬负责FGF23、Klotho浓度检测;李湘负责测量骨龄及身高;别炳阳负责收集临床数据;张建负责论文选题与设计,以及论文审阅与修改。
利益冲突声明:所有作者声明不存在利益冲突。
