江西省猪链球菌的分离鉴定及耐药基因、毒力基因检测分析
2024-05-09张文波陈佳玲周晓丽
韩 瑞,杨 行,张文波,陈佳玲,周晓丽
(江西农业大学动物科技学院,南昌 33045)
猪链球菌病(SwineStreptococcalsuisdiseases)是由多种致病性链球菌感染引起的一种危害严重的人兽共患传染病,具有重要的公共卫生学意义。猪链球菌(Streptococcussuis, SS)是革兰氏阳性球菌,根据其荚膜抗原的不同,可分为35种血清型,其中致病性和毒力最强是猪链球菌2型(SS-2),不仅引起猪的急性败血症和脑膜炎,导致严重的经济损失,同时又能感染人,甚至致死[1]。然而在一些欧洲国家,9型相比其他血清型更常见[2]。据流行病学调查显示,近几年中国SS9型分离率也在逐步上升[3]。SS在粪便中存活时间长达90 d,可感染多种动物,包括牛、羊、猪、鸡以及人[4-5]。自1968年,丹麦首次报道人感染SS[6]以来,多个国家和地区均有报道。2005年,四川省暴发人感染SS-2,短期内超过200多人发病,是近年来发病规模最大的人感染SS[7],使世界对于SS-2对人的致病性有了新的认识[8]。近年来,广东、云南、贵州等地也陆续出现人感染SS病例[9-12]。
SS的致病机制目前仍不清楚,普遍认为其致病力强弱主要取决于它的毒力因子[13]。目前,已报道的SS主要毒力因子有荚膜多糖(capsular polysaccharide,CPS)、溶菌酶释放蛋白(muraminidase-released protein, MRP)、溶血素(suilysin, SLY)、胞外蛋白因子(extracellular protein factor, EPF)、三磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphatedehydrogenase,GAPDH)等[14]。研究表明,表现型为mrp+ef+在强毒力菌株中检出率很高,在无毒力菌株中检出率很低,因而携带mrp和ef基因常被认为是猪链球菌2型高致病性的标志[15]。虽然MRP和EF蛋白与毒力之间有着极密切的关系,但有部分研究发现mrp和ef的编码基因在不同毒力的链球菌菌株中均有发现,表明这2种蛋白对链球菌菌株的致病性并非必不可少[16-17]。
近年来,由于抗生素在临床上的广泛使用,且耐药基因可水平及垂直传播,导致致病菌的耐药问题日益严重,为临床治疗带来了很大困难。因此,了解致病菌的耐药表型及耐药基因流行情况,对于抗生素的使用以及猪链球菌的防控有重要意义。本试验从江西部分规模化猪场疑似链球菌病的病死猪中分离病原菌,经分子生物学鉴定为SS9型和SS1型,分离菌对小鼠的致病力有一定差异,其耐药性、毒力基因以及耐药基因的分布有一定的差异,试验结果为了解江西省内规模化猪场SS的致病性、药物敏感性、耐药基因以及毒力基因的差异提供依据,也为进一步研究SS致病机理和科学防控奠定基础。
1 材料与方法
1.1 样品 2018—2021年在江西省南昌市、抚州市、九江市选取8个规模化猪场,对患败血症、关节肿大、呼吸困难、脑炎的病死猪的肺脏、关节液进行样品采集,共分离到10株SS,菌株来源详见表1。

表1 菌株来源Table 1 Strain source
1.2 主要试剂及培养基 TSA、TSB培养基均购自北京索莱宝科技有限公司;DL2000 DNA marker购自北京康润诚业生物科技有限公司;2× FastTaqPremix购自TOLOBIO公司;药敏纸片购自杭州天和微生物试剂有限公司;细菌16S rRNA通用PCR引物为课题组设计,由生工生物工程(上海)股份有限公司合成。
1.3 试验动物 健康雌性昆明鼠22只,6~8周龄,购自南昌大学医学院实验动物中心。
1.4 细菌的分离及纯培养 无菌条件下,取肺脏、脑或关节液,用接种环划线接种于TSA平板(含5%小牛血清),37℃培养过夜,挑单个菌落进行革兰氏染色镜检;于TSA平板进行纯培养;挑分离菌纯培养物的单菌落,接种于TSB液体培养基,37℃、220 r/min振荡培养10~12 h。
1.5 血清型分析 根据GenBank上登录的猪链球菌16S rRNA基因序列,用Primer Premier 5.0 设计PCR引物。将16S rRNA鉴定为猪链球菌的菌株,用7个血清型特异性的引物进行PCR分型鉴定。以培养菌液作为模板进行PCR。反应体系(25 µL)为:Mix 12.5 µL,ddH2O 10.5 µL,模板1 µL,上、下游引物各0.5 µL。PCR扩增程序:94℃预变性5 min;95℃变性40 s,55℃退火30 s,72℃延伸1 min,共35个循环;72℃再延伸10 min。1%琼脂糖凝胶电泳,观察结果。
1.6 致病性试验 选取6~8周龄昆明鼠,分为11组。采用麦氏比浊法稀释纯培养的分离菌菌液使浓度约为1×108CFU/mL,腹腔注射,每只200 µL;第7组注射等量的生理盐水作为对照组。观察和记录小鼠精神状态、死亡时间。死亡小鼠进行解剖,并无菌采肝脏和肺脏进行细菌分离,观察其菌落形态、革兰氏染色镜检,16S rRNA序列测定及血清型分型结果,判定分离菌的致病力。
1.7 药敏试验 按WHO推荐的K-B纸片法进行操作,37℃培养12~24 h,观察结果。按CLSI(2013)药敏试验结果判定标准[18]进行判定:抑菌圈直径大小作为判定敏感度的标准,并且将其分为耐药(R)、中度敏感(I)和高度敏感(S)。
1.8 耐药基因与毒力基因的检测 参考已发表文献[19-26]设计28对耐药基因和6对毒力基因引物(表2),并根据文献[27]合成猪链球菌血清分子分型引物,由生工生物工程(上海)股份有限公司合成;分别对分离的猪链球菌菌株进行耐药与毒力基因检测分析。以10株分离菌的菌液为模板,PCR反应体系(25 µL)为:Mix 12.5 µL,ddH2O 10.5 µL,模板1 µL,上、下游引物各0.5 µL。PCR扩增程序:94℃预变性10 min;95℃变性40 s,50℃~58℃退火30 s,72℃延伸1 min,共35个循环;72℃再延伸10 min。PCR产物进行1%琼脂糖凝胶电泳。将阳性PCR产物送生工生物工程(上海)有限公司进行序列测定,并用在线BLAST对所测序列进行比对分析。
2 结果
2.1 细菌分离纯化 将分离菌在TSA平板经37℃培养12~16 h后,对于形成直径0.5~1 mm,灰白色、半透明、表面光滑的菌落,染色镜检呈单个、成对或呈链状排列的革兰氏阳性球菌的细菌进行纯化(图1)。共分离到10株细菌,将纯培养物分别命名为JXNG1811、JXFC1809、JXFZ1904、JXNC1904、JXJJ1904、JXNC1906、JXNC2007、JXNC2011、JXNC2103和JXNC2107。
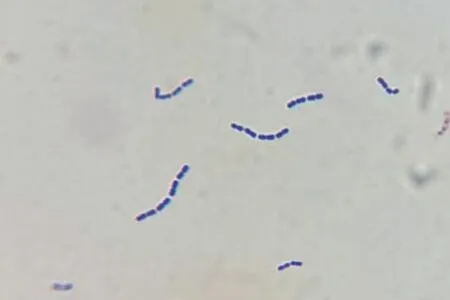
图1 分离菌的革兰氏染色结果(100×)Fig.1 Gram staining results of isolated bacteria (100×)
2.2 分离菌16S rRNA及血清型分型结果 对分离菌进行菌液PCR,电泳结果显示,分离菌在1500 bp左右有与预期大小基本一致的条带(图略)。16S rRNA测序结果经BLAST比对分析,10株分离菌与猪链球菌相应序列同源。用猪链球菌的血清型特异性引物对分离菌进行PCR分型鉴定,结果共检测出2种血清型,分离株JXNG1811、JXFC1809、JXFZ1904、JXNC1904、JXJJ1904、JXNC1906、JXNC2107为猪链球菌9型,分离株JXNC2103为猪链球菌1型,其他2株JXNC2007、JXNC2011分别为猪豕链球菌和猪生殖道链球菌,暂无法分型。
2.3 分离菌的攻毒试验结果 将10株分离菌接种于小鼠,结果显示10株链球菌对小鼠的致病性有较大差异,JXNC1906、JXNG1811、JXJJ1904、JXFZ1904、JXNC1904分离株攻毒的小鼠均有明显症状,而JXFC1809、JXNC2007、JXNC2011、JXNC2103和JXNC2107分离株攻毒的小鼠无明显症状,详见表3。攻毒小鼠发病的症状主要是:精神沉郁,采食食量减少,呼吸困难,可见腹式呼吸,眼角流脓,角膜混浊;JXNG1811分离株和JXNC1904分离株攻毒小鼠有神经症状。剖检可见肝脏肿大,出血,边缘发黑,肺部有出血,JXNG1811分离株和JXNC1904分离株攻毒小鼠有出血及脑软化现象(图2)。无菌采集肝脏和肺脏进行细菌分离鉴定,经16S rRNA序列测定为SS。
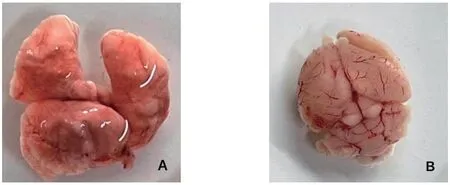
图2 部分攻毒死亡小鼠剖检结果Fig.2 Autopsy results of some dead mice infected with bacteria
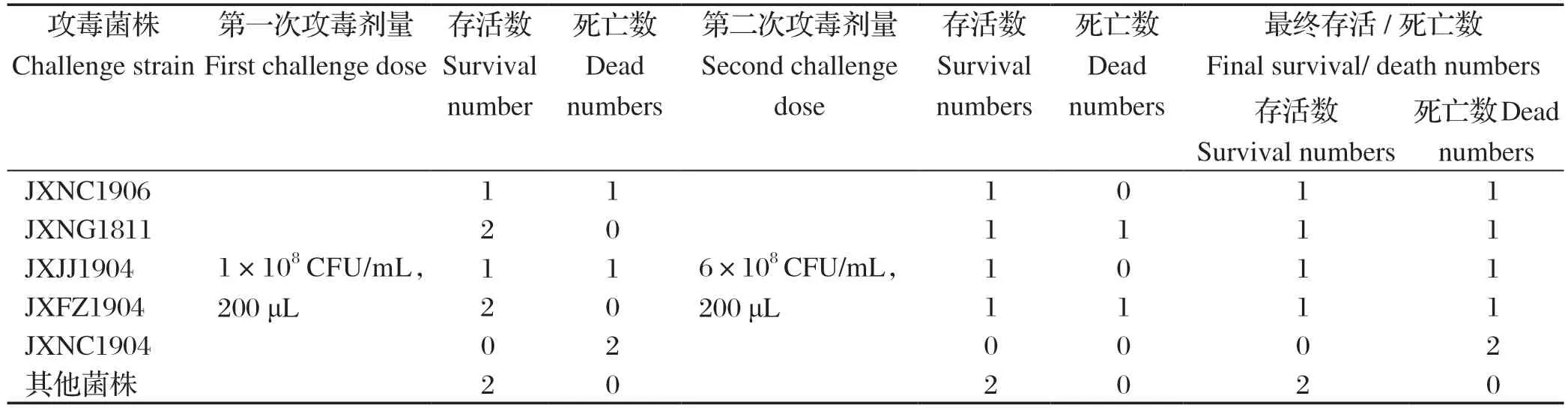
表3 小鼠攻毒试验Table 3 Bacterial challenge test in mice
2.4 药物敏感试验 用14种临床常用的抗菌药物纸片对分离菌进行药敏试验。结果可知,10株菌株中有8株分离菌对氨苄西林高度敏感;10株分离菌均对甲硝唑耐药,7株分离菌对多粘菌素B耐药;其中JXNG1811、JXNC2011分离菌对6种药物耐药,其他分离株对2~5种药物有耐药性;其中甲硝唑、林可霉素、多粘菌素B和链霉素有5种以上的分离株对其耐药(表4)。
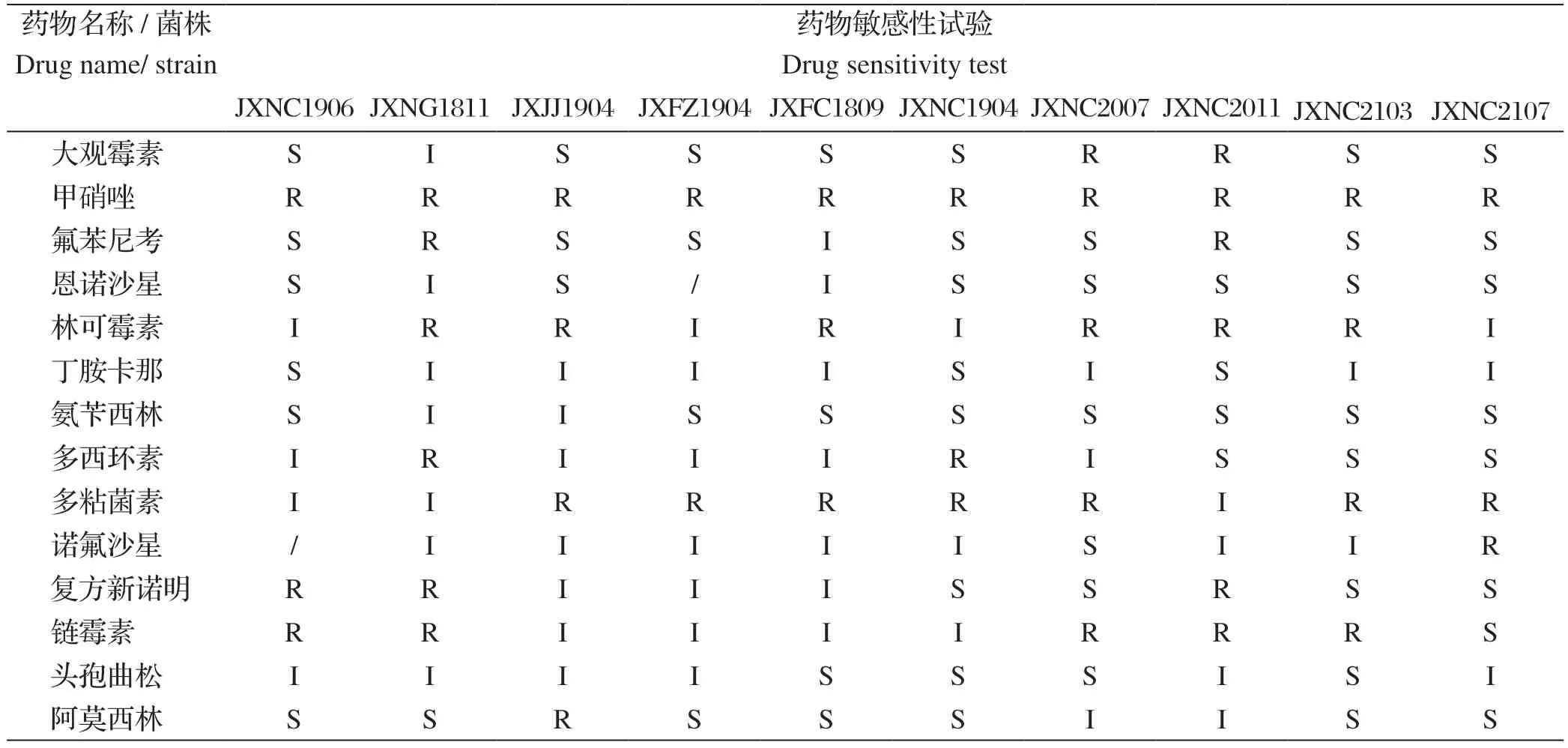
表4 分离菌的药敏试验结果Table 4 Results of drug sensitivity test of isolated bacteria
2.5 耐药基因与毒力基因检测 以10株分离菌的培养液为模板,PCR检测其耐药和毒力基因。耐药基因检测结果显示,8大类抗生素均被检出耐药基因,其中四环素类tetO、大环内酯类ermB、喹诺酮类gyrA、parc和磺胺类sul1耐药基因有9株以上分离菌检出;分离菌中SS9普遍检出的耐药基因少于7种,而其他分离株有14种以上的耐药基因被检出;毒力基因检测结果显示,6种毒力基因均被检出,SS1分离株JXNC2103检测到6种毒力基因,SS9分离株均检出gapdh、mmuM毒力基因,对于SS2型的强毒株代表毒力基因型ef/mrp/sly,9型分离株JXJJ1904、JXFZ1904、JXFC1809、JXNC1904检测出ef+mrp-sly-型,JXNC1906和JXNC2107检测出ef-mrp+sly+型,JXNG1811分离株检测出ef-mrp-sly+型。耐药和毒力基因经测序及BLAST比对分析,所检测到的基因与GenBank上登录的SS相应序列均同源,相似性均为99%以上,耐药和毒力基因检测结果见表5、表6。
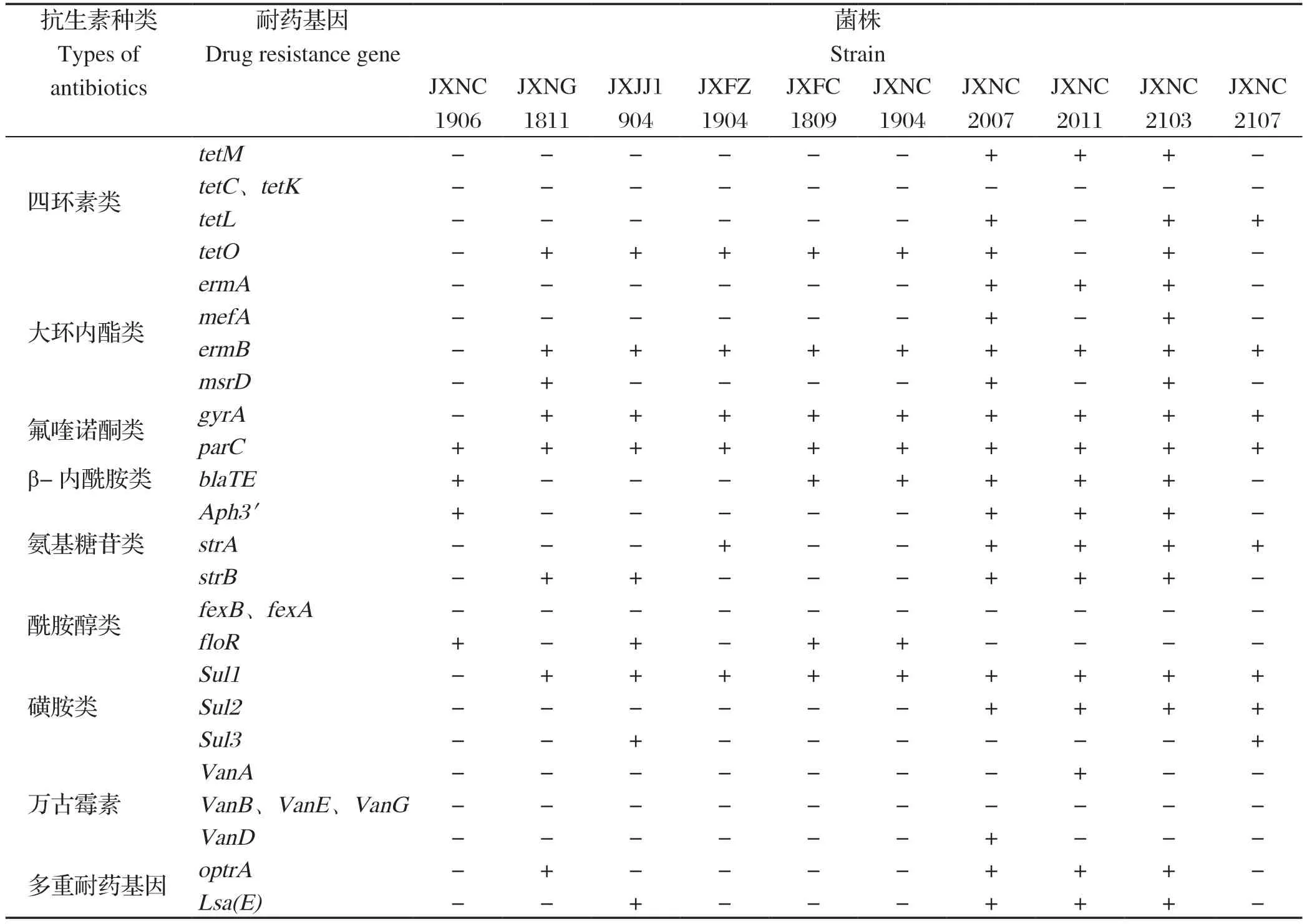
表5 分离菌的耐药基因检测结果Table 5 Detection results of drug resistance genes of isolated strains

表6 分离菌的毒力基因检测结果Table 6 Detection results of virulence genes of isolated strains
3 讨论
SS在自然界和动物群中广泛分布,并可分为35个血清型,长期以来SS对动物和人都具有强致病性,继2005年在四川首次发现链球菌感染人的病例,截至到2008年,全球已经有400多例病例SS[28-29]。然而,对于SS9型感染人的报道却鲜有,直至最近,泰国报告了一例由SS9感染人事件[30]。对于SS部分研究结果表明,SS的致病作用与其携带的毒力基因编码的毒力因子有关。因此,对毒力因子的研究将有助于探明猪链球菌的致病机理[31]。
本试验从江西8个发生疑似猪链球病的规模化猪场的病死猪肺脏和关节液中分离获得了10株细菌,通过16S rRNA和血清型分子分型的序列测定、比对分析,确定分离菌均为SS,其中分离株JXNG1811、JXFC1809、JXFZ1904、JXNC1904、JXJJ1904、JXNC1906、JXNC2107为SS9,分离株JXNC2103为SS1,其他2株JXNC2007、JXNC2011分别为猪豕链球菌和猪生殖道链球菌。用这10株菌株进行动物实验,结果表明:JXNG1811、JXFZ1904、JXNC1904、JXJJ1904和JXNC1906分离株致死量为2×107CFU、1.2×108CFU,可判定为强毒株。其中JXNC1904和JXNG1811菌株可使小鼠产生脑膜炎变化以及明显的神经症状。李秀丽等[32]在SS2感染昆明鼠模型的研究中,有部分攻毒小鼠,72 h左右开始出现神经症状,与本次实验结果相似。陆申申等[33]用超强毒株中成功的复制了脑膜炎模型。本次实验中,不同毒力的毒株也可致使出现相同的脑膜炎症状。经查询文献,选择常用于SS毒力强弱鉴定的6种毒力基因,设计引物,对10株SS分离株进行毒力检测。结果显示,6种毒力基因均被检出,SS1分离株JXNC2103检测到6种毒力基因,但其致病力较弱,在此攻毒剂量下小鼠未呈现发病症状;SS9分离株均检出gapdh、mmuM毒力基因,对于SS2型的强毒株代表毒力基因型ef/mrp/sly,SS9分离株JXJJ1904、JXFZ1904、JXFC1809、JXNC1904检测出ef+mrp-sly-型,JXNC1906和JXNC2107分离株检测出ef-mrp+sly+型,JXNG1811分离株检测出efmrp-sly+型。SS9分离株攻毒试验结果表明,这3种表型均能使小鼠死亡,其中ef+mrp-sly-型和ef-mrpsly+型也可以使小鼠产生神经症状。其中毒力最强的JXNC1906菌株和毒力较弱的JXNC2107菌株毒力基因表型都为ef-mrp+sly+型,根据此结果,可推测对于SS2型的强毒株代表毒力基因型ef/mrp/sly,SS9菌株可能并不能适用。另一方面,关于血清型9型菌株的毒力因子研究很少,在过去的研究中,大多数SS9菌株很少检出ef、mrp、sly基因。此前仅在西班牙分离株,部分巴西分离株以及泰国感染人菌株等都检测出了sly基因,也有约50%的分离株检出mrp基因[34-37]。在小鼠模型中,分离株的基因型与其毒力表型是否一致仍是一个悬而未决的问题。王召贺等[38]收集30株SS9,并根据MLST分型和23个毒力相关基因分型分析结果,进行了攻毒试验,结果呈现高度的多样性。Gottschalk等[39]用2株SS9表型分别为ef-mrp+sly+、ef-mrp-sly-的菌株对小鼠进行了攻毒试验,结果表明这2株表型皆有较强的致病性。本试验结果与之相似,推测ef/mrp/sly并非是强毒力SS9菌株所必需,可能在链球菌不同血清型中毒力基因型有一定差异,SS致病力是多种毒力因子共同作用的结果;通过检测其他几株猪源链球菌株发现,有5株以上分离菌均检测到gapdh、orf2、mmuM、ef和mrp毒力因子,表明了这几种毒力因子可能普遍存在于近几年江西流行菌株中。
目前,对SS的防控,在临床上多采用抗生素,随着养猪的规模化发展,抗生素滥用现象日趋严重,使部分细菌的耐药性不断扩散,给疾病的治疗带来很大的困扰[40]。细菌的耐药机制复杂多样,其中耐药基因是其主要机制之一,且耐药基因可在细菌的种间或属间转移是临床分离菌耐药现象日趋严重的重要原因。因此定期分离病原菌,进行耐药性和耐药基因的检测,筛选敏感药物,采取合理治疗药物对细菌性疾病有重要的实践意义[41]。本研究在耐药检测上选用较为常用的14种抗生素,8大类28种耐药基因对分离的10株SS进行药敏试验以及耐药基因检测,由结果可知,10株分离菌的耐药性差异较大,对大多数药物敏感;7株分离菌对多粘菌素B耐药;JXNG1811、JXNC2011分离菌对6种药物耐药,其他分离株对2~5种药物有耐药性;其中有5种以上的分离株对甲硝唑、林可霉素、多粘菌素B和链霉素其耐药。杨行等[42-45]对河南、湖北以及上海地区的SS2做药敏试验,结果均显示对红霉素、复方新诺明、四环素等药物产生较为广泛的耐药性,另外氟苯尼考、氨苄西林等菌株耐药率呈逐步增高趋势。Hernandez-Garcia等[46]收集了405株猪链球菌,发现2009—2014年,猪链球菌对氨基糖苷类、头孢菌素类、氟喹诺酮类、胸腺嘧啶类、磺胺类、四环素类等多种抗菌药的耐药性水平有所上升,本试验结果与上述结论相似,分离菌对四环素类,氟喹诺酮类、氨基糖苷类和磺胺类都有不同程度的耐药性;然而对β-内酰胺类抗生素,除了JXJJ1904对阿莫西林耐药,其他分离株均对其中敏或高敏。耐药基因检测显示,10株分离株中9株检测出大环内酯类ermB、喹诺酮类gyrA、parc和磺胺类sul1耐药基因,其中SS9普遍检出的耐药基因少于8种,而其他分离株有14种以上的耐药基因被检出,SS1分离株JXNC2103检测出了18种以上的耐药基因;在本试验中,毒力较强的SS9相比其他菌株,耐药基因检出率相对较低,SS9菌株JXNG1811只检出了8种耐药基因,但其耐药谱比其他菌株要广,推测猪链球菌的耐药现象是多种机制联合作用所致,具体的耐药机制有待进一步研究。在本研究中发现耐药基因检测结果与纸片法药敏试验结果不完全一致,对于四环素耐药基因,其耐药表型与基因型部分吻合,除分离株JXNC1906外,其他菌株都检测到了四环素类耐药基因,只有2株分离菌对多西环素耐药,可能原因是大部分菌株只检测出了1种四环素类耐药基因,而对多西环素的耐药性可能需要其他耐药基因的协同作用。谈忠鸣等[47-48]在27株SS2以及15株SS9中进行耐药性分析中发现,SS2对四环素产生极高耐药率的基因主要是tetM基因,而SS9主要是tetO基因。本研究中,SS9分离株有5株都检出了tetO基因,其中2株对多西环素耐药,此结果也可进一步表明对于四环素类抗生素,在不同的血清型中,引起耐药的耐药基因是不同的。β-内酰胺类和氟喹诺酮类耐药表型与基因型基本不一致,分离菌中,大部分菌株均能检测出β-内酰胺类耐药基因,10株分离菌菌株均能检出氟喹诺酮耐药基因,但只有JXNC2107对诺氟沙星有耐药,其他大部分菌株对其敏感。据调查显示尽管β-内酰胺类和氟喹诺酮类抗生素在猪身上使用多年,但大多数临床上的SS仍然对这些抗生素敏感[49]。研究表明,临床分离的SS对氟喹诺酮类药物耐药性取决于parC和gyrA基因喹诺酮耐药决定区(QRDRs),在氟喹诺酮类药物耐药菌株parC和gyrA基因QRDRs发生氨基酸突变,在氟喹诺酮类药物敏感菌株中,parC和gyrA基因的QRDR区均未有突变[50-51]。在本试验中,对于氟喹诺酮类耐药基因与耐药表型有待进一步研究。本研究中,5种分离株都对氨基糖苷类抗生素耐药,除分离株JXFC1809、JXNC1904外,其他均检测到氨基糖苷类耐药基因,其中分离株JXNC2007、JXNC2011全部检出对于氨基糖苷类耐药基因Aph3’、strA、strB,事实上,这2株分离株也表现出较高的耐药性,对大观霉素和链霉素耐药。此外有5株分离菌还检测到了新型耐药基因optrA和lsa(E),表明目前部分猪场的链球菌中,耐药基因较为普遍,尤其是新型多重耐药基因的检出,对该病的控制带来的较大的阻力;商艳红[22]通过检测237株猪链球菌中新型耐药基因发现,optrA基因检出率为11.8%,lsa(E)基因检出率为 14.3 %。这表明这两种基因在SS2中已存在着一定程度的流行[22]。因此做好这些耐药基因的监测可为养殖场链球菌病的防控提供有效的科学依据。
本试验对分离到的10株猪链球菌进行了生物学特性观察、攻毒试验、毒力基因检测和药物敏感性实验。结果表明,临床分离的血清型以9型为主,致病力和毒力基因的差异较大,但耐药性均不强,均对氟苯尼考、氨苄西林和大观霉素高度敏感。
