长非编码RNA lnc-ALVE1-AS1 抑制ALV-J 在鸡巨噬细胞中增殖
2024-05-09柴文娴罗坚强洪雅琴耿拓宇崔恒宓胡序明
柴文娴,骆 欢,金 松,王 姣,罗坚强,洪雅琴,耿拓宇,崔恒宓,胡序明
(1.常州市动物疫病预防控制中心,常州 213002;2.扬州大学 动物科学与技术学院/表观遗传学及表观基因组学研究所,扬州 225009;3.扬州大学 教育部农业与农产品安全国际合作联合实验室,扬州 225009)
巨噬细胞(macrophage)是单核吞噬细胞系统晚期分化细胞,由骨髓造血祖细胞发育分化释放进入外周血。作为天然免疫系统的重要组成部分,巨噬细胞在抵抗病原微生物感染过程中具有关键作用。
近年来,长非编码RNA(Long non-coding RNA, lncRNA)作为非编码RNA的重要家族成员在巨噬细胞天然免疫中的作用也逐渐被认识[1-2]。早期研究发现脂多糖刺激小鼠骨髓树突状细胞后引起lncRNA异常表达,随后证实这些lncRNA与小鼠肺部的病毒感染、单核细胞和巨噬细胞的激活密切相关[3]。在人和鼠巨噬细胞中,lncRNA-Cox2和THRIL对调节TLR2信号起着关键作用。值得注意的是,内源性反转录病毒(Endogenous retroviruses, ERVs)也是宿主lncRNAs的重要来源之一。在小鼠巨噬细胞中鉴定了1278个全长ERVs来源的lncRNAs,其中lnc-EPAV已被证明可以增强宿主的抗病毒天然免疫应答[4]。因此,源自内源性反转录病毒的lncRNAs可能是巨噬细胞参与抗病毒免疫反应的重要组成部分。
内源性反转录病毒是远古反转录病毒感染时留下的痕迹,不仅对早期胚胎发育和胚胎干细胞具有重要作用,还可能与宿主免疫应答有关。目前,在鸡基因组中已鉴定出多种类型的内源性反转录病毒,但其基因组结构都与禽白血病病毒(Avian leukosis virus, ALV)类似[5]。其中,已鉴定鸡内源性反转录病毒ALVE1定位于鸡1号染色体[6],且受到DNA甲基化调控[7]。研究表明,鸡内源性反转录病毒ALVE1衍生的长非编码RNAlnc-ALVE1-AS1与宿主遗传抗性有关[8],并且能够在鸡胚成纤维细胞中激活抗病毒天然免疫反应[9]。然而,关于lnc-ALVE1-AS1在鸡免疫细胞尤其是巨噬细胞细胞中的抗病毒功能及其作用机制尚不清楚。
为了进一步探索lnc-ALVE1-AS1在鸡巨噬细胞中的抗病毒作用及其机制,本研究通过抗病毒实验分析了lnc-ALVE1-AS1对巨噬细胞抗病毒天然免疫和ALV-J病毒增殖能力的影响,并初步探索了lnc-ALVE1-AS1在巨噬细胞中的作用机制。研究结果为进一步研究lnc-ALVE1-AS1在巨噬细胞中的抗病毒功能和机制奠定了基础。
1 材料和方法
1.1 细胞、质粒和病毒 重组真核表达质粒pcDNA3.1-lnc-ALVE1-AS1由本实验室构建;鸡巨噬细胞系(HD11)和J亚群禽白血病病毒(ALV-J)JS09GY3毒株由扬州大学秦爱建教授馈赠。
1.2 主要试剂 RNA-easy Isolation Reagent、反转录试剂盒HiScript Ⅲ RT SuperMix for qPCR (+gDNA wiper)和荧光染料ChamQ Universal SYBR qPCR Master Mix购自南京诺唯赞生物科技有限公司;DMEM高糖培养基和胎牛血清FBS购自美国Gibco公司;LipofectamineTM3000 Transfection Reagent、LipofectamineTMRNAiMAX Transfection Reagent购自美国T hermo Fisher Scientific公司;Amlexanox(TBK1/IKKε inhibitor)购自美国InvivoGen公司;鸡TLR3抗体购自美国Novus Biologicals公司;山羊抗兔IgG(Alexa Fluor®488)购自英国Abcam公司;lncRNA FISH Probe Mix购自广州锐博生物科技有限公司;其他试剂均为国产分析纯。
1.3 引物设计与合成 所有引物采用Primer Premier 6.0软件设计并委托Thermo Fisher Scientific公司合成,引物序列如表1所示。

表1 本研究所使用的qPCR 引物Table 1 The qPCR primers used in this study
1.4 ALV-J感染HD11后lnc-ALVE1-AS1的表达检测 鸡巨噬细胞系HD11细胞接种6孔细胞培养板后,按照病毒感染复数MOI=5感染ALV-J(毒株JS09GY3)。病毒感染细胞后6、12和24 h分别收集细胞。然后,按照RNA-easy Isolation Reagent说明书提取总RNA。接下来,利用反转录试剂盒PrimeScript RT reagent Kit with gDNA Eraser将1 μg总RNA反转录成cDNA产物。cDNA产物稀释后通过Bio-Rad公司CFX ConnectTM实时定量PCR仪进行定量分析。反应体系为:cDNA模板1 μL,SYBR Green Ⅱ 10 μL,上、下游引物各2 μL,无RNA酶水5 μL。反应条件:95℃预变性30 s;95℃变性5 s,60℃退火34 s,40个循环。检测基因为lnc-ALVE1-AS1,内参基因为GAPDH。
1.5 长非编码RNAlnc-ALVE-AS1转染HD11细胞后ALV-J增殖能力的检测 HD11细胞接种6孔细胞培养板后感染ALV-J(毒株JS09GY3)(MOI=5)。病毒感染后4 h,根据Lipofectamine™ 3000 Transfection Reagent说明书分别将pcDNA3.1-lnc-ALVE-AS1(2 µg)和pcDNA3.1-GFP(2 µg)重组真核表达载体质粒转染至HD11细胞。病毒感染后48 h,收集上清液,按照IDEXX禽白血病抗原检测试剂盒的操作步骤,ELISA检测细胞上清中ALV-J p27蛋白表达水平。细胞上清中的ALV-J效价检测通过间接免疫荧光分析后计算出ALV-J的TCID50。同时,收集细胞并提取总RNA,并按照材料与方法1.4所述步骤检测lnc-ALVE1-AS1和ALV-J囊膜基因env表达水平。
1.6 长非编码RNAlnc-ALVE-AS1转染HD11细胞后天然免疫基因表达的检测 HD11细胞接种6孔细胞培养板后,根据Lipof ectamine™ 3000 Transfection Reagent说明书分别将pcDNA3.1-lnc-ALVE-AS1(2 µg)和pcDNA3.1-GFP(2 µg)重组真核表达载体质粒转染至HD11细胞。质粒转染后36 h收集细胞并提取总RNA,并按照材料与方法1.4所述步骤检测TLR3、IRF7、IFN-α、IFN-β、MX1、OASL和IFITM3表达水平。
1.7 长非编码RNAlnc-ALVE-AS1诱导TLR3信号分析
1.7.1 TLR3干扰后lnc-ALVE-AS1转染HD11细胞天然免疫基因表达的检测 针对鸡TLR3序列(NM_001011691.3),由Thermo Fisher Scientific公司设计合成两对RNA干扰序列,具体序列如下:TLR3_Stealth_1 S:5'-CCGAGUACAGCAAUCUGAU UUACUU-3';TLR3_Stealth_1 AS:5'-AAGUAA AUCAGAUUGCUGUACUCGG-3';TLR3_Stealth_2 S:5'-CAGCAAAUUUAGGAUUGCAGCAACA-3';TLR3_Stealth_2 AS:5'-UGUUGCUGCAAUCC UAAAUUUGCUG-3'。
H D 1 1 细胞 接种6 孔细胞培养板后,按照Lipofectamine™ RNAiMAX Transfection Reagent说明书进行TLR3 siRNA转染。TLR3 siRNA转染后12 h转染lnc-ALVE1-AS1,具体步骤按照Lipofectamine™3000 Transfection Reagent说明书进行,lnc-ALVE1-AS1转染细胞后36 h收集细胞并提取总RNA。然后,按照材料与方法1.4所述步骤检测Ⅰ型干扰素(IFN-α和IFN-β)的表达水平。
1.7.2 TLR3下游信号抑制后lnc-ALVE-AS1转染HD11细胞天然免疫基因表达的检测 TLR3下游TBK1/IKKε抑制剂Amlexanox(InvivoGen,处理浓度100 μmol/L)作用HD11细胞2 h后转染lnc-ALVE1-AS1。细胞转染后36 h收集细胞并提取总RNA。然后,按照材料与方法1.4所述步骤检测Ⅰ型干扰素(IFN-α和IFN-β)的表达水平。
1.7.3 lnc-ALVE1-AS1与TLR3共定位分析 长非编码RNAlnc-ALVE1-AS1和TLR3蛋白在HD11细胞内的共定位通过RNA FISH(Fluorescence in situ Hybridization)实验来确定。靶向lnc-ALVE1-AS1全长序列lncRNA FISH Probe Mix由广州锐博生物科技有限公司设计合成。首先,参照RiboTMFluorescent In Situ Hybridization Kit说明书将lnc-ALVE1-AS1探针过夜杂交后分别进行鸡TLR3抗体(Novus Biologicals,NBP2-24565)和山羊抗兔IgG(Alexa Fluor®488)孵育。然后,加入DAPI染色液,染色10 min。避光条件下,从孔中小心取出细胞爬片,用封片剂将其固定于载玻片上,最后,通过Leica SP8共聚焦荧光显微镜观察并采集图像。
1.8 统计分 析与作图 用SPSS软件(version 19.0)和Excel GraphPad(Prism 5)软件进行统计分析和作图。所有实验数据以t检 验比较组间差异并以Mean±SEM表示,*表示差 异显著(P<0.05),**表示差异极显著(P<0.01)。
2 结果
2.1 ALV-J感染HD11后lnc-ALVE1-AS1的表达检测结果 首先分析了lnc-ALVE-AS1在ALV-J感染鸡巨噬细胞系HD11中的表达规律。与未感染ALV-J的对照组相比,lnc-ALVE1-AS1在ALV-J感染HD11细胞12 h和24 h后持续下调。并且,在感染后24 h显著下调(图1)。

图1 lnc-ALVE-AS1 在ALV-J 感染HD11 细胞的表达检测结果Fig.1 Expression detection results of lnc-ALVE-AS1 in ALV-J infected HD11 cells
2.2 长非编码RNAlnc-ALVE1-AS1转染HD11细胞后ALV-J增殖能力的检测结果 既然ALV-J在感染巨噬细胞过程中抑制lnc-ALVE1-AS1表达,那么意味着lnc-ALVE1-AS1可能具有抵抗ALV-J增殖的能力。由此,进一步观察lnc-ALVE1-AS1对ALV-J增殖的影响。结果显示:与GFP对照组相比,ALV-Jenv基因mRNA表达水平在lnc-ALVE1-AS1转染后48 h的HD11细胞显著下调(图2A,2B)。同时,过表达lnc-ALVE1-AS1也显著减少细胞上清液中ALV-J p27蛋白表达(图2C)。与此结果一致的是,与对照组相比,HD11上清中的ALV-J的病毒效价在lnc-ALVE1-AS1转染后48 h明显减少(图2D)。这些结果证实了过表达lnc-ALVE1-AS1可以显著抑制ALV-J在鸡巨噬细胞HD11中增殖。
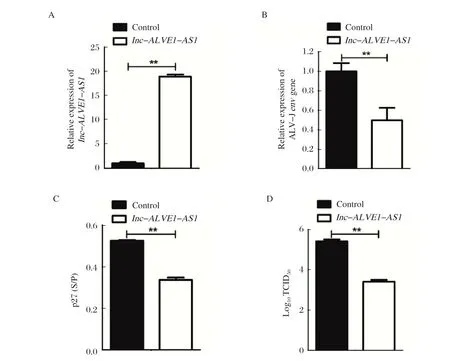
图2 长非编码RNA lnc-ALVE-AS1 转染HD11 细胞后lnc-ALVE-AS1(A)表达以及ALV-J 增殖能力的RT-qPCR(B)、ELISA(C)和TCID50(D)检测结果Fig.2 Expression detection results of lnc-ALVE-AS1(A) as well as RT-qPCR (B), ELISA (C) and TCID50 (D) for ALV-J proliferation after HD11 cells were transfected with long coding RNA lnc-ALVE-AS1
2.3 长非编码RNAlnc-ALVE1-AS1转染HD11细胞后天然免疫基因表达的检测结果 既然lnc-ALVE-AS1可以抑制ALV-J在HD11细胞中增殖,那么过表达lnc-ALVE1-AS1应该可以激活抗病毒天然免疫基因表达。如图3所示,过表达lnc-ALVE1-AS1显著上调dsRN A识别受体TLR3和Ⅰ型干扰素(IFN-α和IFN-β)在HD11细胞中表达(图3)。另外,lnc-ALVE1-AS1也诱导其他抗病毒天然免疫基因(IRF7、MX1、OASL和IFITM3)在HD11细胞中表达。这说明lnc-ALVE1-AS1可以激活HD11细胞抗病毒天然免疫。

图3 长非编码RNA lnc-ALVE-AS1 转染HD11 细胞后天然免疫基因表达的检测结果Fig.3 Expression detection results of innate immune genes in HD11 cells transfected with the plasmid pcDNA3.1-lnc-ALVE1-AS1
2.4 长非编码RNAlnc-ALVE1-AS1诱导TLR3信号分析结果 值得注意的是,lnc-ALVE-AS1显著激活TLR3及其下游Ⅰ型干扰素在HD11细胞中的表达,这说明TLR3信号可能是lnc-ALVE1-AS1激活抗病毒天然免疫的一个重要途径。首先,通过干扰TLR3表达后再转染lnc-ALVE1-AS1,与对照组相比,干扰TLR3后显著抑制lnc-ALVE1-AS1诱导Ⅰ型干扰素(IFN-α和IFN-β)的表达(图4A)。接下来,通过TLR3信号抑制 剂Amlexanox(TBK1/IKKε inhibitor)阻断TLR3-TRIF-TBK1/IKKε-TypeⅠinterferons信号通路2 h后,再转染lnc-ALVE1-AS1。结果显示:与对照组相比,Amlexanox处理后也显著抑制了lnc-ALVE1-AS1诱导Ⅰ型干扰素(IFN-α和IFN-β)表达(图4B)。最后,通过共定位实验观察到lnc-ALVE1-AS1可以与TLR3蛋白直接相互作用(图4C)。这说明lnc-ALVE1-AS1可能通过TLR3信号激活HD11细胞抗病毒天然免疫。

图4 长非编码RNA lnc-ALVE-AS1 诱导TLR3 信号分析结果Fig.4 Analysis results of induction of TLR3 signals by long non-coding RNA lnc-ALVE-AS1
3 讨论
本研究发现长非编码RNAlnc-ALVE1-AS1抑制ALV-J在鸡巨噬细胞中增殖。在小鼠巨噬细胞也发现内源性反转录病毒衍生的长非编码RNA lnc-EPAV可以增强宿主的抗病毒免疫并抑制病毒增殖[4]。另外,鸡内源性反转录病毒ALVE衍生的piRNA可能参与抵抗禽白血病病毒[10]。因此,鸡内源性反转录病毒ALVE衍生的非编码RNA如lncRNA和piRNA可能是细胞免疫应答的重要组成部分以增强宿主抵抗外源性病毒感染。
通过激活TLR3信号介导的Ⅰ型干扰素应答可能是lnc-ALVE1-AS1抑制ALV-J在巨噬细胞中增殖的一个重要机制。过表达lnc-ALVE1-AS1显著激活TLR3和Ⅰ型干扰素(IFN-α和IFN-β)等抗病毒天然免疫基因表达。然而,lnc-ALVE1-AS1这种能力在干扰TLR3或者抑制TLR3信号后显著减弱。共聚焦定位分析显示在巨噬细胞中lnc-ALVE1-AS1可以与TLR3蛋白直接结合。此外,研究也发现TLR3配体刺激会诱导大量lncRNAs异常表达[11],暗示lncRNA可作为TLR3识别信号和天然免疫的调节因子[12]。这些结果说明诱导TLR3信号是lnc-ALVE1-AS1激活抗病毒天然免疫的一个重要机制。
研究表明,内源性反转录病毒衍生的RNA能够被TLR3蛋白识别并激活抗病毒天然免疫。TLR3是一个重要的细胞内双链 RNA(Double stranded RNA,dsRNA)识别受体并参与抗病毒反应[13]。在哺乳动物中,内源性逆转录病毒RNA可以通过识别受体TLR3触发信号传导以增强干扰素应答[14-16]。关键的dsRNA识别受体TLR3在lnc-ALVE1-AS1转染后的巨噬细胞中显著上调,说明dsRNA可能是lnc-ALVE1-AS1发挥作用的一个重要因素。长非编码RNAlnc-ALVE1-AS1是一个反义lncRNAs,可能与其序列互补的正义RNA形成dsRNA。另外,lnc-ALVE1-AS1自身结构中可能形成一些短dsRNA片段。这些dsRNA可以被TLR3识别并激活抗病毒天然免疫。这种行为类似于去甲基化抑制剂5-Aza-dC通过激活源自内源性反转录病毒dsRNA来诱导干扰素应答反应[14-15]。除了识别dsRNA,TLR3还可以识别病毒衍生的带有凸起/内环的茎结构的单链RNA片段[17-18]。生物信息学分析预测发现lnc-ALVE1-AS1可以形成许多带有凸起/内环的茎结构,这些独特的RNA结构可能被TLR3识别。然而,关于lnc-ALVE1-AS1如何调节TLR3的机制尚不清楚,还有待进一步研究。
综上所述,本研究揭示了长非编码RNAlnc-ALVE1-AS1在巨噬细胞中抗病毒功能及其作用机制,为进一步研究内源性反转录病毒在巨噬细胞中的抗病毒功能和机制奠定了基础。
