猪流行性腹泻病毒PEDV SD 株的分离及体外3D 肠道类器官感染模型建立
2024-05-09蔡鸿明吕丽蕾姜一峰虞凌雪李丽薇李国新周艳君刘长龙童光志
蔡鸿明,张 敏,吕丽蕾,姜一峰,高 飞,虞凌雪,童 武,李丽薇,李国新,周艳君,刘长龙,童光志
(1.福建农林大学动物科学学院(蜂学学院),福州 350002;2.中国农业科学院上海兽医研究所,上海 200241)
猪流行性腹泻病毒(Porcine epidemic diarrhea virus, PEDV)会可引起猪特别是新生仔猪的呕吐、腹泻和食欲下降,发病率和死亡率高[1]。PEDV感染会导致明显的肠绒毛萎缩,体内肠细胞磷酸酶活性下降,对营养物质的吸收受限,肠腔内堆积大量液体,小肠组织出血充血呈半透明状,对养殖业危害巨大[2-3]。
对于PEDV的研究,有研究人员将仔猪来源的小肠上皮细胞引入人端粒酶逆转录酶(human telomerase reverse transciptase, HTERT)基因而获得永生化的猪小肠上皮传代细胞系(Intestinal epithelial cells, IECs)[4]。然而,只有一种非转化、非致瘤性猪空肠上皮细胞系IPEC-J2,被用于研究PEDV如何拮抗宿主细胞的抗病毒活性[5]。但是,有研究表明由于IPEC-J2的异质性强,PEDV感染该细胞系的效率非常低[6]。2019年,李慧春等[7]将PEDV用于感染猪原代IECs,1 d时间即可见明显的细胞病变。
肠道类器官可以生成多种肠上皮类型细胞,已经广泛用于包括遗传性疾病、恶性肿瘤等多种疾病模型研究[8-9]。与传统的体外转化细胞株模型不同,肠道类器官接近在活体生物体内的生理状态,可以更为直观的展示了宿主与病毒的相互作用,代表了肠道冠状病毒感染肠上皮的一种新的理想模型[10-12]。但是,类器官作为病毒感染模型应用的研究较少,主要是因为类器官培养方法、感染方法、3D细胞荧光染色成像、基因编辑等技术还是存在一定难度,限制了类器官感染模型的应用发展,特别是在兽医研究领域应用的更少。
本研究首先分离了PEDV的毒株,命名为PEDV SD株,设计了PCR引物,分6个片段快速扩增,获得了PEDV SD株的全基因组序列。并且从仔猪小肠成功分离了猪小肠隐窝组织,在体外培养成猪小肠类器官,使用PEDV SD株感染肠道类器官试验,通过对感染后的3D类器官和2D类器官细胞进行免疫荧光试验,证明了PEDV可以很好的感染猪小肠类器官,为PEDV致病机制的研究奠定了基础。
1 材料和方法
1.1 质粒、菌种及试剂 试验病料采自于山东PEDV发病猪场,病料经PEDV检测为阳性;DMEM细胞培养基、0.25% Trypsin-EDTA、1×PBS、胎牛血清FBS、TrypLETMExpress购自Gibco公司;肠类器官培养基由本实验室配方自行配制;QIAamp®Viral RNA Mini KIT购自QIAGEN公司;E.Z.N.®Gel Extraction Kit 购自OMEGA公司;Prime Script Ⅱ lst Strand cDNA Synthesis Kit、PrimeStar GXL、pMD18-T载体均购自TaKaRa公司;鼠抗PEDV N蛋白单克隆抗体由本实验室保存;山羊抗小鼠IgG Alexa Fluor 488二抗购自Thermo公司;基质胶Matrigel购自Corning公司;Vero细胞由本实验室保存。
1.2 样品处理、病毒分离培养 将发病仔猪的肠内容物用PBS和双抗稀释后离心,用0.22 μm的滤器过滤,放于-80℃冰箱保存。传代Vero细胞,至细胞长满时,以一定的剂量接种到Vero细胞培养,并盲传3代,等细胞出现病变,收取病毒液,冻存于-80℃备用。利用PEDV N蛋白通过IFA实验检测PEDV在Vero细胞上的增殖情况。
1.3 样品RNA的提取、反转录为cDNA 按照QIAamp®Viral RNA Mini KIT说明书提取样品中RNA。按照Prime Script Ⅱ lst Strand cDNA Synthesis Kit说明书对RNA进行反转录,反转录的程序为:42℃水浴1 h,70℃反应15 min,将产物置于-40℃冰箱保存备用。
1.4 PEDV SD株全基因组扩增、克隆及序列测定根据NCBI上PEDV的全基因序列设计扩增引物(表1),扩增病毒全长序列。以1.3步骤反转录生成的cDNA为模板,使用PrimeStar GXL聚合酶,按说明书对分离病毒全基因进行分段扩增。用胶回收试剂盒回收并纯化鉴定正确的目的条带。将纯化产物与T载体连接、转化、涂板、经蓝白斑筛选,挑取白色阳性菌落送至上海擎科生物公司进行测序。

表1 PEDV SD 株全基因组测序所用引物Table 1 Primers used for whole genome sequencing of PEDV SD strain
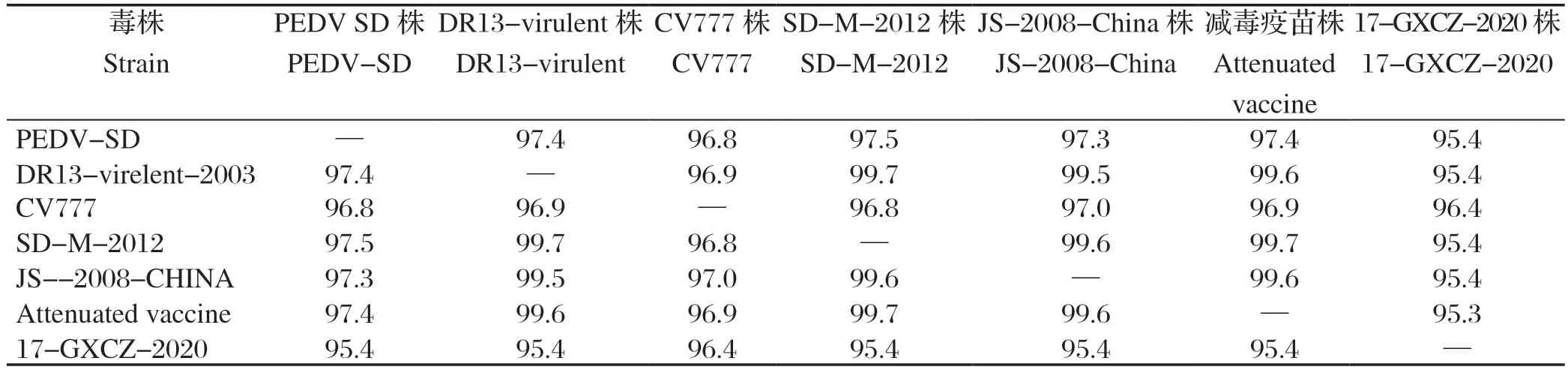
表2 PEDV SD 株全基因组核苷酸同源性比较(%)Table 2 Comparison of genome-wide nucleotide homology in PEDV SD strain (%)
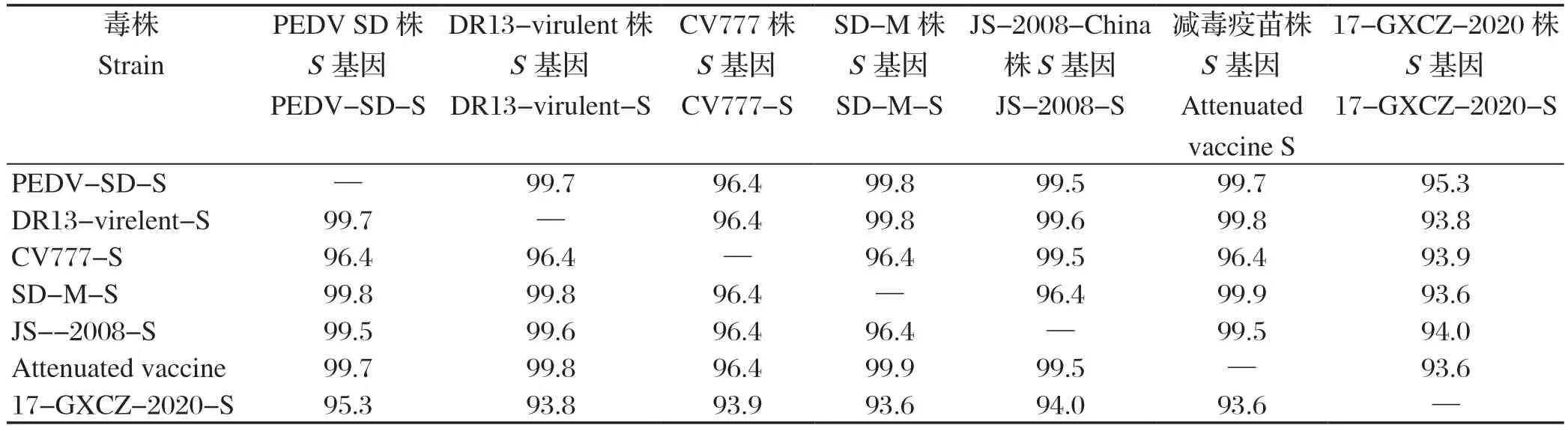
表3 PEDV SD 株S 基因核苷酸同源性比较(%)Table 3 Comparison of the nucleotide homology of the PEDV SD strain S genes (%)
1.5 PEDV SD株全基因、S基因序列比对 利用DNAStar软件对全基因组测序结果进行拼接比对。拼接完的全基因组序列、S基因序列与NCBI上国内外40株PEDV的参考毒株序列进行遗传进化分析,构建遗传进化树。
1.6 猪小肠3D类器官分离及培养 取10日龄仔猪小肠组织剥离肠内容物,PBS清洗处理后将肠道组织剪碎并用2.5 mmol/L的EDTA消化1 h,将分离到的小肠隐窝包埋在细胞基质Matrigel中,待细胞基质凝固后,加入1 mL的类器官培养液[13]。培养至第7 d,类器官中央变大变黑,可以进行传代。传代时,弃去培养板中的上清液,用普通培养基吹打下来沉淀,500 ×g离心4 min,弃去上清液。向类器官沉淀中加入1 mL TrypLE消化类器官,消化5~10 min,并用1 mL的枪头吹打几次将类器官打散,然后加入培养基稀释TrypLE,500 ×g离心4 min去上清液,重新用细胞基质Matrigel重悬消化过的类器官,铺至24孔板上,10 min后待细胞基质凝固后加适量的类器官培养基。
1.7 2D类器官细胞的培养 3D类器官培养至6 d左右,用TrypLE消化2 min成单细胞后,加入到6孔细胞培养板中,37℃培养2~3 d即可见2D形状的猪肠道类器官细胞。
1.8 病毒感染类器官 收集24孔板中生长状况良好的3D类器官细胞去除基质胶后,添加适量的病毒液。4 h后,重新用基质胶将细胞铺至24孔板中培养24 h。12孔板中生长良好的2D小肠类器官细胞,按照常规的PEDV接种方法接毒2 h后进行换液并培养24 h。
1.9 3D类器官和2D类器官细胞的荧光成像 3D类器官或2D的类器官细胞感染PEDV后48 h后,分别收集相应的3D类器官和2D类器官细胞,用4%多聚甲醛溶液在4℃下固定3D类器官或2D类器官细胞45 min,Triton X-100通透20 min后,进行一抗、二抗孵育,DAPI染核色5 min,在荧光显微镜下拍照观察。
2 结果
2.1 PEDV SD株的分离鉴定 用分离的病毒液感染Vero细胞,24 h后,接毒组开始出现多核、皱缩、脱落等病变(图1)。荧光视野下,与对照组相比,接毒组出现明显的多核包体、荧光信号强,进一步证实了该分离株为PEDV。将分离株命名为PEDV SD株(图2)。

图1 PEDV SD 株感染Vero 细胞病变观察结果Fig.1 Observation of PEDV SD strain infection with Vero cells
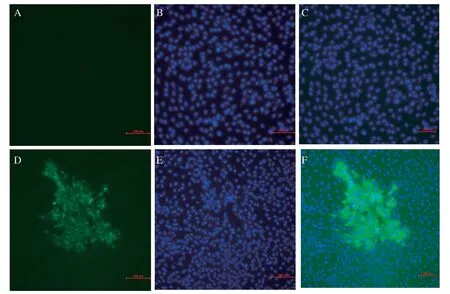
图2 Vero 细胞的间接荧光免疫检测结果Fig.2 Results of indirect f luorescence immunodetection of Vero cells
2.2 PEDV SD株全基因测序 以反转录产物为模板,以表1序列为引物,成功扩增出PEDV SD株的全基因组DNA片段,鉴定结果与预期大小相符(图3)。利用DNAStar对测序结果进行拼接,获得PEDV SD株的全基因组序列,并提交至GenBank,登录号为MZ596343.1。

图3 PEDV SD 株的全基因组PCR 扩增结果Fig.3 Results of the genome-wide PCR amplif ication of PEDV SD strain
2.3 PEDV SD株全基因组序列进化树分析 利用MEGA 6.0软件绘制PEDV SD株与国内外40株PEDV的全基因组、S基因序列的系统进化树,分析其与其他毒株的遗传进化关系(图4)。LEE等[14]根据S基因序列,将PEDV分为Gl和G2两个分支。其中Gl经典毒株亚群分为Gla和G1b,G2变异毒株亚群分为G2a和G2b。Gla包括经典毒株SM98、CV777等毒株;Glb包括DR13-attenuated、DR13-2003韩国毒株。根据遗传进化分析结果,我们可以看到PEDV SD株属于经典毒株的G1b分支,与同分支参考亚群的同源性高,普遍大于97%,与DR13-2003韩国毒株全基因同源性也有97.4%,与G1a分支经典毒株CV777则为96.8%,与G2b分支17-GXCZ-2020同源性只有95.4%。基于S基因序列比对,结果显示与全基因序列比对具有一致性,分支内同源性高于99%,而与CV777只有96.4%,17-GXCZ-2020为95.3%。

图4 PEDV SD 株 S 基因和全基因组核苷酸遗传进化分析Fig.4 PEDV SD strain S gene and genome-wide nucleotide genetic evolution analysis
2.4 肠道3D类器官细胞的培养 3D肠道类器官细胞生长状况良好。传代1 d后的类器官细胞已形成圆形结构。在培养第3 d,肠道干细胞增殖并分化为囊状球状体结构,培养至7 d左右的类器官中央变大变黑时可以进行传代培养(图5)。
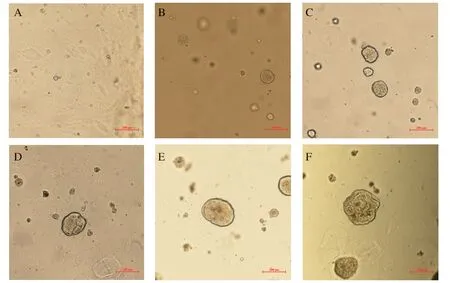
图5 小肠类器官细胞传代过程中的形态学变化Fig.5 Morphological changes in diff erent passage of small intestinal organoids
2.5 PEDV SD株感染类器官细胞 在感染24 h时收集3D和2D类器官、固定、染色。在荧光视野下,可以看到接毒组的类器官细胞有明显的荧光信号,表明PEDV SD株感染了类器官的细胞(图6,图7)。

图6 2D 类器官细胞的间接免疫荧光检测结果Fig.6 Results of indirect immunof luorescence detection of cells from 2D organoids

图7 3D 类器官细胞的间接免疫荧光检测结果Fig.7 Results of indirect immunof luorescence detection of cells from 3D organoids
3 讨论
PEDV属于冠状病毒属,基因组全长28 kb,传统全基因组测序需要设计10~20对引物才能扩增得到病毒的全基因。本研究设计了6对引物并成功扩增得到病毒28 kb基因组序列,完成病毒快速全基因组扩增及测序。从遗传进化树结果发现,PEDV SD株属于经典毒株的G1b分支,存在与经典毒株类似的氨基酸插入、缺失位点,再次证明临床上仍然存在经典PEDV的流行,提示在PEDV的免疫防控上要做到经典毒株与变异毒株的兼顾。
本研究分离了猪肠道隐窝干细胞并在体外培养分化成肠类器官,使用PEDV SD株感染类器官,建立了PEDV感染猪小肠类器官试验模型。3D类器官荧光染色一直较为困难,特别是病毒感染的荧光染色,对染色方法和拍摄显微镜有较高的要求,本实验通过多次试验成功完成了3D类器官细胞的荧光染色及拍照,并且通过3D荧光成像重现了体内猪肠道中PEDV地感染,完善了猪小肠类器官试验模型中PEDV感染细胞和免疫荧光试验的方法,为PEDV感染猪肠道的研究提供了良好的体外模型。
本项目基于国内外的文献报道,通过优化培养条件来建立可在体外长期传代培养的猪肠道类器官,为PEDV的研究提供新的研究模型,突破了一直以来制约PEDV体外研究的瓶颈。基于对该模型的研究可能会加速旨在改善肠道健康的兽医疗法的设计,从而为目前的冠状病毒疾病的治疗防控提供了新的理论指导,也是对现有PEDV机制的进一步生物学认识进行了扩展。
