基于Nomgram模型对老年阵发性房颤病人合并高尿酸血症临床预测模型的初步探索
2024-05-09戎成振卢家忠杨静静
戎成振,卢家忠,杨静静
(安徽省阜阳市第二人民医院 1.心内科,2.内分泌科,236015)
心房颤动(atrial fibrillation,AF)是指原本规则有序的心房电活动转变成快速无序的颤动波,是临床常见的心律失常[1]。其中阵发性房颤(paroxysm atrial fibrillation,PAF)病人会感到心悸、心慌、气短、乏力、烦躁等,一般持续时间<7 d(常<48 h),可自行终止,但具有反复发作的特点,若不及时治疗,可诱发血栓栓塞,加重心力衰竭,提高病人死亡风险[2-3]。随着我国人口老龄化发展加剧以及心电图检查的普及,近年AF发病率不断攀升,其中80岁以上人群患病率可高达8.3%[4]。研究[5-6]证实,高尿酸血症(hyperuricemia,HUA)不仅是AF发生发展的危险因素,还能促使脑卒中发生。故尽早识别诱发HUA的因素对于临床防治工作具有重要价值。目前关于PAF合并HUA的研究大多集中在发病原因、影响因素等方面,尚较少有报道建立相关预测模型[7]。列线图是一种由一簇互不相交的线段将多因素回归分析结果展示在同一平面上的定量预测图形,凭借可视可读、简捷实用的优势,在医学领域中逐渐得以广泛应用[8]。本研究拟在单因素分析、Lasso和多因素logistic回归分析的基础上建立PAF合并HUA风险预测列线图模型,以期为PAF合并HUA的临床防治工作提供参考。
1 资料与方法
1.1 研究对象
回顾性选取2020年9月至2021年9月我院心内科收治的471例老年PAF病人作为研究对象,以发生HUA为随访结局事件,末次随访时间为2021年11月。根据PAF病人是否合并HUA发生,将其分为HUA组45例和非HUA组426例。本研究已通过医院伦理委员会批准。纳入标准:(1)符合《2020 ECS/EACTS心房颤动诊断和管理指南》[9]中关于PAF诊断标准;(2)经影像学检查确诊为PAF;(3)年龄≥60岁,性别不限;(4)临床资料完整;(5)病人均签署知情同意书。排除标准:(1)智力低下或患有精神疾病者;(2)患有炎性疾病、自身免疫性疾病或呼吸系统疾病者;(3)服用除利尿剂外影响尿酸代谢的药物者;(4)肾功能不全、甲状腺功能异常及家族性遗传血脂异常者;(5)合并其他恶性肿瘤疾病者;(6)随访过程中失访者。
1.2 方法
1.2.1 资料收集 参考既往文献[10-11]关于HUA危险因素,结合本院心内科专家意见收集资料。(1)基本信息:性别、年龄、体质量指数(BMI)、吸烟、饮酒;(2)基础疾病:糖尿病、高血压、心血管疾病(冠心病、心肌梗死、心绞痛、心力衰竭和短暂脑缺血病者等)、非酒精性脂肪肝;(3)实验室指标:氨基末端脑钠肽前体(NT-proBNP)、血红蛋白(Hb)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、三酰甘油(TG)、总胆固醇(TC)、血肌酐(Scr)、尿素氮(BUN)、尿酸(UA)、白蛋白(ALB)和24 h尿总蛋白定量。
1.2.2 血液生化指标检测 空腹状态下分别抽取研究对象肘部静脉血5 mL,置入抗凝负压管待检。应用德国西门子自动生化仪(SIEMENS Advia 2400型)检测血清中NT-proBNP、Hb、HDL-C、LDL-C、TG、TC、Scr、BUN、UA和ALB等水平,分别以125 ng/L、110 g/L、1.0 mmol/L、0.34 mmol/L、1.7 mmol/L、5.2 mmol/L、96 μmol/L、7.14 mmol/L、400 μmol/L、35 g/L为各指标截点值。
1.2.3 尿液指标检测 分别采集研究对象24 h尿液,混匀后取5~10 mL送检,并记录24 h尿液总量。采用干化学法分析尿常规和24 h尿液标本,应用全自动生化分析仪检测24 h尿总蛋白定量,以150 mg为截点值。
1.3 相关标准
(1)HUA诊断标准:在嘌呤饮食正常状态下,非同一天2次空腹血检测UA水平,女性>360 μmol/L(6 mg/dL),男性>420 μmol/L(7 mg/dL)。(2)BMI:采用《中国成人超重和肥胖症预防控制指南》中标准[12],超重为BMI >24 kg/m2,肥胖为BMI >28 kg/m2。(3)吸烟:吸烟≥1支/d,且持续>6个月。(4)饮酒:饮酒≥1次/周,且持续>1个月。(5)糖尿病:空腹血糖(FPG)≥7.0 mmol/L,或糖耐量试验中服糖后2 h血糖(2hPG)≥11.1 mmol/L,或随机血糖≥11.1 mmol/L。(6)高血压:收缩压≥140 mmHg,舒张压≥90 mmHg。(7)高血脂:①TC≥ 5.2 mmol/L;②TG≥ 1.7mmol/L;③HDL-C<1.0 mmol/L;④LDL-C≥ 3.4 mmol/L。空腹状态下检查静脉血浆时符合以上任意一项指标或以上均可诊断为血脂异常。
1.4 统计学方法
采用χ2检验、logistic回归分析、Lasso回归分析和ROC曲线分析。
2 结果
2.1 PAF病人合并HUA的单因素分析
2组年龄、心血管疾病、吸烟、饮酒、NT-proBNP、Hb、HDL-C、LDL-C、TG、TC、BUN、UA、ALB和24 h尿总蛋白定量差异均无统计学意义(P>0.05),而性别、BMI、糖尿病、高血压、高血脂、非酒精性脂肪肝和Scr差异均有统计学意义(P<0.05~P<0.01)(见表1)。
表1 PAF病人合并HUA的单因素分析(n)
2.2 PAF病人合并HUA的预测因素筛选
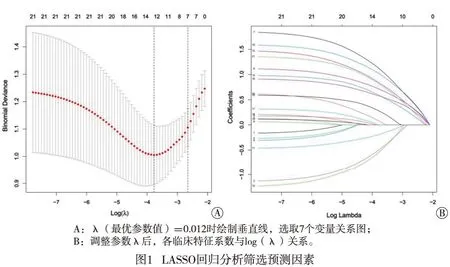
基于471例PAF病人参数资料进行LASSO回归分析,结果显示,性别、BMI、糖尿病、高血压、高血脂、非酒精性脂肪肝和Scr是系数不为0的预测因素(见图1)。
2.3 PAF病人合并HUA多因素logistic回归分析将经单因素分析和LASSO回归分析筛选因素作为自变量,以PAF病人是否合并HUA为因变量(赋值见表2),进行logistic回归分析,结果显示,BMI>28 kg/m2、糖尿病、高血压、高血脂、非酒精性脂肪肝和Scr>96 μmol/L均为PAF病人合并HUA的独立危险因素(P<0.05~P<0.01)(见表3)。

表2 多因素logistic回归分析变量赋值

表3 PAF病人合并HUA的多因素logistic回归分析
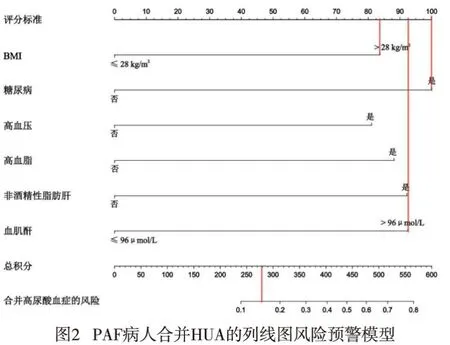
2.4 PAF病人合并HUA列线图风险预警模型建立基于6项独立危险因素建立PAF病人合并HUA的风险列线图预警模型(见图2),各条评分线左侧端点均对应为0分,右侧端点自BMI指标起依次为83分、100分、81分、89分、92分、92分,总分537分。使用方法:例如,1例PAF病人BMI>28 kg/m2,又患有糖尿病,同时Scr>96 μmol/L,那么合并HUA风险为83+100+92=275分,与之对应的HUA风险约为16%左右。
2.5 PAF病人合并HUA列线图风险预警模型验证模型验证结果显示,模型一致性指数(C-index)为0.797(95%CI:0.763~0.832),表明列线图辨别力较好;预测值与实测值基本一致,校正曲线趋近于理想曲线(见图3),表明预测准确性良好;内部验证PAF合并HUA的列线图风险模型AUC为0.803(95%CI:0.779~0.827)(见图4),表明区分度良好;决策曲线显示,阈值概率在5%~93%范围内时,该模型具有较高的净获益值(见图5)。
3 讨论
研究[13]证实,氧化应激参与了房颤的发生和发展,可致心房电重构及结构重构。氧化应激状态主要与大量的活性氧族(reactive oxygen species,ROS)产生有关,ROS能够直接造成心肌细胞肥厚及纤维化、细胞凋亡、DNA损伤等。心肌中ROS水平的增高可介导AF病人心房肌纤维化,致使心房结构性重构[14]。研究[15]表明,HUA与炎性反应和氧化应激密切相关。尿酸是一种嘌呤化合物的代谢产物,其形成过程是由次黄嘌呤转化为黄嘌呤,再通过黄嘌呤转化成尿酸,而这些反应都需要黄嘌呤氧化酶(XOD)的催化,尿酸水平升高可增强XOD活性,激活XOD可引起大量ROS产生,导致心房结构重构,推动房颤产生[16]。研究[17-19]证实,HUA与AF密切相关。本研究中,471例PAF病人中并发HUA 45例,发生率为9.55%。
Lasso回归是通过构造一个惩罚函数得到一个较为精炼的模型,可同时进行参数估计和变量选择,不仅能克服逐步回归变量选择方法的局限性,还可以保留子集选择的可解释性和岭回归的稳定性,适合多个影响因素的变量选择问题[20]。Logistic回归是一种非线性概率型的预测模型,能够研究分类观察结果和一些协变量之间的关系,临床上一般用来分析诱发疾病的高危因素[21]。
既往研究[11,22]显示,肥胖是HUA的独立危险因素。原因可能是肥胖人群体内存在促肾上腺皮质激素和雄性激素水平低下等内分泌功能紊乱现象,进而抑制尿酸的排泄;另外,肥胖人群每天摄入热量较多,包含嘌呤类食物,可加速尿酸生成,同时在脂肪代谢过程中产生较多的酮酸,而酮酸会抑制尿酸的排泄,因此,控制体质量对预防HUA发生意义重大。任娜等[23]研究显示,糖尿病是诱发HUA的危险因素,分析原因可能是糖尿病病人体内存在高胰岛素血症,胰岛素抵抗是尿酸排泄减少的重要因素之一。胰岛素抵抗会增强肾脏近曲小管细胞表面的Na+-H+泵活性,从而起到提高尿液的重吸收作用,并引起尿液酸化和水钠潴留,减少尿酸排泄。徐媛玉等[24]研究证实,高血压是诱发HUA的重要危险因素,分析原因是高血压能够损害血管内皮及其功能,引起肾小球动脉粥样硬化,有效降低肾小球滤过率,提升乳酸水平,抑制尿酸代谢,降低尿酸排泄,从而导致血尿酸升高;同时,高血压也可造成肾小管缺氧缺血,引发肾脏微小血管病变和离子交换系统运转失常等,导致肾小管分泌尿酸减低,进而提升血尿酸水平。另外,一部分高血压病人常伴发糖脂代谢紊乱、胰岛素抵抗和代谢综合征等问题,造成体内嘌呤类化合物产生代谢异常。还有高血压病人可能会长时间服用噻嗪类利尿剂用来调控血压,亦可导致尿酸水平升高。因此,高血压病人更易诱发HUA。张媛媛等[25]研究表明,HUA与非酒精性脂肪肝的发生和发展密切相关,非酒精性脂肪肝的发生风险会随着血尿酸水平增高而增高。HUA和非酒精性脂肪肝的中心环节是胰岛素抵抗。胰岛素抵抗能够激活肾素-血管紧张素系统,而血管紧张素Ⅱ一方面通过加剧氧化应激,推动尿酸合成,另一方面可以降低肾血流量,减少尿酸排泄,另外,尿酸还可以作为炎性因子,造成内皮细胞功能异常,参与非酒精性脂肪肝的发生和发展。陈佳丽等[27]研究证实,Scr水平为HUA的影响因素,分析原因可能是肌酐作为一种小分子物质,能够经肾小球滤过,使得在肾小管内被较少吸收。另外,肾小球的滤过能力可控制Scr水平变化,高水平的Scr代表了肾小球滤过能力降低,也代表了肾脏排泄功能的衰弱,可导致体内尿酸潴留,形成HUA。本研究logistic回归分析结果显示,BMI>28 kg/m2、糖尿病、高血压、高血脂、非酒精性脂肪肝及Scr>96 μmol/L均为PAF病人合并HUA的独立危险因素,这一结果佐证了上述各文献对诱发HUA危险因素的研究结论。
列线图主要由预测模型的变量、变量相应的得分和预测事件的发生概率三个部分组成,是近几年兴起的一种新的数据分析方式,可以把复杂的数据变成可视化图型,临床一般会将其用于表达预测模型中各变量之间的关系[28]。本研究根据筛选出的危险因素建立预测PAF病人合并HUA列线图模型,模型中,BMI>28 kg/m2为83分、糖尿病为100分、高血压为81分、高血脂为89分、非酒精性脂肪肝为92分、Scr>96 μmol/L为92分,医务人员可通过病人各项目得分个体化预测PAF合并HUA发生率,尽早识别高风险病人,对可控危险因素给予干预,开展护理工作分级,合理分配医疗资源。此外,模型验证结果显示C-index为0.797(95%CI:0.763~0.832),校正曲线的预测值与实测值基本一致,内部验证PAF合并HUA的风险列线图模型AUC为0.803(95%CI:0.779~0.827),均表明列线图具有良好的辨别度和预测效能。另外,本研究决策曲线显示阈值概率在5%~93%范围内时,列线图预测PAF合并HUA发生风险具有较高净获益值。

综上,BMI>28 kg/m2、糖尿病、高血压、高血脂、非酒精性脂肪肝以及Scr>96 μmol/L均为PAF病人合并HUA的独立危险因素,基于上述危险因素建立的列线图模型可较准确评估和量化PAF合并HUA风险。本研究局限性在于纳入的样本量有限,且均取自于同一研究中心,存在选择偏倚,未能纳入其他中心样本进行模型外部验证,有待纳入更多样本进行深入探讨。
