山药颗粒结合型淀粉合成酶基因DaGBSS的克隆与分析
2024-05-08王培龙杨燕萍付双彬杨周祥姚丽娟
王培龙, 徐 婉, 杨燕萍, 付双彬, 应 震, 杨周祥, 姚丽娟, 周 庄
(浙江省亚热带作物研究所1,温州 325005)
(瑞安市自然资源和规划局2,瑞安 325200)
山药为薯蓣科(Dioscoreaceae)薯蓣属(Dioscorea)具有双子叶植物特征的一年生或多年生缠绕性藤本植物[1,2],其块茎是主要的食用部位,有长、扁、圆3种不同形态[3]。山药地下块茎因含有丰富的淀粉、蛋白质、氨基酸、薯蓣皂苷及其他对人体有益的微量元素,具有增强免疫力、延缓衰老和抗氧化等功效,具有很高的营养保健和药用价值,在我国被广泛用作菜用鲜食和药材加工的原材料。因其块茎中的淀粉及蛋白质含量与谷物相当,又被视为粮食作物,是一种有着广阔前景的经济作物[4-8]。我国的山药栽培分布非常广,且地区间自然环境和气候差异较大,经过长期的自然适应和人工选择,在全国范围内形成多个栽培区域[9]。以长江为界,我国的山药栽培区域分为南方栽培区和北方栽培区[10],北方栽培地区的主要山药品种为薯蓣(D.opposite),即山药分类中的普通山药,包括许多品质优良的地方特色品种,如铁棍山药、嘉祥细毛长山药和西施种子等。南方地区不仅栽培薯蓣,同时也种植山薯(D.fordi)、参薯(D.alata)、日本薯蓣(D.japonica)和褐苞薯蓣(D.persirnilis)等。不同种类的山药因其基因表达、激素含量等不同从而影响其生长发育规律,且地区间环境的差异对其生长发育过程也有显著的影响。山药的种植地域辽阔,温度、水分和光照条件等差异大,在长期的栽培过程中形成了华南、华中、东北、西北和华北5个主要栽培区域,各区域所产山药的品质也各有差异[11]。
淀粉是山药的主要储藏物质,其性质和组成与山药的食用和加工品质有着密切关系[12]。大部分山药品种的淀粉组成以直链淀粉含量为主,口感上表现出粉性,如淮山药等;而部分种质则以支链淀粉为主,表现出极具特色的糯性口感。颗粒结合型淀粉合成酶(GBSS)在直链淀粉的合成中起关键作用,GBSS通过α-1,4糖苷键将ADPG中的葡萄糖残基添加到葡聚糖的非还原端上,来延长葡聚糖的直链[13]。GBSS包括GBSSI(也称为GBSS1)和GBSSII(也称为GBSS2)2种同工酶,GBSSI主要控制储藏器官中直链淀粉的合成,GBSSII主要控制非储藏器官中直链淀粉的合成[14]。
Wang等[15]报道了水稻GBSSI基因(又称蜡质基因或Wx基因)的全序列,该基因与玉米、小麦等单子叶植物的Wx基因相比,第1内含子较大,水稻GBSSII与GBSSI的结构相似,二者在氨基酸序列水平的一致性达到了66%[16]。在谷物中,GBSSI由Wx基因编码,在花粉、胚乳和胚囊中控制直链淀粉的合成,具有组织特异性,而GBSSII基因在叶、茎、根、果皮等非储藏组织中表达[17,18]。在栽培稻中,Wxa主要存在于籼稻中,Wxb则主要存在于粳稻中,并且纯合Wxa水稻胚乳内的蜡质蛋白表达量高于Wxb水稻蜡质蛋白,导致籼稻直链淀粉含量高于粳稻[19,20]。赵雨欣[21]对水稻OsGBSSI基因的启动子进行多靶向位点编辑,发现突变植株的直链淀粉含量出现了不同程度的降低,且突变株的直链淀粉含量随OsGBSSI基因表达量的下降而降低。沈革志等[22]将反义Wx基因和含潮霉素抗性的基因导入水稻,筛选出直链淀粉含量降低而无潮霉素抗性基因的植株。Chen等[23]将反义Wx基因转入水稻,发现部分水稻胚乳的直链淀粉质量分数降低,最低可达7.02%,比野生型低72.4%。玉米GBSSI和GBSSIIa参与玉米籽粒中直链淀粉的合成,GBSS基因在授粉15 d的胚乳中表达量较高,在根和叶中表达量较低[24,25]。高直链玉米比普通玉米具有更高的直链淀粉含量、更低的相对结晶度,可能是由于GBSSI和PUL基因的高表达量、SBEIIa基因和SBEIIb基因的低表达量导致的[26]。糯玉米中的GBSSI基因发生突变,会形成高支链淀粉[27]。
小麦中编码GBSS蛋白的基因为Wx基因,小麦Wx蛋白由Wx-A1、Wx-B1、Wx-D1编码,小麦籽粒中缺失不同Wx蛋白对GBSSI基因的相对表达量、GBSS活性、直链淀粉的积累量产生影响[28]。在小麦中高温胁迫使GBSSI基因的表达量提前到达顶峰[29]。在灌浆过程中大麦GBSSI主要负责直链淀粉的合成[30]。高粱籽粒中缺失GBSSI会导致其支链淀粉含量增加[31]。
在薯类作物中,刘玉汇等[32]从马铃薯块茎中克隆出GBSSI基因的cDNA序列,编码607个氨基酸,具有3个保守功能区域。马铃薯块茎形成过程中GBSS活性、GBSSI基因的表达量降低,淀粉黏度和回生值降低,直链淀粉含量增加,总淀粉含量减少[33]。通过CRISPR/Cas9技术对马铃薯的GBSS进行基因编辑,使马铃薯GBSS酶的功能完全丧失[34]。Veillet等[35]通过敲除优良四倍体马铃薯品种中产生直链淀粉的GBSSI基因,产生了直链淀粉生物合成受损的四等位基因突变马铃薯,也证实了GBSSI蛋白的功能。文成糯山药Wx基因的表达量降低,导致山药的直链淀粉含量减少[36]。
在其他物种中,关于GBSS基因也有相关报道。在离体百合鳞茎发育过程中,LohGBSSI基因在小鳞茎膨大初期(15 d时)表达量最高,在鳞茎和叶中的表达显著高于茎段和根,表明百合鳞茎直链淀粉合成的主要的部位是鳞茎和叶[37]。在豌豆胚胎发育过程中GBSSII的表达高峰在GBSSI前,GBSSII在植物的各个组织中都有表达,而GBSSI在根、托叶或花中不表达[38]。王前等[39]克隆了芡实GBSSI基因,编码528个氨基酸,为稳定的亲水性蛋白。
在一些水果中也鉴定到了GBSS基因,从苹果、桃子和橘子3种水果中分离并鉴定了3、2、2个GBSS基因,它们在叶、花、果实发育过程中均有表达,具有组织表达特异性[40]。从天宝蕉中克隆出了MaGBSSI[41],在巴西蕉中分离并鉴定了6个GBSS基因,且能通过影响香蕉果实发育和储藏过程中GBSS的水平变化、淀粉颗粒的数量和大小来调节直链淀粉代谢[42]。荸荠EdGBSS基因在球茎、匍匐茎、叶状茎和分株芽组织中均有表达,但在球茎中的表达量最高,在分株芽中表达量最低[43]。从莲藕美人红和z9中克隆出NnGBSS基因,发现随着莲藕根状茎的发育,其总淀粉与直链淀粉含量不断增加,且NnGBSS基因的表达量越高,直链淀粉的含量也越高[13]。
随着消费者对食品口感和营养保健功能需求的不断提高,糯性山药因其独特的口感和药用价值而成为市场的新宠,其中以产自浙南地区的糯米山药为代表。糯米山药为参薯(D.alata)的一个地方传统栽种品种,由于市场影响力不断扩大,得到了越来越多育种专家的关注。但是目前对糯米山药的研究仍处于起步阶段,在山药淀粉代谢及淀粉特性、山药糯性品质形成机制、通过分子手段对与山药生长发育相关差异表达基因的研究均鲜有报道,鲜见通过准确调控淀粉含量、组成等技术开展山药新品种选育,影响了山药产业的进一步发展。鉴于此,本研究采用分子克隆的方法对山药颗粒结合型淀粉合成酶基因DaGBSS进行克隆并进行相关的生物信息学分析,同时通过qRT-PCR对该基因在糯米山药不同部位的时空表达模式进行探究,相关酶活进行测定,以期在分子水平上,为研究糯米山药块根在直链淀粉合成相关酶的表达与调控、糯米山药块茎发育过程中直链淀粉和支链淀粉的生物合成与积累的研究提供参考。
1 材料与方法
1.1 植物材料及处理
糯米山药样本为浙江省文成县采挖15 d的山药根茎,将样本按照生长部位从上至下分为4个部分,去皮处理后放入液氮中速冻,之后冻存于-80 ℃冰箱备用。
1.2 RNA提取、反转录及cDNA的合成
采用CTAB法对获得的山药样品进行总RNA提取,具体操作步骤参考胡根海等[44]方法。分别采用0.8%的琼脂糖凝胶电泳和Nanovue微型光度计对获得的RNA提取质量和浓度进行检测。RNA反转录和cDNA合成采用兰博利德All-in-One First-Strand Synthesis MasterMix (with dsDNase),具体操作方法按照说明书进行。将反转录获得的山药cDNA稀释10倍后用于实时荧光定量RT-PCR和基因克隆。
1.3 DaGBSS基因的查找与克隆
以“granule-bound starch synthase”为关键词,对实验室前期获得的糯米山药转录组Unigenes进行查找,获得的GBSS基因cDNA序列,运用BioEdit软件对比筛选,去除序列相同的基因,进而通过BLASTX(https://blast.ncbi.nlm.nih.gov/Blast.cgi)筛选具有完整ORF的基因序列。以DaGBSS-F:ATGGCTGCTGTTACGGCTTCCCAT;DaGBSS-R:TCATGCAG-TGGCTGGTACTTTCT为引物,以糯米山药cDNA为模板进行DaGBSS基因的RT-PCR克隆,反应体系为:dNTP Mix(10 mmol/L)0.4 μL,10×LA Taq PCR buffer 2 μL,LA Taq(5 U/μL)0.3 μL,基因上下游引物各1 μL,模板2 μL,无菌水补充至20 μL;反应程序为:95 ℃预变性3 min, 95 ℃变性30 s, 61 ℃退火30 s,72 ℃延伸2 min 10 s,30个循环,72 ℃延伸10 min。将获得的RT-PCR反应产物进行电泳,取片段大小正确的基因片段使用胶回收试剂盒进行回收。之后将胶回收产物与T载体连接,进而将连接产物通过热激法转化到大肠杆菌感受态细胞TOP10中,并涂布于含有50 mg/L氨苄青霉素(Amp)的固体LB培养基中,37 ℃培养8 h。挑取单克隆菌落,用载体引物和基因引物分别进行PCR验证,选取条带大小正确的菌株进行测序分析。
1.4 DaGBSS基因的生物信息学分析
对DaGBSS基因序列利用ExPASy软件中的ProtParam程序(http://web.expasy.org/cgi-bin/protparam/protparam)推导其编码蛋白的相对分子质量及理论等电点;利用ProtComp 9.0 (http://www.softberry.com/berry.phtml?topic=protcomppl&group= programs&subgroup=proloc&example=example1)在线工具对DaGBSS蛋白进行亚细胞定位预测分析;利用InterProscan(http://www.ebi.ac.uk/interpro/search/sequence/)在线工具对山药DaGBSS蛋白所属的家族和存在的结构域进行预测。应用ExPASy的ProtScale程序(https://web.expasy.org/protscale/)计算山药DaGBSS蛋白的疏水性图谱。利用在线分析软件SignalP 4.1(https://services.healthtech.dtu.dk/service.php?SignalP-4.1)对DaGBSS蛋白的信号肽进行预测;根据ExPASy提供的软件TMHMM(https://services.healthtech.dtu.dk/ service.php?TMHMM-2.0)对DaGBSS蛋白的跨膜区和跨膜拓扑结构进行预测;运用ExPASy Proteomics tools中的SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/secpred_sopma.pl)软件预测DaGBSS蛋白的二级结构,使用Swissmodel软件(https://swissmodel.expasy.org/)预测DaGBSS蛋白的三维结构。
利用NCBI中的BLASTP程序对DaGBSS的氨基酸序列进行比对,搜索10种同源性较高的植物的GBSS氨基酸序列,包括圆形薯蓣亚种(Dioscoreacayenensissubsp.rotundata)、油棕(Elaeisguineensis)、檬果(Mangiferaindica)、龙舌兰(Agavetequilana)、海枣(Phoenixdactylifera)、尖头芭蕉亚种(Musaacuminatasubsp.malaccensis)、阿月浑子(Pistaciavera)、澳洲坚果(Macadamiaintegrifolia)、香蕉(MusaacuminataAAA Group)、karat香蕉(Musatroglodytarum)。利用Clustalx1.83软件进行多序列比对分析。此外,根据选取的10个物种的GBSS蛋白氨基酸序列,使用MEGA5.0软件进行系统进化树构建分析。
1.5 qRT-PCR分析
以糯米山药不同部位cDNA为模板,用糯米山药DaGBSS基因定量引物(表1)进行实时荧光定量PCR(qRT-PCR)分析。选择山药CKI-2基因作为内参基因[45]。qRT-PCR的反应体系为:SYBR 10 μL,正反向引物(10 μmol/L)各1 μL,cDNA 2.0 μL,ddH2O补充到20 μL。反应程序为:95 ℃ 10 min;95 ℃ 15 s,58 ℃ 15 s,72 ℃ 30 s,80 ℃ 1 s,读版,45个循环。使用QuantStudioTM6 and 7 Flex实时荧光定量PCR仪进行qRT-PCR实验。qRT-PCR数据采用2-ΔΔ(Ct)方法分析[46]。

表1 DaGBSS基因克隆和qRT-PCR引物序列
1.6 GBSS和直链淀粉含量测定分析
对山药样品采用酶联免疫分析中的双抗体夹心法进行GBSS含量测定,详细的实验方法为:用纯化的植物结合型淀粉合成酶(GBSS)捕获抗体包被微孔板,制成固相抗体,往包被的微孔中依次加入GBSS,再与HRP标记的检测抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样品中的GBSS呈正相关。用酶标仪在450 nm波长下测定吸光度(OD值),通过标准曲线计算样品中GBSS活性[47]。同时采用碘结合比色法对样品的直链淀粉含量进行测定[48]。
2 结果与分析
2.1 糯米山药DaGBSS基因的克隆
以糯米山药cDNA为模板,以DaGBSS-F和DaGBSS-R为上下游引物,通过RT-PCR扩增得到一条特异条带(图1b)。纯化回收后连接到pMD18-T克隆载体上,转化大肠杆菌感受态细胞DH5α,将菌液PCR检测得到的阳性克隆菌株进行测序,得到1条具有完整ORF的DaGBSS基因。
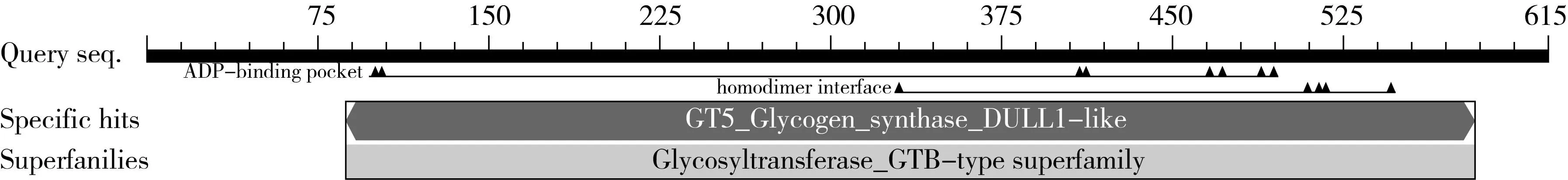
图2 DaGBSS蛋白的一级结构

图3 DaGBSS蛋白的疏水性、跨膜区和跨膜拓扑结构、信号肽预测

图5 山药DaGBSS蛋白质的三级结构预测
2.2 DaGBSS蛋白质的结构分析
通过测序分析,得到一个完整的山药DaGBSS基因ORF序列,长度为1 845 bp,编码614个氨基酸,通过BLASTp对DaGBSS氨基酸序列分析得到DaGBSS蛋白一级结构图(图 2)。ProtParam预测DaGBSS蛋白的分子质量为67.87 ku,理论等电点PI为6.27,为一酸性蛋白,其中含有72个带负电荷的氨基酸残基(Asp+Glu),67个带正电荷的氨基酸残基(Arg+Lys),N-末端含硫类的蛋氨酸M(MET)序列,在酵母和大肠杆菌中的半衰期分别大于20 h和10 h。DaGBSS蛋白的不稳定值数为(II)29.59,属于稳定蛋白。
利用ProtComp9.0在线工具对DaGBSS的亚细胞定位预测,结果显示,DaGBSS蛋白的定位在叶绿体的分值为8.57。利用InterProscan在线工具预测,结果表明DaGBSS蛋白属于植物糖原合酶(IPR011835),含有1个淀粉合酶催化结构域(IPR013534,90-348)和1个糖基转移酶1类结构域(IPR001296,404-532)。用ExPASy的ProtScale程序计算山药DaGBSS蛋白的疏水性,结果表明DaGBSS蛋白的疏水曲线在143、144、407、408、409位附近氨基酸疏水性较强,而在71、72、73、131、132位附近氨基酸亲水性较强,疏水性系数为-102.18,属于亲水性蛋白(图 3a)。利用ExPASy提供的在线跨膜区预测软件TMHMM对DaGBSS蛋白的跨膜区和跨膜拓扑结构进行预测,结果显示该蛋白没有跨膜区(图 3b),属于非跨膜蛋白。利用在线分析软件SignalP 4.1预测DaGBSS蛋白信号肽,结果显示无信号肽存在(图 3c)。
运用ExPASy Proteomics tools中的SOPMA软件对DaGBSS蛋白质二级结构进行预测,该蛋白质的二级结构中,α-螺旋和无规则卷曲占主要部分,分别占39.74%和40.55%,片层结构和β转角占14.50%和5.21%(图 4)。
进一步通过SWISS-MODEL对DaGBSS蛋白的三级结构进行预测,结果显示,共匹配到4个可能的模型图(图 5),分别为颗粒结合淀粉合酶1,糖原磷酸化酶,糖原(淀粉)合酶、麦芽糖糊精磷酸化酶,其得分依次为0.75、0.31、0.32、0.36,且颗粒结合淀粉合酶1的模型匹配度高达68.63%,说明DaGBSS蛋白的三级结构最有可能为模型A。
2.3 山药DaGBSS蛋白的序列相似性及进化分析
DaGBSS、10个不同物种的GBSS氨基酸序列比对结果显示,DaGBSS与所选物种的氨基酸序列之间具有较高的同源性(相似性为70.03%~95.28%),都含有典型的淀粉合酶催化结构域和糖基转移酶1类结构域。为进一步分析山药DaGBSS蛋白的进化关系,将选择的10个GBSS氨基酸序列与山药DaGBSS氨基酸序列一起,使用MEGA 5.0中的Neighbor-joining构建蛋白系统进化树。结果表明,DaGBSS蛋白与圆形薯蓣亚种(Dioscoreacayenensissubsp.rotundata)的物种进化亲缘关系更近(图6)。

图6 DaGBSS蛋白与其他物种GBSS蛋白的进化分析
2.4 山药DaGBSS基因的时空表达分析
为了初步分析DaGBSS基因的表达能力,利用实时定量qRT-PCR分析了在糯米山药块根不同组织部位(图7)DaGBSS基因的表达模式。结果显示(图8):与S1部位相比,DaGBSS基因在S2、S3、S4的表达量明显升高,分别是S1的9.13、7.73、11.44倍,尤其是在S4部位表达量达到最高值。进一步对4个部位的颗粒结合型淀粉合成酶(GBSS)、直链淀粉含量进行测定。结果显示,4个部位的GBSS含量均在2.5 U/g左右,其中与S1部位相比,S2和S3部位的含量稍低,而S4部位的GBSS含量最高,是S1的1.17倍;而直链淀粉在4个部位的含量与DaGBSS基因的表达趋势一致,在S1部位最低,在S4部位最高。综合三者结果,说明DaGBSS基因在山药根部的表达存在差异性,这些表达差异会引起山药根部不同位置颗粒结合型淀粉合成酶合成量的不同,从而导致不同部位直链淀粉含量差异。

图7 取样部分示意图

图8 DaGBSS基因在山药根部不同部位的表达分析
3 讨论
山药的块茎作为食用和药用的主要部分,其组成对其食用和药用的效果有重要影响,了解其营养成分的含量和作用,可以更好地使糯米山药的块茎在饮食和健康管理中发挥作用。淀粉是高等植物光合产物主要的储存形式,可分为直链淀粉和支链淀粉。淀粉也是山药地下块茎的重要组成成分,直链淀粉和支链淀粉的相对含量可以影响山药的口感、黏性、糊化性、回生性等特性[49]。在山药中有多种酶参与淀粉的合成,其中颗粒结合淀粉合成酶在直链淀粉的延长中扮演重要角色[50]。GBSS蛋白不能正常表达或活性下降是禾谷类作物糯性形成的根本原因。例如,糯稻中GBSSI基因碱基片段的突变或插入,会引起前体mRNA的不能正常剪切,从而导致GBSSI表达量减少[51];在糯玉米中,GBSSI基因缺失突变体Wx-D7和Wx-D10的GBSSI蛋白功能丧失[52,53];编码小麦GBSS蛋白表达的Wx基因发生突变会影响小麦的糯性[54]。在马铃薯中,4个经CRISPR/Cas9基因编辑的GBSS基因形成的突变体则完全缺失直链淀粉的合成能力[55]。
研究通过对山药转录组分析、同源克隆得到一个拥有完整开放阅读框的糯米山药颗粒结合型淀粉合成酶基因,cDNA片段长度为1 845 bp,编码614个氨基酸。生物信息学分析结果显示DaGBSS蛋白为酸性稳定蛋白,含有淀粉合酶催化和糖基转移酶2个功能结构域。氨基酸多序列比对结果显示:糯米山药DaGBSS蛋白与所选的物种具有较高的同源性,在70.03%以上,且含有典型的功能结构域。无根进化树分析结果显示DaGBSS蛋白与圆形薯蓣亚种的物种进化亲缘关系更近,说明该基因在同属内具有较强的保守性。通qRT-PCR对该基因在糯米山药块茎不同部位的表达分析结果表明:DaGBSS基因在山药块茎的表达存在明显的差异性,DaGBSS基因在S2、S3、S4的表达量分别是S1的9.13、7.73、11.44倍。进一步对相关指标测定结果表明,GBSS和直链淀粉在不同部位的含量存在差异性,且直链淀粉的含量变化趋势与DaGBSS基因的表达趋势一致,由此推测DaGBSS基因的组织表达差异性可能会引起山药块茎颗粒结合型淀粉合成酶合成的差异,从而导致山药块茎不同位置直链淀粉含量的差异,最终影响食用口感和效果。
通过对DaGBSS基因的结构和蛋白结构特点、在山药块茎不同部位的表达进行解析,为山药的分子育种提供重要的基因资源,同时为糯米山药块茎发育过程中直链淀粉和支链淀粉的生物合成与积累的研究提供参考。研究仅对DaGBSS基因的结构及相关表达进行了探究,关于DaGBSS基因的基本分子生物学功能、与如何在山药块茎的淀粉合成途径中发挥功能将在未来的研究中进行详细的探究。
4 结论
研究从山药中克隆得到1个颗粒结合型淀粉合成酶基因DaGBSS,ORF全长1 845 bp,编码614个氨基酸,为酸性稳定亲水性蛋白,含有典型的淀粉合酶催化结构域和糖基转移酶1类结构域,且与圆形薯蓣亚种的物种进化亲缘关系最近。通过对采收15 d山药块茎进行RNA提取、qRT-PCR分析,结果表明,DaGBSS基因的表达具有时空表达特异性,且在距离地表位置最远的部位DaGBSS基因的表达量、GBSS和直链淀粉的含量均为最高。研究通过对山药块茎淀粉合成的早期阶段进行分析,克隆出淀粉合成过程中的关键调控因子,为淀粉合成的调控、农作物品种改良和能源植物的培育提供参考。
