IRF8靶向铁死亡在急性肺损伤中的作用及机制研究
2024-05-08李忻炎李琳钰张晓晶折志刚
王 佳,李忻炎,李琳钰,张晓晶,杨 娟,折志刚
1.武汉大学人民医院心内科(武汉 430060)
2.武汉大学基础医学院(武汉 430071)
3.赣南医科大学赣南创新与转化医学研究院(江西赣州 341000)
急性肺损伤(acute lung injury,ALI)是由于直接或间接损伤因素导致肺部损伤的危重呼吸疾病,其发病机制复杂,死亡率居高不下。严重情况下进一步进展为急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),临床表现为呼吸困难和顽固性低氧血症[1]。ALI/ARDS 的发病机制核心涉及肺泡-毛细血管屏障的通透性改变,从而导致级联放大的炎症反应和肺泡上皮细胞的损伤[2]。虽然近年来对ALI/ARDS 发病机制以及治疗策略的研究取得了一些进展,但其确切的演变和具体信号通路调控尚不明确,且暂无针对特定靶点的治疗方法[3-5]。因此,研究ALI/ARDS 的病理生理机制,发现有效的调控因子、拟定有效的治疗策略显得尤为重要。
干扰素调节因子(interferon regulatory factors,IRFs)作为先天免疫系统的重要组成部分,在细胞增殖调控、分化、信号转导及免疫反应等方面发挥重要的调节作用[6-7]。其中,干扰素调节因子8(interferon regulatory factor 8,IRF8)作为一种免疫调节基因,在免疫系统中亦扮演着关键角色。早期研究表明,IRF8不仅参与树突状细胞、巨噬细胞、自然杀伤细胞和B 细胞等多种免疫细胞的发育和分化,还参与了肺部炎症的调节[8-9]。此外,既往研究发现IRF8作为肿瘤细胞铁死亡调节因子来调节肿瘤相关疾病的进展[10]。铁死亡是一种由于细胞内铁离子过载而引起的新型细胞死亡方式,与肿瘤的发展和治疗密切相关[11]。IRF8分子不仅在免疫系统调节中发挥着重要作用,还通过调节铁死亡相关信号通路,影响肿瘤细胞的生存和死亡,为进一步探索IRF8在其他疾病治疗中的潜在作用提供了新的方向和可能性。最近研究表明,铁死亡与ALI/ARDS 的发病机制密切相关,针对铁死亡的调控策略成为治疗ALI/ARDS 的新途径[12]。然而尚未有研究阐明IRF8在ALI/ARDS中扮演的角色,因此,本研究旨在探究IRF8在ALI/ARDS 中的生物学功能及其作用机制,有助于拓展其发病机制,并为ALI/ARDS 的治疗提供新的靶点和策略。
1 材料与方法
1.1 材料
1.1.1 实验动物和饲养
选用12 只雄性Irf8敲除品系(Irf8KO)小鼠与12 只雄性同窝阴性对照(WT)小鼠,小鼠年龄为8~10 周龄,体重约为23.5~27.5 g。实验所用C57BL/6J 小鼠均购自北京华阜康生物科技股份有限公司,生产许可证[SCXK(京)2019-0010],使用许可证[SYXK(鄂)2024-0013],其中Irf8敲除品系小鼠引种自Infrafrontier 公司。小鼠均饲养于武汉大学人民医院动物实验中心,其中SPF级小鼠饲料购自北京华阜康生物科技股份有限公司。小鼠饲养环境温度保持在22~24 ℃、湿度保持在40%~70%之间;明暗交替各12 h,自由摄食摄水。所有动物实验均是双盲进行。本研究已获得武汉大学人民医院动物伦理委员会审核批准[批号:WDRM 动(福)第20230508B 号]。
1.1.2 细胞
人肺泡上皮细胞A549购买于中国典藏中心。
1.1.3 主要试剂和仪器
脂多糖(lipopolysaccharide,LPS)购自碧云天生物技术有限公司;BCA 蛋白定量试剂盒购自赛默飞世尔科技公司;兔源一抗IRF8、谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)、BAX、BCL2及溶质载体家族7(solute carrier family 7 member 11,SCL7A11)抗体均购自于爱博泰客生物科技有限公司;BAD、p-BAD及GAPDH 抗体均购自于美国Cell Signaling Technology 公司;HRP 标记的羊抗兔二抗购自中山以诺生物科技有限公司;慢病毒载体、慢病毒包装质粒(pMD2.G 和psPAX2)和Cas9 表达载体均购自于Addgene 公司;DMEM 培养基购自美国Gibco 公司;电泳仪和ChemiDoc MP 成像系统购自美国Bio-Rad 公司;DAPI 购自深圳欣博盛生物科技有限公司;CD11b、CD68 一抗购自美国Boster 公司;Ly6G 一抗购自赛维尔科技有限公司;TRIzol 试剂和TUNEL 试剂盒均购自于江西惠康生物科技有限公司;反转录试剂盒和SYBR 试剂盒均购自于诺维赞公司。
1.2 实验方法
1.2.1 动物模型构建与分组
小鼠麻醉后,以仰卧位固定在操作台上,倾斜50°。造模组(ALI)小鼠采用10 mg·kg-1的LPS 以气管内滴注的方式进行造模,假手术组(Sham)小鼠气管内滴注等体积的0.9%氯化钠溶液,滴注期间小鼠体位保持直立以确保充分吸收LPS。滴注后等待24 h,小鼠ALI 模型构建完成。最后利用腹腔注射戊巴比妥钠(90 mg·kg-1)麻醉,收集小鼠肺泡灌洗液和肺脏组织。
本研究将小鼠随机分为4 组,分别为WT- ALI 组、Irf8KO-ALI 组、WT-Sham 组和Irf8KO-Sham 组,每组各6 只。其中,WT-ALI 组采用10 mg·kg-1的LPS 对同窝阴性对照(WT)小鼠进行气管内滴注,Irf8KO-ALI 组采用10 mg·kg-1的LPS 对Irf8敲除(Irf8KO)小鼠进行气管内滴注;WT-Sham 组采用等体积的0.9%氯化钠溶液对同窝阴性对照(WT)小鼠进行气管内滴注,Irf8KO-Sham 组采用等体积的0.9%氯化钠溶液对Irf8敲除(Irf8KO)小鼠进行气管内滴注。
1.2.2 细胞培养、模型构建与分组
将A549 细胞培养在含10%胎牛血清、1%青霉素和链霉素的DMEM 培养基中,37 ℃、5%CO2恒温培养箱培养。该细胞系使用前已鉴定并无支原体污染。ALI 细胞模型是利用20 µg·mL-1的LPS 刺激A549 细胞12 h 后建立,对照组则利用等体积的PBS 处理12 h 后建立。
细胞实验分组主要包括敲低IRF8和过表达IRF8两组。敲低IRF8实验分为shRNA-PBS 组、shIRF8-PBS 组、shRNA-LPS 组和shIRF8-LPS 组4 组,其中shRNA-PBS 组和shIRF8-PBS 组采用等体积PBS 分别处理shRNA 和shIRF8A549 细胞,shRNA-LPS 组和shIRF8-LPS 组采用20 µg·mL-1的LPS 分别处理shRNA 和shIRF8A549 细胞。过表达IRF8实验分为GFP-PBS组、IRF8OE-PBS组、GFP-LPS 组和IRF8OE-LPS 组4 组,其中GFPPBS 组和IRF8OE-PBS 组采用等体积PBS 分别处理GFP 和IRF8OE A549 细胞,GFP-LPS 组和IRF8OE-LPS 组采用20 µg·mL-1的LPS 分别处理GFP 和IRF8OE A549 细胞。
1.2.3 质粒构建和转染
从人源的cDNA 中扩增人源IRF8的全长编码序列,并连接到噬菌体载体中构建人IRF8的过表达质粒。通过将IRF8的shRNA 靶序列插入pLKO.1 慢病毒载体中构建人IRF8的敲低质粒。所有质粒均通过DNA 测序验证。本实验的转染方法是使用聚乙烯亚胺(polyethyleneimine,PEI)将质粒转染到A549 细胞中。IRF8OE-F:5’-GCAGAGCTCGTTTTAGTGA-3’;IRF8OE-R:5’-CTGGACCACCTCATCCCGT-3’;shIRF8-F:5’-CCGGACCGGTCCCAACTGGACA TTTCTCGAGAAATGTCCAGTTGGGACCGGTTTTT TG-3’;shIRF8-R:5’-AATTCAAAAAACCGG TCCCAACTGGACATTTCTCGAGAAATGTCCAGTT GGGACCGGT-3’。
1.2.4 细胞系构建
将构建好的目的基因质粒和慢病毒包装质粒(pMD2.G 和psPAX2)利用PEI 共同转染入HEK293T 细胞,转染后6~12 h 换液,等待48 h或72 h 后收集慢病毒。随后将包装成功的慢病毒感染A549 细胞,感染48~72 h 后,根据感染效率进行嘌呤霉素的筛选。筛选后的细胞进行不断扩增,利用蛋白免疫印迹(western blots,WB)进行检测是否构建成功,最终得到稳定表达的A549 细胞系。
1.2.5 RT-qPCR实验
提取小鼠肺组织或者A549 细胞中的RNA,利用反转录试剂盒反转为cDNA。加入SYBR Green PCR Master Mix进行聚合酶链式反应。其中所有基因mRNA的表达均以GAPDH为内参。人源IRF8上游引物5’-CGAGGTTACGCTGTGCTTTG-3’,下游引物为5’-CACCAGTCTGGAAGGAGCTG-3’;人源IL-1β上游引物5’-TTCGACACATGGGATAACGAGG-3’,下游引物为5’-TTTTTGCTGTGAGTCCCGGAG-3’;人源IL-6上游引物5’-GAGTAGTGAGGAAC AAGCCAGA-3’,下游引物为5’-AAGCTGCGC AGAATGAGATGA-3’;人源TNFα上游引物5’-TGGCGTGGAGCTGAGAGATA-3’,下游引物为5’-TGATGGCAGAGAGGAGGTTG-3’;人源CCL2上游引物 5’-AGCAGCAAGTGTCC CAAAGA-3’,下游引物为5’-TTGGGTTTGCTTGTCCAGGT-3’;人源CXCL2上游引物5’-CTTGCCAGCTCTCCTCCTC-3’,下游引物为5’- AGGGGCGCTCCTGCT-3’;人源CXCL3上游引物5’-CAAACCGAAGTCATAGCCACAC-3’,下游引物为5’-ACCCTGCAGGAAGTGTCAATG-3’;人源GAPDH上游引物5’-GGAGCGAGATC CCTCCAAAAT-3’,下游引物为5’-GGCTGTTGTC ATACTTCTCATGG-3’;鼠源Irf8上游引物5’-CTGCAGCAATTCTACGCCAC-3’,下游引物为5’-AAGGGTCTCTGGTGTGAGGT-3’; 鼠源Il-1β上游引物5’- CCGTGGACCTTCCAGG ATGA-3’,下游引物为5’- GGGAACGTCACACACC AGCA-3’; 鼠源Il-6上游引物5’-AGTTGCC TTCTTGGGACTGA-3’,下游引物为5’-TCCACG ATTTCCCAGAGAAC-3’;鼠源Tnfα上游引物5’-CATCTTCTCAAAATTCGAGTGACAA-3’,下游引物为5’- TGGGAGTAGACAAGGTACAACCC-3’;鼠源Ccl2上游引物5’- TAAAAACCTGGATCG GAACCAAA-3’,下游引物为5’-GCATTAGCT TCAGATTTACGGGT-3’;鼠源Cxcl2上游引物5’-CCAACCACCAGGCTACAGG-3’,下游引物为5’-GCGTCACACTCAAGCTCTG-3’;鼠源Cxcl3上游引物5’-TGAGACCATCCAGAGCTTGAC-3’,下游引物为5’-TTCATCATGGTGAGGGGCTTC-3’;鼠源Gapdh上游引物5’- AGGTCGGTGTGAACG GATTTG-3’,下游引物为5’-GGGGTCGTTG ATGGCAACA-3’。
1.2.6 蛋白免疫印迹检测蛋白表达水平
将取材得到的肺组织或者处理好的A549 细胞使用RIPA 裂解缓冲液提取其中的蛋白质。使用BCA 蛋白质测定试剂盒测定细胞或组织裂解物中的蛋白质浓度并制定蛋白样品。将蛋白样品在8%~12% SDS-PAGE 凝胶上分离并转移到PVDF 膜上。采用5%脱脂牛奶封闭1 h 后,分别使用一抗(BAX、BAD、p-BAD、BCL2、IRF8、SLC7A11、GPX4 和GAPDH)和二抗进行孵育。洗膜后,使用ChemiDoc MP 成像系统获取图像。以GAPDH 为内参。
1.2.7 免疫荧光
将载玻片上的切片与一抗在4 ℃下孵育过夜,然后与HRP 偶联的二抗孵育1 h,采用DAB 染色观察阳性细胞。通过评估至少4 个随机选择的高倍视野来量化每只小鼠肺组织中炎性细胞浸润程度,阳性率表示阳性染色细胞占总细胞计数的比例。使用Image-J2 进行图片处理和分析。
1.2.8 HE染色评价肺损伤情况
取固定后肺组织,石蜡包埋后连续切片,厚度为5 µm,进行HE 染色,光镜下观察肺组织组织病理学变化,利用Smith 评分方法对肺损伤程度进行评分和半定量分析。
1.2.9 末端脱氧核苷酸转移酶介导的dUTP缺口末端标记
进行末端脱氧核苷酸转移酶介导的dUTP 缺口末端标记(terminal deoxynucleotidyl transferasemediated dUTP-biotin nick end labeling,TUNEL),将取材获得的肺组织经过固定、包埋和切片,按照试剂盒说明书进行染色,通过选取多个高倍镜视野来定量。使用Image J2 进行图片处理和分析。
1.2.10 肺泡灌洗液检测
将经过生理盐水灌洗后的肺组织取材,称重得到湿重;放入烘箱72 h 后再次称重得到干重。用生理盐水反复灌洗肺组织3 次后得到的液体为肺泡灌洗液(bronchoalveolar lavage fluid,BALF),采用3000 r·min-1离心10 min后得到沉淀,利用血细胞计数仪测定BALF 总细胞计数,所得上清利用BCA 检测试剂盒测定BALF 中总的蛋白浓度。
1.3 统计学分析
使用SPSS 29.0 软件进行数据分析,本研究所有的数据均采用平均数与标准差(±SD)表示,两组比较采用独立样本t检验,多组比较采用单因素方差分析,P<0.05 表示差异具有统计学意义。
2 结果
2.1 体内外ALI模型中IRF8的表达情况
本实验分别在体内外ALI 模型中检测IRF8的蛋白和mRNA 表达情况。实验结果发现,与PBS 组相比,LPS 刺激后A549 细胞中IRF8的蛋白和mRNA 均表达上调,差异具有统计学意义(P<0.05)(图1-A、1-B);小鼠ALI 模型实验结果与体外实验结果基本一致(图1-C、1-D)。基于上述实验结果推测IRF8可能参与了ALI 的发生发展。
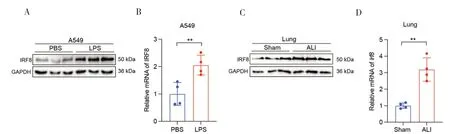
图1 体内外ALI模型中IRF8的表达情况Figure 1.The expression of IRF8 in both in vivo and in vitro model of ALI
2.2 体外敲低IRF8进一步加剧细胞内炎症和细胞凋亡
为了进一步探索IRF8在ALI 中扮演的具体角色,本研究在体外构建了稳定表达敲低IRF8的A549 细胞系,结果通过WB 检测得到了验证(图2-A)。进一步的RT-qPCR 结果发现,与shRNA-LPS 组相比较,shIRF8-LPS 组炎症相关因子mRNA 水平进一步增加(图2-B)。此外,在LPS 处理条件下敲低IRF8进一步促进了促凋亡相关基因(BAX、p-BAD)的表达,而抗凋亡相关基因(BCL2)则表达减少(图2-C)。上述实验结果共同证实在体外敲低IRF8可进一步加重肺泡II 上皮细胞内炎症和凋亡。
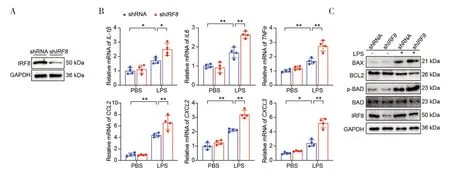
图2 体外敲低IRF8对细胞内炎症反应和凋亡的影响Figure 2.The effect of IRF8 knockdown on intracellular inflammatory response and apoptosis in vitro
2.3 体外过表达IRF8在肺泡II型上皮细胞中发挥保护作用
为了双重验证IRF8在ALI 中的生物学功能,本实验成功构建了稳定过表达IRF8的A549 细胞系,并通过WB 检测得到验证(图3-A)。实验结果发现,与GFP-LPS 组相比,IRF8OE-LPS 组炎症相关因子的转录水平明显下调(图3-B)。同时本研究检测了凋亡相关基因的蛋白水平表达,实验结果发现IRF8OE-LPS 组较GFP-LPS组促凋亡相关基因(BAX、p-PAD)表达下调,而抑凋亡相关基因(BCL2)表达上调(图3-C)。因此,体外过表达IRF8在肺泡II 型上皮细胞中发挥重要保护作用。
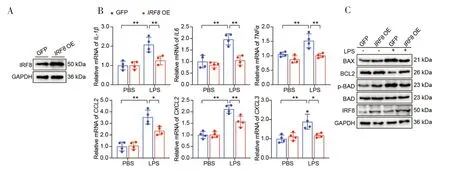
图3 体外过表达IRF8对细胞内炎症反应和凋亡的影响Figure 3.The effect of overexpression IRF8 on intracellular inflammatory response and apoptosis in vitro
2.4 敲除Irf8进一步加重小鼠肺组织损伤
本实验构建Irf8敲除品系小鼠,通过体内实验进一步验证该分子在ALI 中的生物学功能(图4-A)。与WT-ALI 组相比,Irf8KO-ALI 组小鼠BALF 总细胞数和上清中总蛋白质浓度均显著增加(图4-B、图4-C)。组织学分析结果发现Irf8KO-ALI 组小鼠肺损伤病理评分较WT-ALI 组增加,并且通过HE 染色代表图像发现Irf8KOALI 组小鼠肺组织炎症浸润程度和肺间质出血相较于WT-ALI 组明显加重(图4-D、图4-E)。此外,本研究对肺组织中的炎症细胞进行免疫荧光染色分析,结果发现Irf8KO-ALI 组CD11b+和Ly6G+细胞比率相较WT-ALI 组均显著增加(图 4-F、图4-G)。进一步的RT-qPCR 结果也发现,敲除Irf8将进一步加重小鼠肺组织中炎性细胞浸润程度(图4-H)。另一方面,TUNEL染色以及凋亡相关基因蛋白表达水平检测结果显示,Irf8的敲除进一步加重了小鼠肺组织内凋亡和损伤程度(图4-I、4-J)。上述实验结果均证实敲除Irf8可进一步引发组织内炎症反应级联放大和小鼠肺组织损伤。

图4 敲除Irf8对小鼠肺组织中炎症和凋亡情况的影响Figure 4.The impact of Irf8 knockout on inflammation and apoptosis in mice lung tissue
2.5 IRF8对铁死亡相关信号分子SLC7A11/GPX4的表达影响
为了探索IRF8是否通过铁死亡来调节ALI的疾病进程,本实验分别在体内外ALI 模型中检测了IRF8对铁死亡相关信号分子SLC7A11/GPX4蛋白表达水平的影响。实验结果发现,与WT 组相比,Irf8敲除小鼠肺组织中SLC7A11 和GPX4蛋白水平表达下调(图5-A)。同时在A549 细胞中发现敲低或过表达IRF8在LPS 刺激条件下与SLC7A11 和GPX4 蛋白表达水平变化一致(图 5-B、5-C)。实验结果验证了IRF8通过影响铁死亡相关信号分子SLC7A11/GPX4 的表达进而影响ALI 疾病进程,进一步拓展ALI 的发病机制并寻找有效治疗靶点。

图5 IRF8对铁死亡相关信号分子SLC7A11/GPX4的表达影响Figure 5.The impact of IRF8 on the expression of ferroptosis-related signaling molecules SLC7A11/GPX4
3 讨论
ALI/ARDS 由于发病机制复杂、死亡率高,已成为现代危重医学亟待解决的一大难题。肺部炎症反应级联放大和肺泡上皮细胞损伤是ALI/ ARDS 的重要病理生理特征,这些病理过程与氧化应激、细胞凋亡以及炎症反应等事件密切相关[13]。目前对于ALI/ARDS 患者以支持治疗(如机械通气、体外膜肺氧合等)为主,虽可以改善症状,但是患者长期预后差和死亡率高等问题依旧存在[14],因此寻找治疗ALI/ARDS 的关键调节分子迫在眉睫。
病原相关分子模式或损伤相关分子模式等直接或间接损伤因素可激活IRFs,并进一步参与自身免疫系统疾病的发展[15]。其中IRF8是一个表达受IFN-γ 调控的级联因子,在维持免疫细胞稳态和周转中起关键作用[16]。最近研究表明IRF8参与调节NLR 家族凋亡抑制蛋白的转录,进而促进核苷酸结合寡聚化结构域样受体蛋白4 炎症小体的形成,最终引发宿主对细菌和其他微生物病原体的防御反应[17]。IRF8在天然免疫过程中和其他病理状态下发挥重要调节作用[16,18]。在肺部疾病中,天然免疫可帮助机体对抗感染并维持肺部组织的稳态。既往研究表明IRF8在巨噬细胞的发育和功能中发挥重要调节作用,同时IRF8可通过调控炎症介质的表达或调节免疫细胞的活性来影响炎症反应的程度和持续时间[19]。但是在肺损伤中,IRF8扮演的角色尚不清楚。本研究专注于肺泡上皮细胞损伤的研究,实验结果显示IRF8不仅能显著改善肺组织的结构和功能,还可减轻肺泡上皮细胞内炎症和凋亡。这些实验结果共同证实IRF8在ALI 中的重要调节作用。
铁死亡是一种非凋亡性的死亡方式,通常伴有大量的铁积累和脂质过氧化。大量研究报道铁死亡发生的潜在机制主要与谷胱甘肽耗竭、GPX4失活、铁超载、脂质过氧化物和活性氧相关[20]。然而大量积累的活性氧和脂质过氧化物可进一步加重细胞内炎症因子级联释放和细胞凋亡,最终导致细胞免疫反应失调、细胞死亡和组织损伤。最近研究证实,铁死亡密切参与ALI/ARDS 的疾病发展[12]。因此,铁死亡可以作为ALI/ARDS 的治疗和干预靶标。
本研究发现,在ALI 体内外模型中IRF8蛋白水平和转录水平表达均明显上调,说明IRF8可能参与调控ALI 疾病进程。进一步在体内外实验中分别检测IRF8对炎症相关因子的表达水平以及细胞凋亡严重程度的影响,结果发现IRF8可抑制细胞内炎症反应和细胞凋亡,在ALI 中发挥保护作用。进一步的机制探索发现,IRF8可通过上调SLC7A11/GPX4 铁死亡相关信号分子表达而减少肺组织损伤。
本研究仍存在一定的局限性。实验仅在细胞系中探讨了IRF8在ALI 中的作用和机制,未在原代细胞中进行验证,还需更多的后续实验进行补充和完善。此外,IRF8在ALI/ARDS 中的机制研究还需深入探讨。
综上所述,本研究发现,IRF8作为一个关键调节因子,通过上调铁死亡相关信号分子SLC7A11 和GPX4 的表达,进而减轻肺损伤的进展。这一发现进一步拓展了对IRF8生物学功能以及ALI 发病机制的理解。
