生物电阻抗分析法与CT对肿瘤恶病质的预测价值
2024-05-08段若男
王 宇,段若男,宋 彬
山西医科大学第三医院/山西白求恩医院/山西医学科学院/同济山西医院肿瘤中心(太原 030032)
恶病质(cachexia)是一种以体重减轻伴肌肉和(或)脂肪含量消耗为特征的综合征,常伴发于多种慢性疾病[1]。其中,肿瘤恶病质(cancer cachexia)发病率最高,是各种恶性肿瘤的常见并发症,进展期恶性肿瘤约60%~80%可出现恶病质,约20%肿瘤患者因此死亡[2]。而恶病质的发生机制尚未完全阐明,亟需发掘客观的临床指标,寻找合适的诊断工具以指导肿瘤恶病质的相关诊疗。
生物电阻抗分析法(bioelectrical impedance analysis,BIA)是一种测量人体成分的非侵入性方法。国外多项研究证实BIA 可用于评估多种疾病包括肿瘤患者在内的人体成分、营养状况[3-5],但BIA 受多种因素干扰,如治疗方式和合并症、水合作用、运动情况等[6],故还需进一步的研究来评估BIA 生成的数据对治疗决策和整体癌症护理的潜在益处。计算机断层扫描(computed tomography,CT)是一种较为理想的恶病质评估工具,可通过测量皮下和内脏脂肪的体积以及腹部和椎旁肌肉的体积推断全身肌肉水平,通常限于第3 腰椎(the third lumbar vertebra,L3)水平的一个5~10 mm 厚的CT 切片[7],但目前因其费用昂贵和电离辐射,尚未用于临床上肿瘤恶病质的诊断和动态监测。据此,本研究使用CT L3 水平肌肉、脂肪相应参数,结合肿瘤患者的体成分指标,旨在发掘客观的临床指标指导肿瘤恶病质的早期发现和临床干预,探索BIA 与CT 对肿瘤恶病质的预测价值。
1 资料与方法
1.1 研究对象
选取2022 年8 月至2023 年9 月在山西白求恩医院肿瘤科住院的肿瘤患者为研究对象。纳入标准:①经组织病理学或细胞病理学确诊为肿瘤的患者;②年龄≥18 周岁;③意识清楚,患者及家属自愿参加本研究。排除标准:①体内装有心脏起搏器、固定钢钉等金属物品;② 合并大出血、脑卒中、心肌梗死等严重并发症;③合并慢性阻塞性肺疾病、慢性心衰、慢性肾衰、肝功能不全、艾滋病、风湿性关节炎等易引起恶病质的疾病;④合并甲状腺功能亢进、肾上腺皮质功能不全等代谢性疾病;⑤半年内各种术后体重减轻者;⑥其他原因无法配合本研究者。本研究已获得山西白求恩医院伦理委员会审核批准(批号:YXLL-2023-235),所有研究对象均知情同意。
1.2 研究方法
1.2.1 人体测量
采用韩国InBody 身高体重测量仪BSM370 于入院时测量肿瘤患者身高体重。测量时要求排尽大小便,保持空腹,脱去鞋帽和外衣,以立正姿势站于底板,双手自然下垂。测量仪通过感应器自动测量受试者身高体重,并将数据输出于BSM370 液晶输出屏,即可读数。测量精度为 ±0.1 cm,连续测2 次取平均值,计算得到体重指数(body mass index,BMI)。
1.2.2 人体成分分析
入院后48 h 内测量研究对象的人体成分,测量仪器采用韩国InBody770 人体成分分析仪,测量人员均经统一系统培训后操作。测量前要求受试者空腹、排尽大小便,不可携带金属物品,严禁体内装有心脏起搏器、固定钢钉等金属物品者受试。测试前采用医用卫生湿巾擦拭电极,所有阻抗测量均在受试者站立位时进行。受试者去掉鞋袜裸脚上台,上台后两足跟和掌跖前部分别站在指定电极,成自然直体站立,两手大拇指分别轻按电极按钮,其余四指全部握在手柄下方电极,手臂自然伸直。测量指标包括全身相位角(phase angle,PhA)、去脂体重(fat free mass,FFM)、基础代谢率(basal metabolic rate,BMR)、骨骼肌指数(skeletal muscle index, SMI)、内脏脂肪面积(visceral fat area,VFA)等。
1.2.3 CT图像处理及身体成分测量
使用MIM 计划系统V 7.1.2(北京明维视景医疗软件开发有限公司),对患者入院后1 个月内获得的腹部CT 图像进行分析。选取L3 椎体中点平面,不同组织的CT 值阈值范围如下:骨骼肌(-29~+150)HU,皮下脂肪与肌间脂肪组织(-190~-30)HU,内脏脂肪组织(-150~-50)HU。根据既定范围半自动化勾画骨骼肌(如图 1红色区域所示)、皮下脂肪组织(如图1 黄色区域所示)、肌间脂肪组织(如图1 绿色区域所示)与内脏脂肪组织(如图1 蓝色区域所示),系统自动计算各区域面积,并根据身高进行标准化,计算得到CT 骨骼肌指数(CT-skeletal muscle index,CT-SMI) 和CT 脂肪质量指数(CT-fat mass index,CT-FMI)。为保证数据和结果的准确性,所得图像均由2 名影像科主治医师及以上职称且具有至少3 年工作经验的医师进行审核与修改。
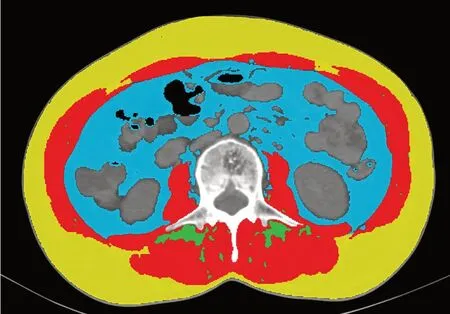
图1 L3椎体平面骨骼肌与脂肪示意图Figure 1.Example of a patient's L3 slice with measurements of skeletal muscle and fat areas
1.2.4 恶病质诊断
根据中国抗癌协会肿瘤营养专业委员会制订的《肿瘤恶液质临床诊断与治疗指南(2020 版)》[1],满足以下3 项诊断标准之一者纳入恶病质组,否则纳入非恶病质组:①无节食条件下,6 个月内体质量减轻>5%,同时伴有摄食减少;②BMI<18.5 kg·m-2和6 个月内任何程度的体质量减轻>2%,同时伴有摄食减少;③男性SMI <7.26 kg·m-2,女性SMI <5.45 kg·m-2和任何程度的体质量减轻>2%,同时伴有摄食减少。
1.3 统计学分析
利用SPSS 25.0 软件进行统计分析。符合正态分布的计量资料采用均数和标准差(±s)表示,两组间比较采用两独立样本t检验,不符合正态分布的数据采用中位数和四分位数表示[M(IQR)],两组间比较采用非参数检验中的Mann-Whitney U 检验;计数资料采用例数和百分比(n,%)表示,两组间比较采用χ2检验。单因素Logistic 回归分析评估影响恶病质发生的危险因素,结果采用比值比(OR)和95%可信区间(95%CI)表示。ROC 曲线用于确定相关指标的诊断界值,并评估其诊断恶病质的灵敏度及特异度。采用R 4.2.0 中的predictABEL 包计算综合判别改善指数(integrated discrimination improvement,IDI) 和净重新分类指数(net reclassification imporvement,NRI)。 诊断水准α=0.05,P<0.05 被认为差异具有统计学意义。
2 结果
2.1 一般资料
本研究纳入100 例肿瘤患者,男性和女性患者分别为59 例(59.0%)和41 例(41.0%)。其中,结直肠癌24 例(24.0%)、肺癌22 例(22.0%)、胃癌20 例(20.0%)、食管癌12 例(12.0%)、宫颈癌6 例(6.0%)、胰腺癌5 例(5.0%),其他类型恶性肿瘤11 例(11.0% ),包括乳腺癌3 例、胆管癌2 例、肝癌1 例、平滑肌肉瘤1 例、神经内分泌癌1 例、咽癌1 例、阴茎癌1 例、尿道癌1 例。根据第八版美国癌症联合委员会TNM 分期Ⅰ~Ⅱ期12 例(12.0%),Ⅲ期23 例(23.0%),Ⅳ期65 例(65.0%)。研究对象平均年龄(60.64±9.57)岁,SMI 为(6.33±0.97) kg·m-2,PhA 为(4.14±0.78)°,BMI 为(22.15±3.35) kg·m-2,其中正常体重59 例(59.0%)、低体重14 例(14.0%)、超重或肥胖27 例(27.0%)。根据相关诊断标准,恶病质患者53 例(53.0%),非恶病质患者47 例(47.0%)。
2.2 两组患者相关指标比较
恶病质组男性占比高于非恶病质组(71.7%vs.44.7%),恶病质组Ⅰ~Ⅱ期(18.9% vs.4.3%)、Ⅳ期(66.0% vs.63.8%)占比高,Ⅲ期占比低(15.1%vs.31.9%),恶病质组PhA、BMI、FFM、BMR、SMI、VFA、CT-SMI、CT-FMI 均低于非恶病质组,以上差异具有统计学意义(P<0.05),两组年龄差异无统计学意义(P>0.05),见表1。
表1 两组肿瘤患者相关指标比较(±s)Table 1.Comparison of basic information between two groups (±s)

表1 两组肿瘤患者相关指标比较(±s)Table 1.Comparison of basic information between two groups (±s)
注:★为计数资料,以例数和百分比(n,%)表示;PhA:全身相位角;BMI:体重指数;FFM:去脂体重;BMR:基础代谢率;SMI:骨骼肌指数;VFA:内脏脂肪面积;CT-SMI:CT骨骼肌指数;CT-FMI:CT脂肪质量指数。
特征恶病质组(n=53)非恶病质组(n=47)t/χ2值P值性别*7.5170.006男38(71.7)21(44.7)女15(28.3)26(55.3)平均年龄(岁) 61.79±10.13 59.31±8.83-1.2820.203肿瘤分期*7.5150.023Ⅰ~Ⅱ期10(18.9) 2(4.3)Ⅲ期 8(15.1)15(31.9)Ⅳ期35(66.0)30(63.8)PhA(°) 3.96±0.80 4.35±0.702.5530.012 BMI(kg·m-2) 20.81±2.97 23.66±3.114.673<0.001 FFM(kg) 40.40±6.83 43.36±7.132.1220.036 BMR(kcal)1 242.57±147.611 306.55±153.912.1210.036 SMI(kg·m-2) 6.05±0.91 6.64±0.943.2070.002 VFA(cm2) 76.91±33.18 95.40±40.462.5090.014 CT-SMI(cm2·m-2) 38.90±7.55 43.07±8.782.5500.012 CT-FMI(cm2·m-2) 54.14±36.64 80.57±45.543.2140.002
2.3 相关指标与恶病质的Logistic回归分析
将性别、年龄、肿瘤分期、PhA、BMI、FFM、BMR、SMI、VFA、CT-SMI、CT-FMI作 为自变量,将恶病质作为因变量,进行单因素Logistic 回归分析,结果显示男性和较低的PhA、BMI、FFM、BMR、SMI、VFA、CT-SMI、CT-FMI是肿瘤患者发生恶病质的相关危险因素,见表2。

表2 影响肿瘤患者发生恶病质的单因素分析Table 2.Univariate analysis of cachexia in cancer patients
2.4 恶病质相关危险因素的受试者工作特征曲线图
2.4.1 BIA与CT相关指标预测肿瘤恶病质的比较
比较BIA 与CT 的肌肉相关指标SMI 与CT- SMI,结果表明SMI 预测恶病质AUC=0.658[95%CI(0.551,0.765)],P=0.007;CT-SMI 预测恶病质AUC=0.623[95%CI(0.513,0.734)],P=0.034,如图2 所示。相较作为诊断标准之一的SMI,CT 得到的CT-SMI 同样可用于预测肿瘤恶病质。

图2 SMI与CT-SMI预测肿瘤恶病质的ROC曲线图Figure 2.ROC curves of SMI and CT-SMI predicting cancer cachexia
进一步计算BIA 所得SMI 的IDI 与NRI,发现SMI 预测恶病质的IDI 为0.031[95%CI(-0.011,0.073)],NRI 为-0.080[95%CI(-0.241,0.081)],反映BIA 对恶病质的诊断效能并未优于CT,但也不劣于CT。
比较BIA 与CT 的脂肪相关指标VFA 与CT-FMI,结果表明VFA 预测恶病质AUC=0.636[(95%CI(0.527,0.746)],P=0.019;CT-FMI 预测恶病质AUC=0.672[95%CI(0.565, 0.778)],P=0.003,表示依靠评估脂肪含量预测肿瘤恶病质发生,CT 与BIA 无明显差异,如图3 所示。
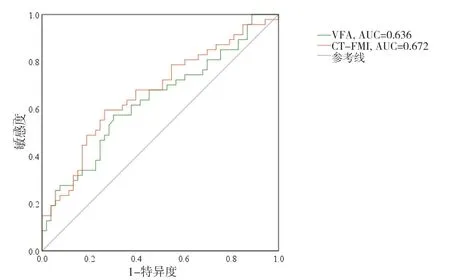
图3 VFA与CT-FMI预测肿瘤恶病质的ROC曲线图Figure 3.ROC curves of VFA and CT-FMI predicting cancer cachexia
2.4.2 BIA其余体成分指标预测肿瘤恶病质的比较
比较BIA 其余体成分指标BMI、PhA、FFM、BMR,结果表明BMI 预测恶病质AUC=0.748[95%CI(0.652,0.844)],P<0.001,当BMI 为20.47 kg·m-2时,约豋指数最大,此时BMI 预测肿瘤恶病质发生的灵敏度为0.915,特异度为0.528;PhA 预测恶病质AUC=0.648[95%CI(0.541,0.755)],P=0.011,当PhA 为3.65 °时,约豋指数最大,此时PhA 预测肿瘤恶病质发生的灵敏度为0.851,特异度为0.415;BMR 预测恶病质AUC=0.606[95%CI(0.495,0.717)],P=0.068;FFM预测恶病质AUC=0.607[95%CI(0.496,0.718)],P=0.066,如图4 所示。本研究中BMR 与FFM 尚不足以用于预测肿瘤患者恶病质,BMI 与PhA 有更好的诊断效能。
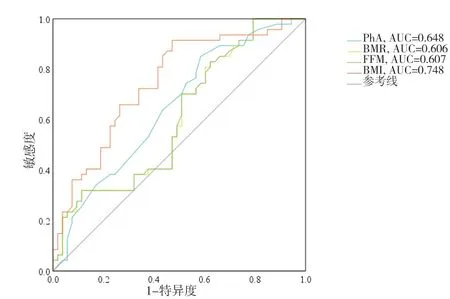
图4 BMI、PhA、FFM、BMR预测肿瘤恶病质的ROC曲线图Figure 4.ROC curves of BMI, PhA, FFM and BMR predicting cancer cachexia
3 讨论
肿瘤恶病质影响肿瘤的进展和预后,增加肿瘤患者的并发症、住院时间以及死亡率, 严重降低患者的生活质量,积极的营养干预被证明可有效降低肿瘤患者术后并发症的发生率[8-9]。因此,关注肿瘤患者的营养状况,早期发现恶病质并加以干预,对改善肿瘤患者的预后、提高生活质量具有重要意义。
目前有多种量表被推荐作为恶病质患者、厌食症患者的营养评估工具量表,其中营养风险筛查采用营养风险筛查2002(Nutritional Risk Screening 2002,NRS2002),营养评估采用主观整体评估法(Subjective Global Assessment,SGA),患者主观整体评估法(Patient-Generated Subjective Global Assessment,PG-SGA) 已被广泛应用于肿瘤患者的营养评估[10-12]。2021 年我国多位肿瘤和营养方向的学者基于PG-SGA 联合开发了改良的PG-SGA(mPG-SGA),并在34 071名肿瘤患者中得到验证,相比PG-SGA 和删减的PG-SGA 具有更好的生存预测有效性[13]。但评估工具量表的主观性强,且不适用于无自主意识的患者。作为恶病质最主要的特征,指南推荐应动态监测肿瘤患者的肌肉减少[1]。CT 和BIA 是指南推荐评估患者肌肉含量的两种有力工具,CT 可用于推测肿瘤恶病质患者的炎症情况[14],而全身炎症是肿瘤患者厌食和肌肉萎缩的关键驱动因素[15];BIA 作为一种简单、无创的检查手段,不仅可以用于评估人体不同部位的肌肉、脂肪含量,还可测量人体细胞外水比率、PhA 等,从侧面反映肿瘤患者的预后[16]。
本研究以肿瘤恶病质为结局变量,单因素Logistic 回归分析发现,男性和较低的PhA、BMI、FFM、BMR、SMI、VFA、CT-SMI、CTFMI 是肿瘤患者发生恶病质的危险因素。关于肿瘤患者恶病质的性别差异相关研究较少,与女性肿瘤患者相比,男性患者恶病质患病率似乎更高。Baracos 等通过分析441 名非小细胞癌患者的CT图像来评估身体成分,结果显示男性表现出肌肉减少症的比例远高于女性(61% vs.31%)[17]。但仍需大样本的研究数据证明。
本研究通过ROC 曲线分别比较了CT 和BIA用于评估肌肉和脂肪含量的效能,二者具有高度的相似性。目前,通过计算CT L3 水平肌肉面积进而判断不同类型肿瘤患者预后已被广泛应用于临床[18-20];而二者在评估脂肪含量方面的相似性,也使得通过全身脂肪水平预测肿瘤恶病质成为一种可能。
本研究还比较了BMI、PhA、FFM、BMR 4种指标对肿瘤恶病质的预测价值,BMR 与FFM尚不足以用于预测肿瘤患者恶病质,而BMI 与PhA 具有较好的预测价值,且BMI 用于诊断恶病质的临界值已写入指南。PhA 是衡量细胞响应身体成分测量电流的指标,可以反映细胞膜的完整性,PhA 越高,表示细胞膜完整性越好,细胞功能越好[21]。由于肿瘤和各种治疗方式会在肌肉和脂肪丢失之前损伤机体细胞,所以PhA 的减小也与肿瘤恶病质相关的营养不良有所联系,是预测恶病质发生和许多重症疾病进展的重要指标[22]。本研究结果显示,预测肿瘤恶病质的PhA 临界值是3.65°,低于多项癌症相关临床研究中计算的PhA 临界值。Shi 等在一项804 例肺癌患者的临床研究中,计算得出与总生存期相关的PhA 临界值为男性5.1°、女性4.1°[23]。Vegas- Aguilar 等报道了127 名结直肠癌患者肌肉减少症相关PhA 临界值,女性为4.85°,男性未得出有诊断意义的临界值[24]。Ji 等对455名患有非小细胞肺癌和消化道癌的老年男性患者进行研究,发现上述肿瘤合并肌少症相关的PhA 临界值为4.25°[25]。考虑到本次研究纳入的晚期肿瘤患者较多,并且多半合并肿瘤恶病质,故计算得出的PhA 临界值偏低。本研究属于单中心研究,样本量较小,混杂因素较多,使研究结果外推受限。未来应在确定瘤种的基础上,继续扩大样本量,进行多中心研究,进一步探讨CT 与BIA 对肿瘤患者的应用价值。
综上,BIA 与CT 均可用于预测肿瘤恶病质,二者评估肌肉与脂肪的水平相近。BIA 作为指南强烈推荐的诊断恶病质的手段,其多种指标可用于评估患者身体情况,判断预后。但BIA 评估水肿患者及携带金属物的患者会受到较大干扰,而CT 不受影响,恰好可以用于此类患者。且晚期肿瘤患者会经常完善CT 评估病情,使用CT 作为备用手段判断肿瘤恶病质的程度完全可应用于临床实践。
