大米免疫活性肽在小鼠体内的作用机制
2024-05-06文诗雨
文诗雨
张芷萌1
吴 昊1
谢雨菲1
黄庆明2
廖 娟2
文 李1
(1. 长沙理工大学食品与生物工程学院,湖南 长沙 410014;2. 湖南助农米业有限公司,湖南 益阳 413200)
生物活性肽可为机体提供基本营养,还具备多种有益于人体健康的生物学功能,因此可以通过调节和改善生理功能来抑制慢性疾病[1]。来自于食物蛋白的生物活性肽是一类经蛋白酶水解及分离纯化后、具有特殊生物活性的多肽,其氨基酸残基数目不等且相对分子质量一般较小,由2~20个氨基酸组成[2]。研究[3-4]表明,食物源生物活性肽具有显著高血压抑制、抗氧化、免疫调节、降血糖血脂、降人体总脂蛋白胆固醇、抗肿瘤、体外抗菌、识别体外免疫异常细胞、抗疲劳、改善提高人体骨代谢和神经活性调节能力等多种功能特性。
中国是水稻种植和消费大国,其中湖南省为水稻种植大省。精白米加工会产生大量副产物——米糠,其中仍含有丰富的营养物质,但在实践中的利用率极低。国内外对免疫活性肽的研究主要集中在大豆肽和一些动物源肽,而有关植物肽——大米源生物活性肽的报道较少。大米胰蛋白酶解物可从蛋白及mRNA水平抑制RAW264.7细胞的炎症因子表达,通过阻碍p65入核及ERK的磷酸化,分别影响巨噬细胞的NF-κB及MAPK炎症通路,从而实现抗炎作用显示出免疫活性[5-6]。有研究[7]表明,通过计算机预测、网络药理学方法可进行免疫活性成分的筛选。将先进的组学技术与生物信息学分析相结合,有望阐明肽在体内的新作用途径[8]。研究拟在前期以大米源免疫活性肽GBP1细胞试验研究[5]的基础上,深入探讨GBP1进入小鼠体内后对小鼠体重、血清中细胞因子(IL-2、TNF-α、IFN-γ)、脾细胞增殖数和脏器系数的影响,并对免疫器官胸腺和脾脏的病理切片进行分析;利用RNA-Seq在基因转录组水平上分析大米源免疫活性肽GBP1对小鼠机体基因表达水平的影响,以期为大米源免疫活性肽在临床上的应用提供理论及研究基础。
1 材料与方法
1.1 材料和试剂
1.1.1 材料
合成大米肽GBP1:肽序NSVFRALPVDVVANAYR,合肥赛曼诺生物科技有限公司;
免疫低下型SPF级雄性Balb/c小鼠:20只,体重18.6~22.2 g,湖南斯莱克景达实验动物有限公司。
1.1.2 试剂
0.9%氯化钠注射液:湖南康源制药有限公司;
胎牛血清(FBS):浙江天杭生物科技有限公司;
刀豆蛋白A(Con A):分析纯,德国默克公司;
噻唑蓝(MTT)细胞活力及毒性测试试剂盒:上海碧云天生物技术有限公司;
二甲亚砜:99.8%,北京兰杰柯科技有限公司;
白细胞介素-2(IL-2)、γ干扰素(IFN-γ)、α肿瘤坏死因子(TNF-α)、免疫球蛋白G(IgG)酶联免疫试剂盒:江苏酶免生物科技有限公司。
1.2 仪器与设备
电子天平:ME2002E/02型,梅特勒—托利多仪器有限公司;
生物显微镜:B203LED型,重庆奥特光学仪器有限公司;
石蜡切片机:RM2235型,德国Leica公司;
全自动脱水机:TP1020型,德国Leica公司;
摊片机:HI1210型,德国Leica公司;
组织包埋机:EG1150H+C型,德国Leica公司;
病理成像系统:DFC 420C型,德国Leica公司;
压力蒸汽灭菌器:BKQ-B75L型,山东博科生物产业有限公司;
生物安全柜:BSCIIB2-1101型,山东博科生物产业有限公司;
高速冷冻离心机:Centrifuge 5418R型,德国Eppendorf公司。
1.3 试验方法
1.3.1 试验设计 选取免疫低下型SPF级Balb/c小鼠20只,雌雄各半,体重18.6~22.2 g,根据性别、体重随机分为4组,分别为GBP1肽灌胃低、中、高剂量组(25,50,100 mg/kg)和对照组,每组5只,对照组灌胃纯水,给药量为20 mL/kg,每天给药1次,连续给药21 d。观察给药期间是否出现动物死亡,按式(1)计算各组死亡率。解剖取血、脾脏、肠系膜淋巴结、胸腺、肝脏、肾脏,称重相应脏器并按式(2)计算免疫器官指数。
(1)
(2)
式中:
D——死亡率,%;
C1——每组动物死亡数量,只;
C2——每组动物数量,只;
R1——免疫器官指数,mg/kg;
m1——器官质量,mg;
m2——体重,kg。
1.3.2 GBP1肽对小鼠脾细胞的增殖作用 采用MTT法检测脾细胞增殖。使用RPMI-1640磨碎脾组织,过200目细胞筛网。使用红细胞裂解缓冲液清除红细胞,离心,加入10% FBS至RPMI-1640中,重悬细胞浓度为1×107个/mL。将脾细胞(106个/孔)接种于96孔板上,每孔加入含ConA(12.5 μg/mL)或不含Con A(作为对照)的培养基培养72 h,每孔加入20 μL MTT(5 mg/mL)再培养4 h,弃培养液,每孔加入二甲亚砜,用分光光度计测定570 nm处吸光值,并按式(3)计算刺激增殖指数。
(3)
式中:
R2——脾细胞增殖指数,%;
A1——加入ConA培养后的吸光值;
A0——不含ConA培养后的吸光值。
1.3.3 GBP1肽对小鼠细胞因子释放及免疫球蛋白分泌情况的影响 末次给药24 h后取眼球采血,4 ℃、3 000 r/min离心10 min取血清,对血清样本进行细胞因子分析。在相同稀释液中制备细胞因子标准品的系列稀释液,将对照品、标准品和血清样品添加至ELISA试剂盒孔中,并根据ELISA试剂盒说明书测定IL-2、IFN-γ、TNF-α及免疫球蛋白IgG水平。
1.3.4 GBP1肽对小鼠组织病理的影响 末次给药2 h后,在深度麻醉下处死每个治疗组的一只小鼠。取小鼠的胸腺、脾脏组织,用4%福尔马林固定24 h,石蜡包埋,采用苏木精—伊红对组织切片进行染色,并使用生物显微镜观察。
1.3.5 转录组学分析 采用酚/氯仿法,分别从对照组和GBP1肽处理组小鼠的脾脏中提取RNA,在浓度与完整性检测前对提取的Total RNA按一定比例进行稀释。利用微量分光光度计检测RNA纯度,Agilent 2100 Bioanalyzer和Agilent RNA 6000 Nano Kit检测RNA浓度与完整性;基于UHPLC-MS/MS和联合测序平台,进行全面转录组分析;并委托武汉希望组生物科技有限公司进行测定。
1.3.6 差异表达基因功能富集分析
(1) GO富集:GO的基本单位是term(词条、节点),富集性分析首先需把所有差异表达基因映射到Gene Ontology数据库(http://www.geneontology.org/)的各个term上,筛选出与参考基因组相比样本差异表达基因中显著富集的GO条目。将阈值Qvalue≤0.05的GO term定义为在差异表达基因中显著富集的GO term,通过GO功能的显著富集分析确定差异表达基因所执行的主要生物学功能。
(2) KEGG富集:通过KEGG数据库可以在基因水平上对生物学上的复杂行为进行深入研究,经多重校验后,筛选出满足Qvalue≤0.05条件的Pathway即为在差异表达转录本中显著富集的Pathway。
(3) 数据处理与统计分析:使用SPSS 22.0软件进行差异显著性分析和相关性分析,其中*表示有统计学意义(P≤0.05),**表示非常显著性意义(P≤0.01),结果以平均值±标准偏差表示。采用IBM SPSS Statistics 22、Origin 9.0、Cytoscape软件进行数据分析及绘图。
2 结果与讨论
2.1 GBP1肽对小鼠的影响
2.1.1 对小鼠机体的影响 体重变化是反映机体健康状态的一个重要指标,通常免疫力低下都会伴随着体重下降[9]。由图1(a)可知,肽处理前,各组小鼠体重随时间延长不断增加。经灌胃递送GBP1肽后,各组小鼠相对体重均上涨。灌胃第7天,肽处理组小鼠体重显著上升,对小鼠机体有良性影响,因此GBP1肽处理组符合对照组体重增长趋势,尤其是50 mg/kg肽处理组的体重值出现极显著增加。
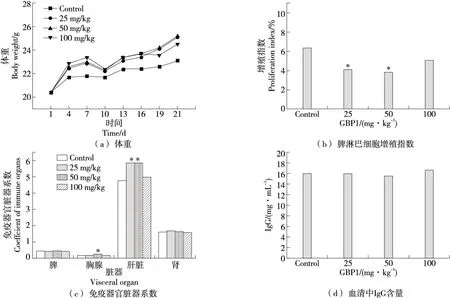
图1 GBP1肽对小鼠机体的影响
体外培养T细胞时,受到植物血凝素或特异性抗原刺激后,可出现细胞体积增大,代谢旺盛,蛋白和核酸合成增加并能进行分裂,成为淋巴母细胞,因此淋巴细胞增殖率的高低可以反映机体细胞免疫水平,可作为测定机体免疫功能的指标之一,正常脾淋巴细胞增殖区间为3%~5%[10]。由图1(b)可知,经25,50 mg/kg的GBP1肽处理后,小鼠脾细胞增殖数趋于正常值水平。
免疫器官脏器系数的变化能直接反映机体免疫功能的改变[11],其中脾脏和胸腺是机体内重要的免疫器官,其脏器系数的变化能够有效反映机体免疫状态。由图1(c)可知,与对照组比较,25 mg/kg的GBP1肽处理组小鼠胸腺脏器系数和25,50 mg/kg的GBP1肽处理组的肝脏器系数显著升高,说明GBP1肽未对脾脏、肾脏组织产生不良影响。
由图1(d)可知,经肽处理后,小鼠血清中IgG含量稳定,无统计学差异;说明肽处理后机体的体液免疫功能状态良好,未产生不良影响。
2.1.2 对血清中细胞因子表达量的影响 由图2可知,25 mg/kg的GBP1肽处理对小鼠机体产生的促炎因子IL-2、IFN-γ和TNF-α均有抑制作用;50 mg/kg的GBP1肽处理组中小鼠机体产生的促炎因子IL-2、IFN-γ和TNF-α有上升趋势,说明低浓度肽对促炎因子分泌具有良好的抑制作用。
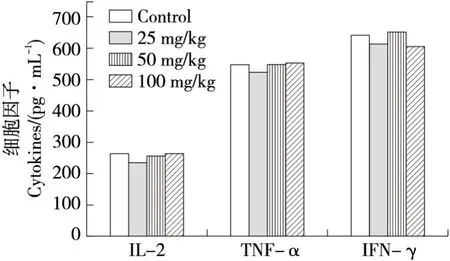
图2 GBP1肽对小鼠细胞因子分泌的影响
2.1.3 对小鼠胸腺和脾脏组织的影响 小鼠的脾脏、胸腺代表适应性免疫器官,在其中维持了免疫稳态的平衡[12]。由图3可知,与对照组相比,GBP1肽处理组小鼠的脾脏和胸腺组织切片显示正常结构,形态清晰,无组织学改变,表明GBP1肽可以提高正常小鼠的免疫力,不会对脾脏、胸腺形态造成损害,且未对胸腺、脾脏组织产生病理影响。
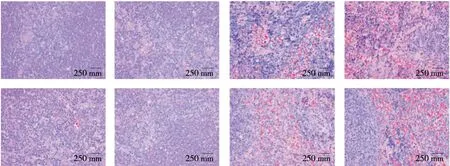
从上至下依次为胸腺、脾脏切片;从左至右依次为对照组、25,50,100 mg/kg GBP1肽处理组
综上,经25 mg/kg的GBP1肽处理后,可以显著影响小鼠的脏器指数变化、脾脏细胞增殖及炎症因子的分泌,且对脏器无损害。因此,进一步对25 mg/kg的GBP1肽处理的小鼠脾脏组织进行转录组分析。
2.2 小鼠脾脏组织转录组测序分析
2.2.1 过滤后的Reads质量统计 由表1可知,经过滤和比对后,共获得299 632 082 Raw Reads,293 293 182 Clean Reads。Clean Reads达到了Raw Reads的98%,比对到基因组上的比例均>97%。二代测序要求Q20的碱基比例>95%,Q30的碱基比例>85%;该测序中6个样品的Q20值均>97%以上,Q30值均>92%,表明每个样品的碱基正确识别率均>90%。
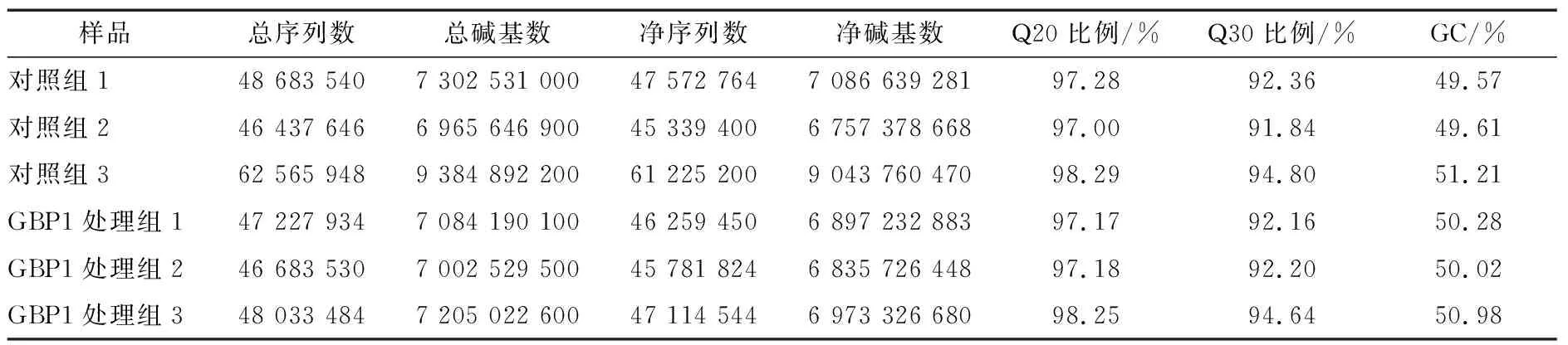
表1 过滤后的 Reads 质量统计
2.2.2 基因表达水平分析 Reads计数除了与基因的真实表达水平成正比外,还与基因的长度和测序深度呈正相关[13]。每百万映射读片段的每千碱基读数(FPKM)值可以反映出一个基因在RNA样本中的相对表达水平大小,FPKM在0.10~3.75 可以认为是低丰度表达水平的基因;FPKM 在3.75~15.00为中等丰富度表达水平基因;FPKM>15为高丰富度表达水平基因。利用StringTie[14]软件对所有基因表达量进行统计,结果见表2。
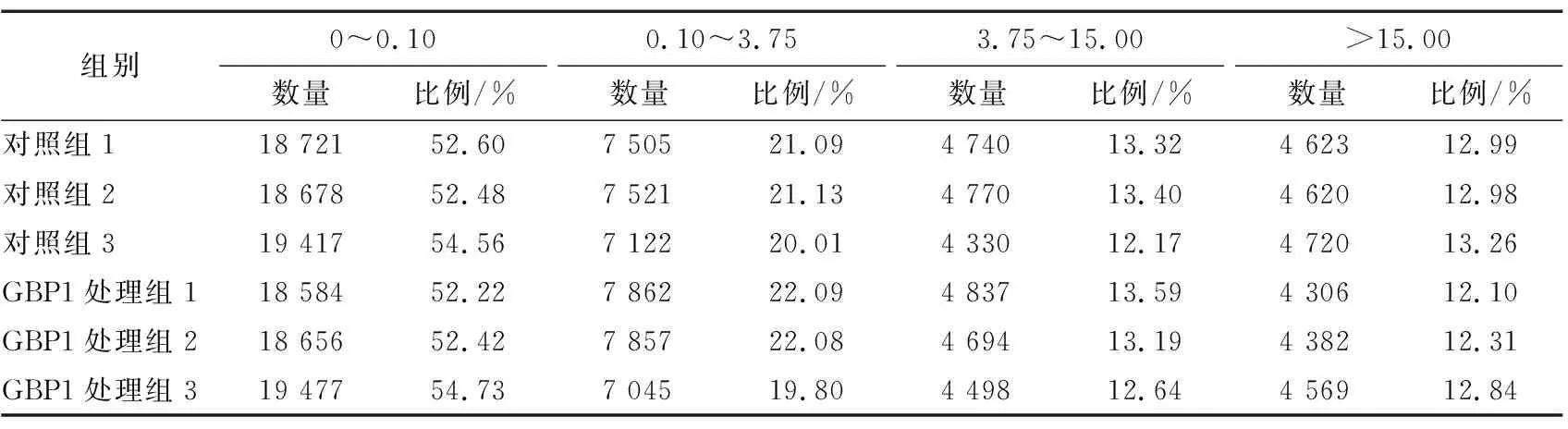
表2 表达量统计表
依据各样品的基因表达量绘制主成分分析图,样本的表达分布及相关性分析结果如图4所示。由图4可知,对照组与GBP1处理组分开,各样本转录组间差异较大,说明GBP1处理改变了脾脏组织的基因表达丰度。
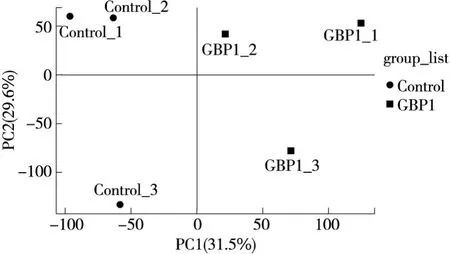
图4 主成分分析图
2.2.3 差异表达基因分析 有生物学重复的差异表达基因定义为FoldChange≥2且fdr≤0.05,无生物学重复的差异表达基因定义为FoldChange≥2且fdr≤0.005。由此可得差异基因共780个,其中显著上调的差异基因741个,显著下调的差异基因39个。通过两组转录本对比,对基因表达进行层次聚类分析,结果如图5所示。由图5可知,经GBP1肽处理后的小鼠脾脏组织中上调基因数高于下调基因数。通过两组样本中差异表达基因分析,GBP1肽可明显促进小鼠脾脏组织中基因的转录水平。

图5 差异基因分析图
2.3 GO和KEGG富集分析
GO富集包括生物过程(BP)、细胞组分(CC)和分子功能(MF)3部分。由图6可知,GO分析共富集了219个条目,其中70个与生物过程相关,24个与细胞成分相关,125个与分子功能相关。根据P值<0.01,选取生物过程、细胞成分、分子功能富集结果排名靠前的条目进行可视化处理。GBP1处理脾脏组织的差异基因主要参与微管运动和跨膜转运等生物过程,存在于血红蛋白的复合物和质膜等细胞成分,行使微管结合、调节丝氨酸型内肽酶活性和微管运动等分子功能。

a.. 氧气运输 a2. 基于微管的运动 a3. 跨膜转运 a4. DNA复制 a5. DNA修复 a6. 脂蛋白代谢过程 a7. 趋化性 b1. 血红蛋白复合物 b2. 转录调节因子复合物 b3. 微管 b4. 质膜的组成部分 c1. 氧结合 c2. 微管结合 c3. 微管运动活动 c4. 蛋白质同源二聚化活性 c5. 细胞骨架的结构成分 c6. 丝氨酸型内肽酶活性 BP. 生物过程 CC. 细胞组分 MF. 分子功能
KEGG分析共富集了217个信号通路。根据P值<0.01,选取前16条通路进行可视化处理,主要涉及细胞周期、铁死亡、ECM-受体相互作用、p53信号通路、次生代谢物的生物合成等途径。这些通路均与免疫、癌症、细胞凋亡等息息相关。其中p53信号通路是一个重要的细胞生存和死亡调控通路,p53是所有癌症中最常见的突变蛋白。研究[15]认为,活性p53在肿瘤抑制方面具有重要作用。p53信号通路中所富集到的10个基因均上调,其中表达量最高的基因为Rrm2,该基因编码核糖核苷酸还原酶,参与核苷酸代谢并催化核苷酸转化为脱氧核苷酸,且该基因与耐药性、调节细胞死亡和肿瘤免疫有关[16];另一个表达量较高的基因为细胞周期蛋白B2(Ccnb2),该基因是细胞周期蛋白通路的重要组成部分,在癌症的发生发展中起关键作用[17];铁死亡通路是一种细胞死亡形式,具有直接杀死癌细胞的能力,并具有潜在的抗肿瘤作用,随着免疫细胞在肿瘤微环境(TME)中的作用不断增强,铁死亡可能对免疫细胞产生额外的影响[18]。铁死亡信号通路中所富集到的8个基因均上调,其中表达量最高的基因为Tfrc,该基因编码转铁蛋白受体,该受体表达广泛分布于免疫系统、造血系统(如骨髓干细胞、红细胞和白细胞)、神经系统(如神经元和神经胶质细胞)等[19]。补体和凝血级联是由具有相似结构特征的丝氨酸蛋白酶组成的共同祖先途径衍生的两个进化级联反应,具有综合和高度复杂的功能,它们将彼此交织在机体的全过程中,从而达到机体的止血作用和免疫防御作用[20]。补血和凝体级联通路中所富集到的11个基因均上调,其中表达量最高的为Itgam,该基因编码整合素αM链,整合素 ITGAM/ITGB2 与单核细胞、巨噬细胞和粒细胞的各种黏附相互作用以及介导补体包被颗粒和病原体的摄取有关[21]。
2.4 GBP1肽对脾脏组织转录组信号通路及差异基因表达分析
选择KEGG富集分析中免疫调节相关通路前8条进行分析。由表3可知,细胞周期通路相关的差异基因为20个,与铁死亡通路相关的差异基因为8个,ECM-受体相互作用通路相关的差异基因为11个,次生代谢物的生物合成通路相关的差异基因为32个,p53信号通路相关的差异基因为10个,补体和凝血级联反应通路相关的差异基因为11个,谷胱甘肽代谢通路相关的差异基因为9个,细胞衰老通路相关的差异基因为15个。
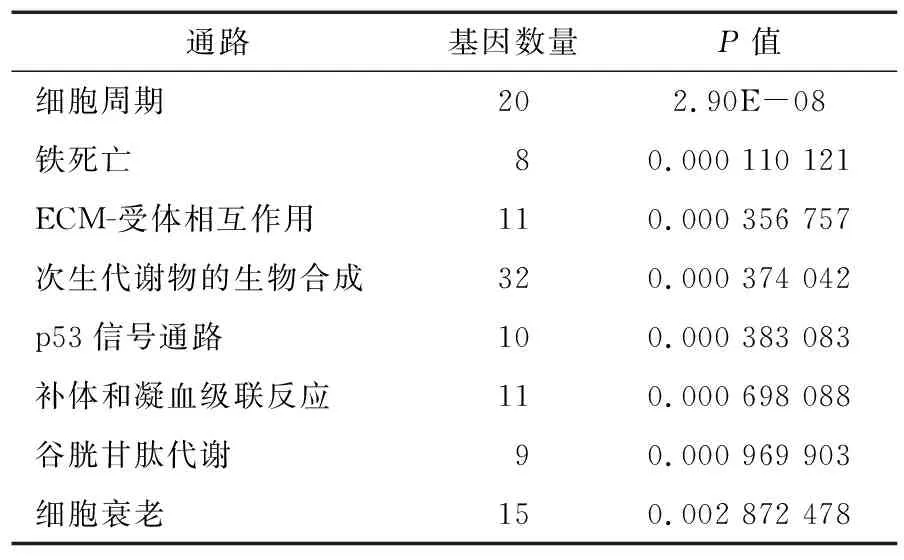
表3 差异基因与免疫调节相关的KEGG途径
结合GO和KEGG富集结果,与免疫调节密切相关的有铁死亡通路、p53信号通路、补体和凝血级联反应3条通路,包含相关的差异基因有28个(表4),且均为上调基因。

表4 脾脏组织的差异基因及差异表达水平分析
2.5 差异基因互作网络分析
利用String网站分析得到总的差异基因的互作网络,如图7所示。为明确与免疫调节相关通路的关键基因,选择KEGG富集分析中免疫调节相关通路前8条及其相关基因导入Cytoscape软件,分析得到关键基因互作网络图。

图7 免疫相关关键基因互作网络图
通过比较介数中心度(betweenness centrality),筛选出与免疫调节相关的基因包括Rrm2、Thbs1、Tfrc、Itgam、Ccnb1、Cdk1等。Thbs1基因编码血小板凝血酶蛋白-1,其是近年来肿瘤领域研究的热门靶点基因[22];Ccnb1基因编码细胞周期蛋白B1,该基因编码周期蛋白依赖性激酶1,且Ccnb1、Cdk1和Ccnb2与肝癌细胞的免疫浸润相关[21]。这些关键基因,均与肿瘤、癌症、炎症等免疫调节有关。
3 结论
研究考察了大米源免疫活性肽GBP1肽小鼠机体发挥的免疫调节作用,并从转录组水平分析了免疫活性肽对小鼠发挥免疫调节作用的机制。结果表明,大米源免疫活性肽GBP1肽处理后的小鼠体重整体呈上升趋势,25 mg/kg的GBP1肽处理组小鼠肝脏器系数升高,50 mg/kg的GBP1肽处理组小鼠胸腺、肝脏器系数升高,低浓度肽组对促炎因子分泌具有良好的抑制作用,肽处理组脾淋巴细胞体外增殖能力无明显变化,免疫球蛋白IgG水平无统计学差异。经GO功能富集和KEGG通路富集,发现GBP1肽与p53信号通路、铁死亡、补体和凝血级联等免疫调节通路相关;通过分析免疫相关通路的基因表达量以及构建关键基因互作网络,预测与肿瘤、癌症、免疫调节等相关的关键基因包括Rrm2、Ccnb2、Thbs1、Tfrc、Itgam、Ccnb1和Cdk1等。研究主要考察了免疫活性肽GBP1肽小鼠机体发挥免疫调节作用,从转录组水平出发分析了免疫活性肽对在小鼠发挥免疫调节作用的机制,这为未来更进一步研究GBP1肽的免疫活性及作用机制提供了相关的研究路线。后续可对GBP1肽进行人群试验以探讨其在人体内的作用机制。
