不同负荷梯度对污水厂活性污泥的产酸性能分析
2024-05-06王柯丹王保生蔺洪永李海松
王柯丹,王保生,蔺洪永,谢 佳,黄 龙,*,李海松,*
(1.知和环保科技有限公司,河南郑州 450001;2.郑州大学生态与环境学院,河南郑州 450001;3.中原环保股份有限公司,河南郑州 450006)
城镇污水处理厂普遍采用活性污泥法进行污水处理,剩余污泥(以下简称“污泥”)是活性污泥法的主要副产物之一。 2021 年我国生态环境统计年报数据显示,污泥产量为4 592.1 万t[1]。 污泥的处理与处置费用较高,一定程度上增加了污水处理厂的运营成本。 污泥的资源化利用是当前的热点,相关研究聚焦于污泥中大量可利用有机物如蛋白质、多糖、纤维素、腐殖质等的高效回收[2-3]。
污泥通过厌氧发酵产酸技术能够实现污泥碳源与能源回收,被认为是助力“碳中和”的重要技术途径之一[4-6]。 在污泥发酵产酸过程中,较多研究采取物理、化学(添加CaO2、NaSO3、NaNO2等化学试剂)、电解、加热等方法加强污泥的分解,提高污泥的水解产酸性能[7-11]。 碱性发酵产酸已被证明是污泥厌氧发酵积累挥发性脂肪酸(VFAs)的有效方法之一[12-13],然而长周期的碱性发酵实践并不多见。在碱性环境中,蛋白质水解酸化释放大量的氨氮会转化为高浓度游离氨(FA)。 FA 是限制污泥碱性发酵累积小分子VFAs 的主要因素。 因此,在污泥长周期碱性发酵过程中弱化FA 影响,提高污泥产酸率仍需探讨。 有机负荷是污泥碱性发酵累积VFAs的关键工艺因子,调控负荷是在碱性发酵系统中获得稳定产酸效能的技术路线,但如何选择合适的负荷梯度以逼近最佳且稳定的产酸效能是该系统实际运行中需要解决的问题。 Xing 等[14]在研究餐厨垃圾与剩余污泥共消化中,发现在低梯度提负荷有助于试验的长期(600 d)稳定运行。 此外,缩短污泥发酵时间或提高污泥有机负荷可以快速获得高浓度VFAs。 然而高梯度提负荷面临着系统运行不稳定、周期长等缺点。 因此,本研究的目的是通过控制提负荷的梯度实现污泥长期碱性发酵产酸,获得较高的污泥产酸率。
本研究在污水处理厂现场开展,构建了全程pH可控的半连续碱性发酵系统,通过负荷梯度的调控进行污泥产酸性能长周期研究。 以先低梯度再高梯度提升有机负荷,使碱性发酵系统产生VFAs 效能趋于最优,并实现污泥产酸系统的稳定运行,探究负荷梯度的改变对污泥产酸效能、VFAs 的组成及菌群的影响。 此外,还研究了负荷提升过程中非VFAs产物如氮、磷、多糖、蛋白质的释放情况以及代谢基因的丰度变化。
1 材料与方法
1.1 污泥来源与试验条件
本试验在郑州市五龙口污水处理厂现场开展,污泥取自于氧化沟工艺后端的二沉池回流污泥。 污泥在4 ℃下进行沉淀浓缩24 h,浓缩后的污泥在有效容积为4.0 L 的反应器中进行发酵产酸反应。 试验过程中进行在线控制,温度为(35±1) ℃,搅拌速度为(120±10) r/min,分别采用氢氧化钠和盐酸调节pH,使pH 值维持在10.0±0.05。 污泥的性质如表1 所示。

表1 浓缩污泥的基本性质Tab.1 Basic Properties of Thickened Sludge
1.2 试验方法
试验分为3 个阶段:阶段Ⅰ为低梯度提升有机负荷,其目的是增强污泥发酵体系中微生物的反应能力,以及体系运行的稳定性;阶段Ⅱ为高梯度提升有机负荷,其目的是增加体系的生物量并富集水解酸化菌,实现VFAs 的大量积累;阶段Ⅲ为最佳负荷的稳定运行阶段。 如图1 所示,该试验运行238 d,阶段Ⅰ共运行56 d(8 周),每周补料3 次,负荷从186 mg TSS/(L·d)提高至271 mg TSS/(L·d),第6周因反应器运行问题使得本周运行负荷降低。 阶段Ⅱ共运行77 d(11 周),每周补料7 次,负荷从625 mg TSS/(L·d)提高至3 750 mg TSS/(L·d)。 阶段Ⅲ以最佳负荷[3 250 mg TSS/(L·d)]进行稳定运行,运行时间共49 d(7 周)。
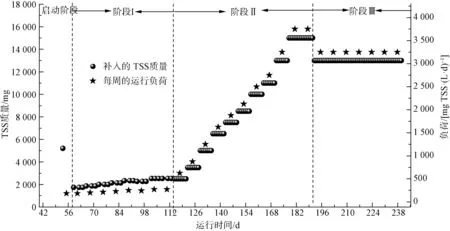
图1 污泥碱性发酵的运行负荷Fig.1 Alkaline Fermentation of Sludge under Different Load Dradiends
1.3 分析方法
TSS、VSS、氨氮、磷酸盐分别采用重量法、重量法、纳氏试剂光度法与钼锑抗分光光度法进行测定,TCODCr和SCODCr采用COD 快速检测仪[连华科技,5B-6C(V12)]通过重铬酸钾法进行检测。 VFAs采用气相色谱法进行检测(Agilent GC7890B),具体参数:用FID 检测器;色谱柱为HP-5MS 弹性适应毛细管柱,柱长为30 m,膜厚为0.25 μm,内径为320 μm;进样口条件设置为温度250 ℃,分流比为10 ∶1;检测器条件为温度300 ℃,流量为40 mL/min,气源是H2;升温程序为在70 ℃下维持3 min,以30 ℃/min 升至170 ℃[15]。
此外,分别计算了污泥产酸过程中污泥分解率[6]、水解率和酸化率[2],以及VFAs 的各组分占比和FA[16],计算如式(1)~式(5)。
其中:CVSS(in)和CVSS(out)——浓缩污泥和发酵污泥的质量浓度,mg/L;
η1——污泥分解率;
CSCODCr——溶 解 性 CODCr质 量 浓 度,mg/L;
CTCODCr——总CODCr质量浓度,mg/L;
η2——水解率;
CVFAs——总VFAs 质量浓度,以CODCr计,mg CODCr/L;
η3——酸化率;
Ci——VFAs 组分如乙酸、丙酸、正丁酸、异丁酸、正戊酸和异戊酸,以CODCr计的质量浓度,mg CODCr/L,转换因子分别是1.07、1.51、1.82、1.82、2.04 和2.04;
η4——VFAs 组分占比;
CFA——发酵液中的FA 质量浓度,mg/L;
CN——发酵液中氨氮质量浓度,mg/L;
A——反应pH;
T——反应温度,℃。
此外,还分别对污泥细菌和古菌的V3 ~V4 区进行扩增分析,其引物分别是341F、805R 和340F、1000R,利用Illumina MiSeq PE300 平台进行测序分析。 微生物群落结构分析依照扩增子数据分析指南[17]。 基于RDP 训练集v16 对特征序列(OTUs)进行分类学并注释。 在R 语言环境下使用vegan v2.5-6 包分析多样性。 此外,基于京都基因与基因组百 科 全 书 (Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库对活性污泥中的微生物进行功能预测分析。
2 结果与讨论
2.1 负荷梯度变化过程中的污泥产酸性能
污泥絮体在碱性发酵产酸过程中先将有机物释放到液相中,然后水解菌将大分子有机物转化为小分子有机物,随后通过酸化菌的代谢转化为VFAs。以污泥浓度的变化阐述污泥的分解情况,结果如图2(a)所示。 在阶段I,污泥转化率从40%左右逐渐增高至76%,随着负荷提高,污泥絮体中有机物逐渐释放到液体中,污泥的“增溶性”增加。 当负荷梯度陡然增加,污泥转化率急剧下降,但在阶段Ⅱ随着反应的继续,污泥的转化率回升。 试验运行至15 周之后[负荷>2 500 mg TSS/(L·d)],污泥转化率开始下降,原因是环境中高FA 浓度(质量浓度>300 mg/L)对发酵体系中微生物的活性产生抑制,如图2(b)所示。 研究[18]表明,当FA 质量浓度>250 mg/L 时会对微生物产生抑制作用。

图2 不同负荷梯度下的污泥产酸效能Fig.2 Acid Production Performance of Sludge under Different Load Gradients
在图2(c)中,SCODCr和VFAs 浓度随着负荷提高而增加,且增加趋势与负荷梯度呈正相关。 当负荷为3 250 mg TSS/(L·d)时,SCODCr与VFAs 质量浓度分别为7 631 mg/L 和3 339 mg CODCr/L,且随着负荷的继续提高而下降。 因此,污泥碱性发酵的最佳运行负荷为3 250 mg TSS/(L·d),在阶段Ⅲ稳定运行50 d 后,获得的污泥产酸率为(606±30) mg CODCr/(g VSS)。 从图2(d)中发现,污泥水解率与SCODCr和VFAs 浓度的变化趋势相似,随着负荷的提高而逐渐增加。 但是污泥酸化率与污泥转化率的变化规律相似。 在不同梯度提升负荷过程中,水解率从28%提高至41%(192 d),然而酸化率在阶段I达到最大值73%。 除了与污泥梯度变化有关,还与每天补入的浓缩污泥浓度有关,在阶段Ⅱ,每天补入的浓缩污泥的质量浓度从10.7 g/L 逐渐增加至30.0 g/L。
在污泥碱性发酵产酸过程中,FA 是影响VFAs 积累的主要限制因素。 在图2(b)中展示了不同梯度提高有机负荷的FA 浓度变化。 在阶段I,FA 均值为(208±39)mg/L,低于文献中报道的抑制限值(250 mg/L),表明低梯度工况下污泥发酵产酸性能没有受到FA 影响。 因此,通过低梯度提负荷对污泥产酸性能具有正向促进作用,有利于污泥碱性发酵系统的稳定,该结果与之前的研究结论一致[18]。在阶段Ⅱ,随着负荷的提高,FA 浓度逐渐增加。 当运行至第14 周,负荷为2 125 mg TSS/(L·d)时,FA质量浓度增加至283 mg/L,污泥的分解率、水解率、酸化率以及累积的VFAs 浓度均没有明显下降,反而随着反应的继续而增加。 当负荷为3 250 mg TSS/(L·d)时,FA 质量浓度达到最大值(456 mg/L),之后污泥的产酸性能下降。 污泥在碱性条件进行发酵产酸,通过先低梯度再高梯度提负荷的方法可以有效提高污泥的产酸性能。 此外,通过梯度变化的选择压,筛选出对FA 具有一定耐受性的水解酸化菌群,在高FA 浓度下仍具有较高活性,实现VFAs 的最大积累,以及碱性发酵的长期稳定运行。
2.2 负荷梯度变化对污泥产VFAs 组分的影响
VFAs 作为碳源被应用过程中,其组分是重要的考虑因素。 图3 展示了负荷梯度变化对VFAs 组分占比的影响。 VFAs 中包含了6 种小分子酸,乙酸占比超过50%,结果表明污泥碱性发酵产生的VFAs主要是乙酸,该结果与其他文献报道的结果一致。但是在不同负荷梯度下,VFAs 组分的变化趋势呈现差异。 在阶段I, 乙酸占比从64.01% 增加到71.67%(112 d),而丙酸、丁酸和戊酸的占比均呈现下降趋势:丙酸占比从20.02%降低至17.53%,异丁酸占比从5.98%降低到3.55%。 原因可能是丙酸和丁酸在产乙酸菌的作用下转化为乙酸,并释放CO2和H2。 在阶段Ⅱ,乙酸和丙酸的占比均下降,而丁酸和戊酸的占比均上升。 乙酸和丙酸的占比分别从69.12%和20.50%降低至57.11%和15.65%;异丁酸、正丁酸和异戊酸占比分别从3.47%、1.04%和5.39%升高至7.04%、6.47%和12.53%。 VFAs组分发生变化是负荷梯度变化导致对微生物形成环境选择压,促使微生物群落结构发生了变化,富集的优势功能菌发生演替,微生物的群落分析见3.4小节。

图3 不同负荷梯度下产生VFAs 的组分占比Fig.3 Components Proportion of VFAs under Different Load Gradients
2.3 负荷梯度变化对污泥发酵产生的非VFAs 产物的影响
污泥微生物胞内有机组分多为蛋白质和多糖,它们是污泥产酸的关键性物质[19-20]。 蛋白质和细胞组织等经过水解会释放氨氮和磷酸盐等物质,这些发酵产物的结果如图4 所示。 结果发现,阶段Ⅱ中蛋白质和多糖浓度比阶段I 的高,当运行至15 周之后[负荷>2 500 mg TSS/(L·d)]时,蛋白质和多糖浓度明显增加[图4(a)]。 原因是高浓度FA 刺激微生物,使微生物分泌更多的胞外聚合物,从而释放更多的蛋白质和多糖进而被水解酸化转化为VFAs,进一步提高VFAs 的含量[21]。 该结果与产酸效能结果一致。 在图4(b)中发现阶段Ⅱ中的氨氮与磷酸盐浓度均高于阶段Ⅰ,稳定运行后它们的质量浓度分别为(255±22) mg/L 和(153±18) mg/L。结果表明,高梯度提负荷过程中,污泥的水解性提高。 更多的污泥在细胞裂解酶、水解酶、酸化酶等作用下释放氨氮和磷酸盐。 此外,在整个发酵过程,氨氮的浓度明显高于磷酸盐。 因为释放氨氮的蛋白质等有机物的含量高于释放磷酸盐的磷脂双分子层和多磷酸颗粒的含量。

图4 不同负荷梯度下污泥发酵系统的非VFAs 产物变化Fig.4 Changes of Non-VFAs Products under Different Load Gradients
2.4 不同梯度负荷下的微生物群落分析
2.4.1 微生物多样性分析
为了进一步揭示不同负荷梯度对污泥产酸性能的影响,对污泥进行扩增子测序分析。 微生物的多样性结果如表2 所示。 S1、S2 和S3 分别是第62 d[第1 周,186 mg TSS/(L·d)]、110 d[第8 周,271 mg TSS/(L·d)]和173 d[第17 周,3 250 mg TSS/(L·d)]的产酸污泥。 所有污泥的微生物群落覆盖率均>99%,表明本次污泥的测序结果可信。 OTUs数量、Chao 指数和Ace 指数代表微生物的丰度,Shannon 指数代表微生物多样性。 从S1 到S3,Shannon 指数和OTUs 数量分别从3.89 和752 逐渐升高至4.20 和1 099。 结果表明,随着负荷的提高,微生物多样性和丰度均增加。
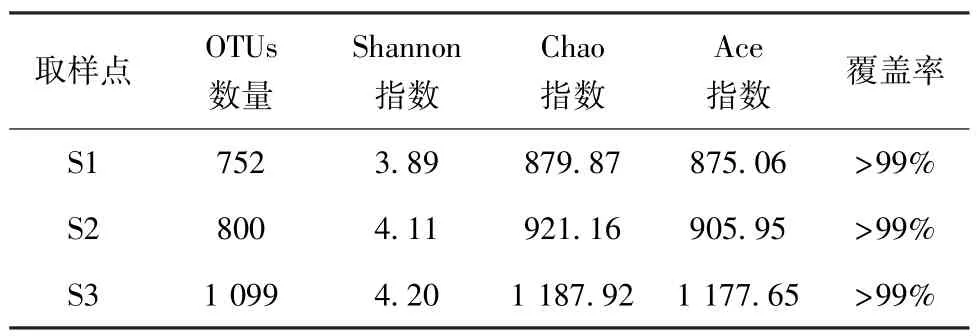
表2 不同负荷梯度下微生物多样性指数Tab.2 Microbial Community Diversity Index under Different Load Gradients
2.4.2 微生物组成分布
图5 展示了发酵污泥中的优势菌群(相对丰度>1%)。 在门水平[图5(a)],S1、S2 和S3 共有的优势菌分别为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes)。 这些微生物是厌氧发酵体系内常见的水解酸化菌[22-24]。 在低梯度负荷下,厚壁菌门和放线菌门的相对丰度分别从59.23%和10.15%下降到46.35%和3.67%,而变形菌门的相对丰度逐渐增加至22.89%。 结果表明,厚壁菌门和放线菌门中不适应的微生物逐渐被淘汰。 变形菌门是一种在各种环境中常见的微生物,包含了好氧-厌氧-兼性厌氧菌,可以降解大分子有机物,较易适应微生态环境的变化[25-26]。 因此,变形菌门逐渐富集。 据报道[24],拟杆菌门主要参与污泥中固体成分的分解,可以分泌溶细胞酶,将有机物转化为乙酸。 因此,在阶段I 中S2 富集的拟杆菌门(6.02%)将有机物转化为乙酸,并提高了乙酸的占比。 在阶段Ⅱ,拟杆菌门的相对丰度降低至3.87%,而绿弯菌门(Chloroflexi)逐渐富集(7.86%)。 绿弯菌门在厌氧消化中发挥至关重要的作用,促进水解过程,破坏复杂的有机物产生VFAs。 在阶段Ⅱ中富集的绿弯菌门有可能将复杂的有机物分解转化为丁酸和戊酸,提高VFAs 中丁酸和戊酸占比。
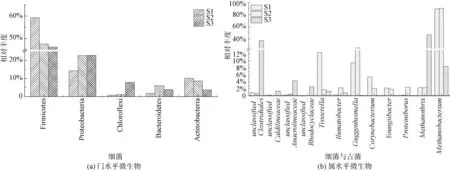
图5 不同负荷梯度的微生物组成Fig.5 Microorganism Composition under Different Load Gradients
图5(b)展示了属水平前10 种水解酸化菌和前2 种产甲烷古菌。 泰氏菌属(Tissierella)在负荷梯度变化过程中逐渐被淘汰,其相对丰度从12.34%降至1.31%。 泰氏菌属是一种嗜碱菌,在厌氧环境中可以将蛋白质和葡萄糖转化为VFAs。Youngiibacter和产氢产乙酸菌(Guggenheimella)作为产乙酸菌,可以将有机物转化为乙酸并释放H2和CO2。 在低梯度工况下,Youngiibacter相对丰度从2.34%降至1.94%,而产氢产乙酸菌相对丰度从9.37%升至24.88%。 结果表明,产氢产乙酸菌作为主要优势菌提高了乙酸占比。 此外,棒状杆菌(Corynebacterium)在S1 中相对丰度最高(5.38%),分解氨基酸转化为VFAs,随着负荷的提高,该菌基本上被淘汰。 在S2 中演变出新的水解酸化菌,分别为微酸菌(Ilumatobacter) 和产乙醇食蛋白质菌(Proteiniborus)。 在高梯度工况下S2 中富集的优势功能菌在S3 基本上被淘汰,阶段Ⅱ富集的优势菌分别为unclassified_Clostridiales(37.08%)、unclassified_Anaerolineaceae(4.29%)、unclassified_Rhodocyclaceae(2.58%) 和unclassified_Caldilineaceae(1.37%)。unclassified_Clostridiales是典型的水解酸化菌,可以分泌水解酶,将蛋白质和多糖等大分子有机物代谢为氨基酸和葡萄糖等小分子物质,进而转化为VFAs[27]。 此外,文献[28]报道Clostridiales中的部分微生物是产丁酸菌,该结果解释了在阶段Ⅱ丁酸占比增加的原因。 尽管碱性条件会抑制产甲烷菌的活性,但是在不同负荷梯度工况下检测到的产甲烷菌展现了差异。 在阶段I 中富集的产甲烷古菌是甲烷杆菌属(Methanobacterium),其在S1 和S2 中的相对丰度分别为89.78%和90.65%。 甲烷杆菌属是一种氢营养型的产甲烷菌,利用H2和CO2转化为甲烷。 然而在阶段Ⅱ中,甲烷杆菌的相对丰度降至8.37%, 甲烷丝菌(Methanothrix) 逐渐富集(46.96%)。 甲烷丝菌是一种乙酸型产甲烷菌[29],可以消耗VFAs 中乙酸。 微生物组成的结果进一步阐释了负荷梯度变化形成的环境选择压对微生物群落进行筛选,从而影响了VFAs 组分。
2.4.3 微生物的功能预测
图6 展示了前5 种氨基酸和碳水化合物代谢的基因丰度。 在5 种氨基酸代谢中,通过控制梯度提高负荷,更多的蛋白质被分解为缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、酪氨酸、色氨酸。 在低梯度工况下更多的色氨酸和赖氨酸进一步被酸化为VFAs。 针对多糖的分解,丁酸代谢的基因丰度在高梯度工况中最高,与VFAs 组分中丁酸占比增高的结果一致。
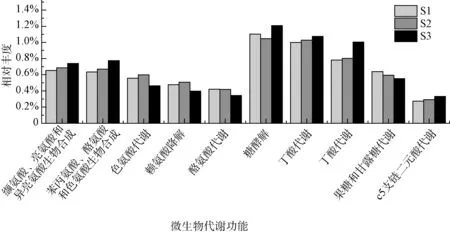
图6 不同负荷梯度下的微生物代谢功能Fig.6 Metabolic Function of Microorganisms under Different Load Gradients
3 结论
(1)通过负荷梯度的调控提高了污泥中有机物的长周期碱性发酵产酸性能,碱性环境发酵238 d,VFAs 积累量为3 339 mg CODCr/L,污泥的产酸率高达(606±30) mg CODCr/(g VSS)。
(2)污泥碱性发酵产酸的主要成分为乙酸,且负荷梯度变化对VFAs 组成产生了影响。 原因是梯度变化对微生物施加环境选择压,导致微生物群落结构发生变化。
(3)低梯度阶段富集的产乙酸菌为产氢产乙酸菌,高梯度阶段演变出新的优势水解酸化菌为unclassified_Clostridiales。 此外,代谢蛋白质和多糖的功能基因的丰度也发生变化。
(4)在高梯度提负荷工况下,FA 质量浓度达到456 mg/L 后产酸性能下降,富集的功能菌对FA 的耐受性高于其他文献中报道的限值(250 mg/L)。
