CRISPR/Cas12a技术在动物疫病检测方面的应用
2024-05-06孔玉方王慧煜袁向芬许晓琳吴绍强
孔玉方 , 王慧煜 , 袁向芬 , 许晓琳 , 吴绍强
(中国检验检疫科学研究院 动物检验与检疫研究所 , 北京 大兴 100176)
为加强我国国门生物安全,快速检测技术成为当下遏制外来动物疫病传入我国的有效方法之一。传统的病毒检测需要进行病毒的分离培养,细菌检测需要经过增菌扩大培养后鉴定,比较耗时费力,无法满足动物疫病的现场快速筛检。近期,随着核酸扩增技术结合簇状规则间隔的短回文重复序列及其相关蛋白(Clustered regularly interspaced short palindromic repeats and associated protein,CRISPR/Cas)系统检测敏感度和特异性的提升以及检测时间的缩短,该方法逐渐被应用于动物疫病的检测领域。
CRISPR-Cas系统为规律成簇的间隔短回文重复序列,是存在于古生菌和细菌中的适应性免疫系统[1],能够抵抗外来病菌的入侵,还具有“记忆性”,可以抵抗相同病菌的RNA或DNA的再次入侵,切断病菌入侵路径,使其无法进行复制和表达。近年来,研究人员发现CRISPR及其相关的Cas12、Cas13和Cas14蛋白在小向导RNA(Small guide RNA,sgRNA)的引导下,不仅可以裂解特异的靶标序列,还可非特异性切割单链DNA(Single-stranded DNA,ssDNA)或单链RNA(Single-stranded RNA,ssRNA),可基于上述原理设计特异性报告探针用于核酸的检测。因样本中靶病毒或细菌含量较少,研究者们通常将CRISPR/Cas系统与聚合酶链式反应(Polymerase chain reaction,PCR)、重组酶聚合酶扩增(Recombinase polymerase amplification,RPA)和环介导等温扩增(Loop-mediated isothermal amplification,LAMP)相关技术结合,实现靶标核酸含量增加的目的,使检测信号扩大,从而提高CRISPR/Cas系统检测的敏感性和特异性[2]。本文主要针对CRISPR/Cas12a结合核酸扩增技术在动物疫病检测中的应用进行综述,阐明该系统目前在检测中存在的问题,并对未来应用场景进行展望,以期为我国动物疫病的防治提供强有力的技术支撑,为我国进境动物把好国门生物安全关卡,防止外来动物疫病的入侵。
1 CRISPR/Cas12a检测原理
CRISPR/Cas系统大致分为2个大类和5个亚型,作为第2类V型CRISPR/Cas系统的Cas12a含有催化结构域RuvC,Cas12a蛋白可以利用RuvC结构域识别靶标核酸中的前间隔序列邻近基序(Protospacer adjacent motif,PAM),在sgRNA介导下与RPA产生的靶标DNA形成三元复合体,sgRNA-Cas12a三元复合物通过识别富含T的PAM序列特异性切割双链DNA(Double-stranded DNA,dsDNA)或ssDNA,激活并开始非特异性切割ssDNA两端修饰的羧基荧光素-马来酰亚胺,6-异构体(FAM maleimide,6-isomer,FAM)荧光显色基团和黑洞猝灭剂-1(Black hole quencher 1,BHQ1)猝灭基团[3-5],切断后的荧光报告分子中的荧光显色基团和猝灭基团分离,在特定波长的光源照射下可产生荧光信号。当含有靶标基因时,生物素作为报告分子,非特异性切割ssDNA两端修饰的FAM荧光显色基团和Biotin生物素基团,胶体金标记抗FAM抗体可以与FAM荧光显色基团结合,质控线(C线)中的链霉亲和素与生物素基团结合显色,抗FAM的二抗与胶体金-FAM荧光显色基团复合物结合,检测线(T线)显色,最终通过免疫层析试纸条实现检测结果的可视化(图1)[6-7]。该方法相较于传统的核酸检测方法具有无需特殊的仪器设备、操作简单、检测速度快、灵敏度高等优点(表1)[8]。目前,该技术已应用于新冠病毒[9]、食品生物安全[10]、动植物病毒[11-12]以及转基因[13]等多个检测领域。

表1 基于CRISPR/Cas12a系统的核酸检测技术与传统核酸检测技术的比较
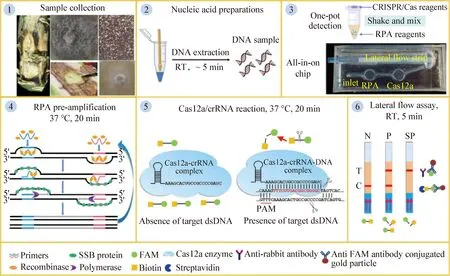
图1 恒温扩增和CRISPR/Cas12a可视化过程示意图[7]
2 CRISPR/Cas12a在动物疫病检测方面的应用
2.1 病毒疾病 非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)引起的一种急性、烈性和高度接触性病毒性传染病,可感染不同日龄和不同品种的家猪和野猪,病死率高达100%,给养猪业造成数以百亿的经济损失。目前,ASF尚无有效的商品化疫苗和治疗方法,只能通过快速精准的诊断和扑杀等手段来控制该病的传播。因此,开发高效快速的检测技术对ASF的预防和控制意义重大。目前,市售的非洲猪瘟检测试剂盒需要依赖大型仪器设备和专业操作人员,不能满足现场大批量样品的快速筛查。池进进[14]利用重组酶、DNA聚合酶和RPA,在37 ℃恒
温条件下即可扩增DNA,与CRISPR/Cas12a的切割反应相结合,建立了不依赖专业操作人员和大型昂贵仪器设备的ASFV检测方法,实现了荧光检测仅需30 min、可视化试纸条检测仅需20 min,2种方法的检测限均可达到10 copies/μL。Lu等[15]利用CRISPR/Cas12a技术,在ASFV保守区域设计了较为合适的sgRNA,将RPA技术与免疫层析试纸条技术相结合,该方法不依赖传统的PCR仪进行扩增就能够快速检测到ASFV,可准确检测出猪临床样品中的ASFV,灵敏度也较常规qPCR高。Wang等[16]采用ASFV保守基因p72设计了多条sgRNA,并筛选出几个高效的sgRNA用于ASFV的检测,结果显示,该检测技术的敏感性较商业化试剂盒提高了约10倍,且与其他病毒无交叉反应。He等[17]开发了一种高通量、全溶液相和等温CRISPR/Cas12a的ASFV检测系统,能够有效区分具有紧密匹配序列的核酸靶点,该系统仅靠1个墨盒和荧光计,在没有核酸扩增的情况下,2 h内ASFV的检测极限(Limit of detection,LoD)为1 pM,Cas12a/crRNA/ASFV DNA复合物在37 ℃这种生理温度下高度稳定,可以继续切割ssDNA,将LoD提高100 fM,适用于无设备仪器工作环境的基层工作人员对ASFV的筛查工作。
非洲马瘟(African horse sickness,AHS)是由非洲马瘟病毒(African horse sickness virus,AHSV)引起的马属动物疫病,对马的致死率达90%以上,是所有马类疾病中最严重致命的一种[18]。虽然我国迄今为止还没有AHS疫情的发生,但随着我国赛马相关产业的发展,马属动物贸易往来日趋频繁,增加了AHS的传入风险。因此,为防止AHS的传入,建立快速检测AHS的方法尤为重要。黄超华等[19]基于实时重组酶介导的恒温扩增(Real-time recombinase-aid amplification,RT-RAA)和CRISPR/Cas12a特异性sgRNA,结合侧向层析试纸条建立了一种AHSV RT-RAA-CRISPR/Cas12a可视化快速检测方法,该方法的最低检测限为2.16×101copies/μL,与世界动物卫生组织(World Organisation for Animal Health,WOAH)推荐的RT-qPCR检测结果高度一致,比较适用于口岸或野外现场AHSV的快速筛查。
猪伪狂犬病是由猪伪狂犬病毒(Pseudorabies virus,PRV)感染引起的一种急性、热性和高度接触性传染病,幼龄猪易感,死亡率高达100%。高效快速的现场大规模筛查是预防该病的重要举措。目前,国内外该病最常用的核酸检测方法是逆转录聚合酶链工反应(Reverse transcription polymerase chain reaction,RT-PCR)检测技术,该方法需要专业人员操作,无法满足现场检测的要求。胡轻轻[20]利用CRISPR/Cas12a能够特异性切割目的基因和非特异性切割荧光报告分子的特点,建立了现场检测PRV的Cas12a核酸体系和CRISPR/Cas12a与侧向层析试纸条相结合的核酸检测体系。Cas12a荧光检测体系与PCR扩增结合,虽延长了检测时间,但灵敏度和特异性都有了很大提高;Cas12a荧光检测体系与试纸条结合后,结果肉眼可观,无需检测仪器,易于野外和现场检测。与实验室常用的RT-PCR相比,Cas12a荧光检测体系耗时短、成本低,为猪伪狂犬病的早期预防和诊断提供了技术支持。
猪圆环病毒病(Porcine circovirus diseases,PCVD)是由猪圆环病毒(Porcine circovirus,PCVs)引起的一系列猪传染性疾病的统称,包括猪呼吸道疾病综合征(Porcine respiratory disease complex,PRDC)、断奶仔猪多系统衰竭综合征(Postweaning multisystcmic wasting syndrome,PMWS)、猪繁殖与呼吸障碍综合征(Porcine reproductive and respiratory syndrome,PRRS)、仔猪先天性震颤(Congenital tremors,CT)、猪皮炎肾病综合征(Porcine dermatitis and nephropathy syndrome,PDNS)和肠炎。猪圆环病毒2型(Porcine circovirus 2,PCV2)是猪圆环病毒病的主要病原,该病毒的传播给国内外养猪业造成了重大的经济损失,快速检测对PCV2的净化具有重要意义。范乐佳[21]利用CRISPR/Cas12a自身特性与RAA结合,通过RAA技术扩增PCV2核酸再进行CRISPR/Cas12a检测,因检测体系中加入ssDNA报告分子,其检测结果可通过蓝光照射或试纸条判读,且均可在30 min内获取准确结果。该检测体系为PCV2的净化提供了一种可行的技术手段。
2.2 细菌疾病 结核分枝杆菌(Mycobacteriumtuberculosis)是一种通过气溶胶传播的可引起人兽共患病的细菌。2018年,全球约有160万人死于该细菌感染,而且该菌特别容易产生耐药。对于结核分枝杆菌的早期快速检测也是预防和治疗该菌感染的关键。2018年,Ai等[22]在Chen等[23]建立的一种DNA核酸内切酶靶向CRISPR反式报告(DNA endonuclease targeted CRISPR trans reporter,DETECTR)方法的基础上,将该方法与Cas12a和RPA技术结合,用于结核病的检测,结果发现,基于CRISPR的活动性结核病的诊断方法,具有接近单拷贝的灵敏度,并且还具有同时检测与药物反应相关的多个位点的潜力,这对结核病的防治意义重大。Jia等[24]开发了一种新型的结核病诊断检测平台,称为基于CRISPR-Cas12a生物传感器系统的结核分枝杆菌多重交叉置换扩增技术(Mycobacteriumtuberculosismultiple cross displacement amplification technique with CRISPR-Cas12a-based biosensing system,MTB-MCDA-CRISPR),通过CRISPR/Cas12a的检测对MCDA结果进行解码,从而产生简单的视觉荧光信号读数,LoD为40 fg/反应,并且不与非结核分支杆菌菌株和其他物种发生交叉反应。总之,MTB-MCDA-CRISPR检测是一种很有前景且有效的结核病感染诊断、监测和预防工具。
布鲁氏菌病和类鼻疽伯克霍尔德菌病是2种人兽共患传染病,均具有传播性强和致病率高的特点,严重威胁人类的生命安全。快速精准地检测病原体,是防止疫情扩散、降低人民感染风险和减少我国养殖业经济损失的有效手段。徐健皓[25]建立了检测布鲁氏菌和类鼻疽伯克霍尔德菌的RPA检测技术,最低可检测出50fg/反应的羊布鲁氏菌基因组DNA和100 fg/反应的类鼻疽伯克霍尔德菌基因组DNA,且所有检测均可在10 min内完成,将RPA与CRISPR/Cas12a结合检测羊布鲁氏菌基因组DNA和类鼻疽伯克霍尔德菌基因组DNA时,最低检测限分别为5 fg/反应和20 fg/反应,所需检测时间为40 min;虽然检测时间延长了,但检测细菌的灵敏度提高了很多。该检测技术仅需金属浴或者小巧轻便的加热器就可以在野外或者现场实现对细菌的快速检测,为布鲁氏菌病和类鼻疽伯克霍尔德菌病的防治提供了新方法和新思路。
2.3 寄生虫疾病 隐孢子虫(Cryptosporidium)是一类寄生于人和多种动物胃肠道的病原。微小隐孢子虫(Cryptosporidiumparvum,C.parvum)是最常见的虫种,其中II d亚型是最常见的亚型。最常被报道的微孢子虫种是毕氏肠微孢子虫(Enterocytozoonbieneusi,E.bieneusi)。隐孢子虫除感染人外,还会感染家养畜禽、野生动物和伴侣动物等。感染这些肠道原虫后,免疫功能较强的个体一般为无症状感染者;而免疫功能不健全的个体严重时可导致死亡。这些病原对畜牧业的健康发展和人类的生命安全造成了极大的威胁。余复昌[26]建立的RPA-CRISPR/Cas12a可以快速检测样品中的C.parvumIId和E.bieneusi特异性核酸片段,最低可以分别检测到1.9×10-18M的重组质粒或每克粪便10个卵囊和3.7 copies/μL的E.bieneusiDNA,并且不与常见的肠道原虫发生交叉反应,表明该检测方法比较适用于临床大批量样品的检测,对寄生虫病的防控也具有一定的指导意义。Yu等[27]通过整合重组聚合酶扩增和Cas12a/crRNA反式切割系统,在蓝光下通过肉眼即可观察荧光试纸条检测结果,LoD达到单个拷贝数的C.parvum60kDa糖蛋白,并且与细小梭菌或其他常见肠道寄生原生动物无交叉反应。
疟疾是由疟原虫感染引起的一种最为严重的人兽共患寄生虫病,2021年,全球有2.47亿例疟疾病例,61.9万人死于疟疾。虽然2021年6月世界卫生组织(World Health Organization,WHO)宣布我国通过了消除疟疾的认证,但是境外输入疟疾的风险依然存在[28-30]。对人体危害最大的是恶性疟原虫,常用的检测方法有外周血涂片染色镜检法、酶联免疫吸附法、PCR和RT-PCR等,这些方法存在耗时和操作繁琐等缺陷。黄维益等[31]开发了一种简单快速检测恶性疟原虫的方法,以恶性疟原虫18S rRNA基因作为靶标序列,建立了RAA-CRISPR/Cas12a系统的恒温荧光快速检测恶性疟原虫的方法,可以检测出1 copies/μL的含恶性疟原虫3D7株18S rRNA基因的质粒;用该方法检测50份临床样本的结果与巢式PCR一致性达100%,检测稀释后的临床样本,最低检测限为50个疟原虫/μL。Wei等[32]开发并优化了一种基于RPA和CRISPR/Cas12a对疟原虫分离株进行检测的平台,结果显示,疟原虫基因组质粒的LoD为1 copies/μL,干血点的LoD为3.11~7.27个疟原虫/μL,且与血源性病原体无交叉反应。RPA-CRISPR/Cas12a平台检测疟原虫和恶性疟原虫的准确率分别为98.68%和94.74%,与巢式PCR的结果一致,优于qPCR的结果,该平台不需要核酸扩增反应的仪器或只需要最少的仪器,结果可以肉眼读取。与类似的诊断方法相比,该平台在降低检测要求的同时提高了反应速度。综上结果表明,该方法有望用于恶性疟原虫的快速检测和风险监测[32]。CRISPR/Cas12a技术在动物疫病检测中的应用如表2所示。

表2 CRISPR/Cas12a结合RPA扩增技术在动物疫病检测中的应用
3 小结与展望
CRISPR/Cas12a技术在动物疫病检测中展现出了良好的应用前景。该技术与各种核酸扩增技术的结合,提高了检测方法的灵敏度和特异性,且无需昂贵的仪器设备和专业人员就可实现现场的快速检测。但CRISPR/Cas12a技术也存在一定的缺陷,单独使用Cas12a进行检测的灵敏度较低,识别病原的难度较大,需要联合等温扩增等技术来提高模板量。但等温扩增技术的缺陷也随之呈现,如酶的工作效率、引物的用量和反应体系是否达到最佳配比等;CRISPR/Cas12a的sgRNA序列需设计在特定的PAM后,有时能够满足此设计条件的情况有限;RAA结合CRISPR/Cas12a系统提高了检测的灵敏度,但当将核酸扩增产物加入Cas12a的切割体系中时,开盖容易造成气溶胶的污染,导致假阳性结果的出现。相信未来通过不断的充分利用Cas12a的反式切割活性,简化核酸扩增的步骤,可以使CRISPR/Cas12a技术成为最为普遍的核酸检测技术。总之,CRISPR/Cas12a技术在动物疫病检测方面的优势值得进一步挖掘和探索,相信在不久的将来也可以实现该技术的现场快速定量检测,为我国的国门生物安全保障提供强有力的技术支撑。
