磁性金属-有机框架复合材料作为抗癌药物载体的研究进展
2024-05-06付巧芳
付巧芳 , 吴 瑛
(1. 新疆生产建设兵团塔里木盆地生物资源保护与利用重点实验室 , 新疆 阿拉尔 843300 ; 2. 塔里木大学生命科学与技术学院 , 新疆 阿拉尔 843300 ; 3. 塔里木大学化学化工学院 , 新疆 阿拉尔 843300)
在现代社会中,癌症的发病率和致死率不断提高,手术、放疗和化疗是治疗癌症最普遍的方式。但手术治疗局限于实体瘤而无法针对转移性恶性肿瘤; 放疗利用电磁辐射进行局部治疗,但对于晚期恶性肿瘤没有效果; 化疗是通过化学药物有效抑制肿瘤的增长,但因为化疗是全身给药,药物不具有识别性,会给全身的重要器官造成不可修复的损伤,除此之外,化疗还具有复合抗药性,会导致人体对多种药物产生抗药性。因此寻找新的治疗癌症的方式迫在眉睫。
磁性纳米粒子主要包括高饱和磁化的纯金属(Fe、Co、Ni等)及其氧化物(Fe3O4、γ-Fe2O3、NiO、Co3O4等)和铁氧体MFe2O4(M= Mn、Co、Ni)等。1996年,磁性粒子首次作为磁共振成像(Magnetic resonance imaging,MRI)的负性造影剂用于临床,此后,美国食品和药物管理局(Food and Drug Administration,FDA)批准g-Fe2O3和Fe3O4用于诊断和治疗,Fe3O4纳米粒子制备过程简便、产物纯度较高、且进入人体内参与代谢最终会被排出体外,因此其在生物医学领域,包括固定化酶、细胞分离、免疫测定、磁控栓塞环境和食品生物检测以及靶向药物方面具有广阔的应用前景[1]。
金属-有机框架(Metal-organic frameworks,MOFs)是一种新型多孔晶体材料。MOFs的高孔隙率和高比表面积使其具有较大的载药空间[2-4],还能调节材料中孔径的大小,最重要的是其具有较好的生物相容性,且易分解,从而可以快速排出体外,降低体内毒性,因此被认为是一种极具潜力的药物递送载体[5-6]。但是,由于MOFs不能有效识别癌细胞,对正常细胞具有较大毒性,因此大量研究者将目光聚集于磁性框架复合材料(Magnetic framework composites,MFCs),该复合材料通过一定的方法将MOFs与磁性粒子组装在一起,两者协同作用,既保留了MOFs的结构和性能特征,允许存储和释放药物;又为复合材料增添了强磁性能,提供了靶向效果,在生物医药领域具有广泛的应用价值。将MFCs视为微型“机器人”,通过病灶外部施加强磁场,成千上万个装载治疗药物的微型“机器人”组成治疗“大军”,直达患者的病灶部位,识别并攻击癌细胞,从而减少药物在循环中的扩散,由于肿瘤部位体液环境的pH(5.6)不同于正常体液环境的pH(7.4),且外界交变磁场使肿瘤部位温度升高,因此MFCs中MOFs结构在肿瘤部位崩塌而释放抗癌药物,可实现高效且无毒副作用的治疗。本文对MFCs的制备方法、种类、作为抗肿瘤药物载体的特点及其作用方式进行总结与归纳,以期为MFCs的临床应用提供理论依据。
1 MFCs的制备方法
MFCs是指将各种MOFs与磁性粒子组装在一起,使MOFs具备磁性性能,使其能够磁靶向到病灶区域,其制备方法包括嵌入法、叠层法、封装法和混合法(图1)[7]。

图1 MFCs的不同制备方法[7]
1.1 嵌入法 如图1A所示,嵌入法是将磁性粒子嵌入MOFs材料的表面,通常在MOFs的成核和生长混合物中加入磁性粒子,然后通过超声或水热条件将磁性粒子包埋在MOFs中。根据主要溶剂的不同,可以通过溶剂热法或水热法合成MFCs。溶剂热法使用高沸点极性非质子溶剂,例如N,N-二甲基甲酰胺(N,N-Dimethylformamide,DMF)、N,N-二乙基甲酰胺(N,N-Diethylformamide,DEF)、N,N-二甲基乙酰胺(N,N-Dimethylacetamide,DMA)或二甲亚砜(Dimethyl sulfoxide,DMSO),也可以添加助溶剂,例如甲醇、乙醇或水;水热法则使用水或以水为主要成分的溶剂混合物。嵌入法制备方法简单,适用于大多数MFCs的合成,通过嵌入法合成的MFCs材料结构通常类似于MOFs结构,但在合成过程中,一部分磁性粒子会嵌入MOFs的孔径中,致使MFCs的比表面积降低,因此MFCs作为药物载体时一般不会采用嵌入法进行制备,因为磁性粒子占用了MOFs的孔径,会使载药率降低。
1.2 叠层法 由于官能团的修饰可以有效控制晶体的生长,叠层法一般先用一定官能团修饰磁性粒子表面,再将MOFs通过液相外延法在修饰后的磁性粒子表面逐层生长,最终形成具有核壳结构的MFCs材料(图1B)[8]。一般需要—COOH或—NH2等官能团进行修饰,形成以磁性颗粒为核,MOFs为壳的核壳结构,因此所得到的MFCs晶体可以保持原始磁性粒子的形状。这种方法适用于合成复杂的MFCs复合材料,可以精确控制 MOFs 外壳的厚度,制备过程简单,在室温下即可进行,但该方法制备时间过长,可以满足要求的 MOFs 配体种类也很有限。Ashtiani等[9]提出了一条简易的合成路线来制备新的杂化材料Fe3O4-UiO-66-NH2,制备过程如图2所示,以—NH2进行修饰,控制Zr-MOFs在Fe3O4纳米粒子表面的生长。

图2 Fe3O4-UiO-66-NH2的制备过程
1.3 封装法 封装法利用磁性粒子和MOFs之间的缓冲界面,促进了磁性粒子周围MOFs的增长,磁性粒子需要预先嵌入聚合物层中,然后添加到 MOFs 的成核和生长混合物中,即可形成MFCs(图1C)。该方法通常用于合成以磁性粒子为核心、以MOFs为壳层的复合材料,合成步骤较简单、可调控性强,缺点是需要对磁性粒子提前进行修饰,且MOFs生长的均匀性难以控制。Lu等[10]报道了一种控制封装法,使不同尺寸、形状和组成的表面活
性剂覆盖的磁性粒子被沸石咪唑酸盐框架(Zeolite imidazolate framework,ZIF)-8包裹,加入的纳米粒子可以很好地分散并完全限制在ZIF-8晶体中,且每个ZIF-8晶体中可以有控制地掺入多个磁性纳米粒子。该方法所制备的纳米颗粒/ZIF-8复合材料有催化、磁性和光学特性。
1.4 混合法 混合法首先要分别制备磁性颗粒和MOFs,然后将提前制备好的磁性颗粒与MOFs直接混合在一起,在超声或高温聚合条件下制备MFCs材料(图1D)[7]。该方法中控制 MOFs 与磁性材料之间粘合性能的持久度是关键问题之一,其中静电相互作用是重要条件。混合法是制备MFCs复合材料最简单的方法之一,几乎适用于任何 MOFs。但是磁性纳米粒子与MOFs的结合并不是特别牢靠,容易分离,混合法制备的MFCs的不稳定结构限制了其在药物递送领域的应用,而且在制备过程中两者的量不能很好的控制,因此,要从MFCs中清除未完全反应的MOFs需要利用磁分离的方法,而去除未完全反应的磁性颗粒则需要依赖MFCs和磁性粒子不同的沉降速率的原理来完成,操作较复杂。
2 MFCs的种类
近年来,随着国内外研究者对MFCs材料的不断探索,MFCs的种类和数量不断丰富,根据MOFs常见基底种类的不同可将其分为以下几个类别(图3),并对其相应的载体结构进行举例。

图3 MFCs的种类
2.1 磁性拉瓦希尔骨架系列MOFs材料 磁性拉瓦希尔骨架(Magnetic materials of institute Lavoisier,M-MIL)系列MOFs材料具有耐高温、耐溶剂等优良特性,通常由过渡金属(如Cr3+、Fe2+等)与二羧酸配体制备而成[11],由于Cr3+具有一定毒性,因此通常药物载体不会选择Cr-MOF,而选择生物安全性好的Fe-MOF。Yang等[11]所制备的Fe3O4@Fe-MOF为明显的核壳结构(图3),该复合材料载体本身的生物相容性较高,通过负载HAp而具有pH响应性能,因此在肿瘤酸性环境下可以有效杀死肿瘤细胞,减少对正常组织的毒副作用。但传统的M-MIL通常采用水热法合成,不仅需要使用高压反应釜,在水热温度高于100 ℃的条件下反应12 h,还需控制反应体系的pH<1。水热法能耗非常高但产率较低,同时还需要添加氢氟酸(Hydrofluoric acid,HF)用作矿化剂以促进晶体生长并改善结晶度;严苛的合成条件和使用HF所带来的环境风险,严重限制了M-MIL的规模化生产和应用。
2.2 磁性ZIF系列MOFs材料 磁性ZIF(Magnetic zeolitic imidazolate frameworks,M-ZIFs)系列MOFs材料是由2价金属离子Zn2+、Co2+等与咪唑类配体配位产生的一种材料,是目前使用最为广泛的MOFs型药物载体。M-ZIFs的合成方法简单,在室温条件下即可合成。ZIFs具有较好的稳定性,耐受高温,因此,复合材料M-ZIFs包裹药物后可保护药物不受高温环境的破坏。此外,M-ZIFs不仅具有M-MOFs的基本特性,还具有中性条件稳定、酸性条件降解的独特优势,是一种良好的pH响应性药物传输载体材料[12]。在酸性条件下,ZIF-8中的2-甲基咪唑发生质子化,导致 Zn2+与咪唑环之间的配位键断裂,ZIF-8的结构逐渐降解。
2.3 磁性UiO系列MOFs材料 磁性UiO(Magnetic university of Oslo,M-UiO)系列MOFs材料是由Zr(IV)与线性配体形成一个立方刚性三维多孔结构,Zhao等[13]通过简易的原位合成法合成Fe3O4@UiO-66,由于UiO-66有大量的开放腔、金属位点和两亲性,使Fe3O4@UiO-66利于捕获和释放阿霉素(Adriamycin,DOX)等抗癌药物;形成的Fe3O4@UiO-66复合材料同时具备Fe3O4核心的T2-磁共振(T2-magnetic resonance,T2-MR)特性和MOF外壳的药物输送能力。因此,Fe3O4@UiO-66复合材料显示了优秀的稳定性、较高的药物装载能力、较低的细胞毒性和明显的MR信号,此外,该复合材料可持续性的释放药物,表现出长期持久且有效的抗癌治疗效果。
2.4 磁性Mg基MOFs材料 虽然磁性Mg基MOFs(M-Mg-MOFs)目前尚未用于载药,但单纯的Mg-MOFs已经用作药物载体,Lawson等[14]制备了具有快速药代动力学特性的Mg-MOF-74,首次证明Mg-MOF-74可以对布洛芬和姜黄素进行联合递送,因此在未来的研究中应扩大M-Mg-MOFs在药物输送方面的应用。
2.5 磁性Cu基MOFs材料 磁性Cu基MOFs也具有作为药物载体的优良特性,Ke等[15]将Fe3O4纳米棒与Cu3(BTC)2(HKUST-1)纳米晶体相结合制备磁性MOFs纳米复合材料,该复合材料是一个具有三维通道系统的MOFs,具有磁性特性和高孔隙率,可装载尼美舒利用于治疗胰腺癌。这些MOFs基磁性纳米复合材料吸附量达到0.2 g/g,且在37 ℃生理盐水中完成药物释放需要长达11 d。尽管基于羧酸铜的受控药物递送材料由于其可能的生理毒性而不能应用于实际中,但这项研究表明存在潜在的磁性MOFs纳米复合材料,为后期研究提供了一定的研究思路。
3 MFCs作为抗肿瘤药物载体的特点
磁性框架复合材料在生物医学领域具有极大的意义,其可以在生物系统中携带和传递特殊的药物,这些功能是由MFCs中的MOFs和磁性粒子之间协同作用实现的。事实上,MOFs的高比表面积用来存储和释放药物,磁性粒子提供靶向效果,两者协同作用后有如下几个特点。
3.1 较高的安全性 生物安全性是药物最重要的一个特点,良好的生物可降解性能够保障载体在较短时间内分解成小分子物质,进而排出体外,减轻机体代谢负担。已知Fe3O4纳米粒子安全性较高,可被排出体外,因此应用于临床。Baati等[16]制备了MIL-100(Fe)等多种MOFs,将三种不同的多孔羧酸铁(Ⅲ)金属-有机框架纳米颗粒高剂量静脉注射大鼠,进行体内急性毒性研究,评估它们在大鼠体内的分布、代谢和排泄情况,结果所有研究参数(血清、酶、组织学等)都表明纳米MOF被生物降解,直接通过尿液或粪便排出体外,不会产生大量毒性。
3.2 较高的载药率 当前的有机纳米药物普遍存在载药量过低的问题,如脂质体的载药量通常难以超过1wt%,聚合物纳米粒的载药量只有约6wt%[17],这样患者会摄入大量辅料,导致身体负担加重[18]。因此,提高载药率一直是研究抗癌药物的一个巨大挑战,表1列举了9种MFCs对不同药物的载药能力,表2列举了9种常见药物载体的载药能力,通过表1和表2对比可知,MFCs载体的载药量较高,说明MFCs继承了MOFs高比表面积和高孔隙率的特点,有很大的载药潜力。

表1 MFCs载药能力统计
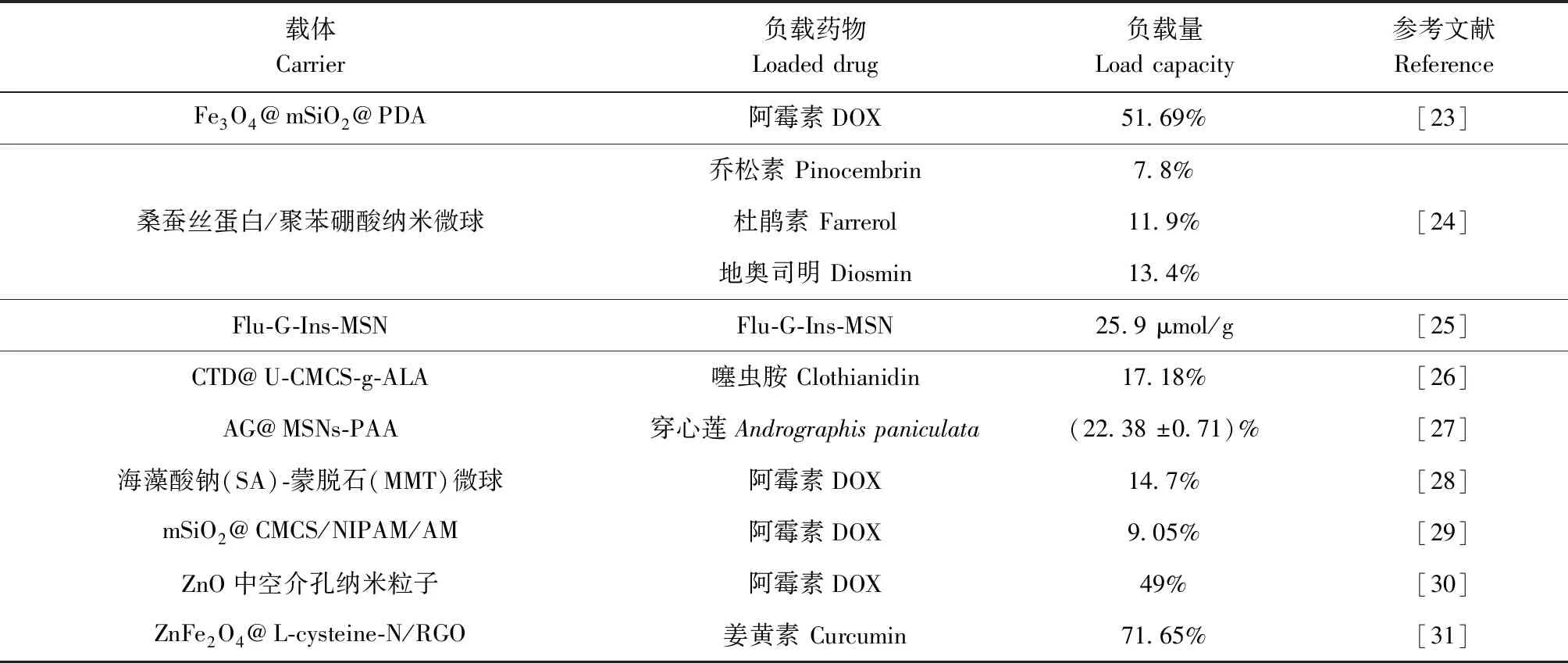
表2 常见药物载体载药能力统计
3.3 药物释放精准 药物递送系统(Drug delivery system,DDS)是指将治疗药物与纳米载体材料复合形成的纳米药物载体复合物,载体将化疗药物、多肽、基因和蛋白质等通过局部给药或全身循环累积在特定的病灶部位。近年来,DDS在肿瘤治疗中受到极大关注,宿主MOFs可通过DDS在pH、磁场、离子、温度、光和压力等多种刺激下将客体药物靶向传递到细胞或组织并精确释放,达到靶向治疗效果[32]。肿瘤微环境是一个pH<7的弱酸性环境,因此,MFCs中的磁性粒子将载体与封装在载体中的药物通过外界磁场靶向到肿瘤组织,进而通过MFCs中MOFs的pH响应将药物从载体中释放出来,这使MFCs在DDS中更具有发展前景。王晓丹等[21]以磁性Fe3O4纳米粒子为基底,制备的Fe3O4@ZIF-8@PA具有pH响应,其负载DOX后在pH为7.4的条件下相对稳定,24 h持续累积释放量达到39.8%,当pH为5.0时,由于载体表面物理吸附的药物分子和载体本身壳层结构发生降解,孔道内的药物分子释放速率明显加快,24 h后最终累积释放量可高达82.8%,表明通过合成pH响应控制释放载药载体有利于药物在肿瘤部位的加速释放,提高局部药物浓度。
3.4 肿瘤靶向效果 Fe3O4磁性纳米粒子的超顺磁性,使其可以被外界磁场所调控,进而为癌细胞的标记、分离和对肿瘤组织的靶向给药提供了可能[33]。MOFs 用作控释载体一般是与磁性粒子结合达到可控释放的目的,具体做法是将负载药物载体MOFs 包覆在磁性粒子表面,制成磁性药物释放系统,在外加交变磁场的作用下,实现磁性颗粒与药物分子的定向运送,在医药领域有巨大潜力[34]。Lohe等[35]制备了磁功能化的HKUST-1负载布洛芬,发现不论外部静磁场的表面功能化程度如何,都能使药物分子在特定的组织细胞中定向积累,而且外部交变磁场的磁诱导加热明显加快了布洛芬的释放速率,实现了药物分子的可控释放。
3.5 肿瘤热疗 热疗是通过对肿瘤组织选择性地加热至39~45 ℃,产生对肿瘤的抑制和杀伤作用,这种治疗方法对正常细胞的损害小,具有安全性高的特点,在肿瘤的治疗方面已经有了极大的进步[36]。然而,传统加热方法的效率和精度不足导致其发展缓慢,疗效有限。磁热疗法是通过外界磁场将磁纳米载体靶向到病灶区,随后通过外界交变磁场的干预直接产生热能,对深层肿瘤具有杀伤能力。Xiang等[37]制备了MOFs衍生的新型多孔Fe3O4@C纳米复合材料,结果显示,磁性热疗和化疗协同治疗后,Fe3O4@C-PVP@DOX显著降低了肿瘤的体积和重量,为癌症治疗提供了一体化平台。
3.6 核磁共振成像 通过使用具有成像功能的材料构成DDS,可实现在递送药物的同时,辅助肿瘤病情的诊断,具有诊疗一体化的功能。MFCs很有前途成为磁共振成像(Magnetic resonance imaging,MRI)的造影剂,与临床小分子造影剂相比,MFCs的框架结构特点确保了其不仅具有大量的顺磁性金属中心,而且表现出增强的单金属基弛豫性。Rigter等[38]展示了Gd-MOFs作为MRI造影剂的潜力,但游离Gd3+浸出导致肾源性系统性纤维化,限制了其临床应用。Mn2+和Fe3+也是强顺磁性金属离子,其毒性远低于Gd3+,因此低毒性的Mn2+-MOFs和无毒的Fe3+-MOFs已被开发应用。Mn/Fe-MOFs作为MRI造影剂的生物相容性得到了改善,但其中等弛豫性限制了成像灵敏度,阻碍了其实际应用。氧化铁纳米颗粒能够显著缩短横向弛豫时间且具有良好的生物相容性,在MRI成像中普遍使用[39]。因此,利用Fe3O4作为磁性纳米颗粒设计弛豫性高、有效载荷大、生物相容性好的多功能MOFs基复合材料是切实可行的。最近,2个研究小组分别开发了多功能Fe3O4@PAA/AuNCs/ZIF-8NPs[40]和RITCFe3O4@IRMOF-3/FANPs[41],用2种不同的基于锌的MOFs进行成像和给药,证明了MOFs复合材料在生物医学中的实用性。
4 MFCs的作用方式
肿瘤细胞具有无限增殖的特点,分裂速度极快,需要高效的新陈代谢作用才能获取必需的腺嘌呤核苷三磷酸(Adenosine 5′-triphosphate,ATP);氧气和能量底物的不足会迫使肿瘤细胞改变呼吸作用方式,转变为无需氧的糖酵解途径。代谢途径的改变导致细胞内产生大量乳酸,肿瘤微环境表现为微酸性[42]。肿瘤酸性微环境可促进肿瘤细胞的增殖,并使其向正常细胞侵袭,这也是肿瘤发生恶性转移的重要原因之一。靶向制剂-MFCs在外界磁场作用下向病灶区域富集,如图4所示,未添加外界交变磁场时,病灶区域的温度为37 ℃,在肿瘤酸性环境中MFCs中的MOFs成分使其中一部分载体结构崩塌,致使负载在MFCs载体中的抗癌药物释放,进而达到抗癌效果;当添加外界交变磁场后,磁诱导加热使病灶区域温度迅速升高至39~42 ℃,过高的温度可以加速癌细胞的死亡。因此,MFCs载体可以通过pH响应和热响应2种方式促进抗癌药物的释放,进而使癌细胞凋亡,将抗肿瘤与磁热疗更好的应用于癌症治疗中。

图4 以MFCs为抗癌药物载体的作用机制
5 小结与展望
针对不同药物载体的不足之处,MOFs结合了有机载体安全性高的特点和无机载体载药率高的特点,而以磁性粒子为核生长MOFs所得到的MFCs不仅继承了MOFs载药率高、生物相容性好、孔径率高和比表面积高的优点,同时还具有磁靶向和磁热疗性能,在未来的生物载药方面具有巨大的发展意义。
MFCs作为抗癌药物的载体,国内外研究的时日较短,目前仍处于理论和发展时期,因此还存在一定弊端:(1)作为药物载体,不仅要求载药率高,重要的是生物安全性要高,但大多数MOFs合成时所应用到的有机溶剂具有一定毒性且较难清除,因此对有机配体的清除和选择具有极大的挑战;(2)MFCs的制备方法单一,传统的4种方法都有利有弊,因此需要探索寻求更可控、简单和环保的MFCs的制备方法。(3)MFCs中可以利用的MOFs种类较少且制备出的MFCs的结构不够稳定,未到病灶区就崩塌,从而导致药物递送效率降低,因此对MFCs结构的稳定性具有一定的挑战。
总之,MFCs作为抗癌药物的载体具有巨大的发展空间,优化MFCs使其真正应用于医疗,还有待于不断的挖掘和研究。
