不同ELISA检测方法在检测出壳雏鸡禽白血病病毒感染中的应用
2024-05-06崔慧珍张亚文王一新
崔慧珍 , 张亚文 , 王一新 , 常 爽 , 赵 鹏
(山东农业大学动物科技学院 , 山东 泰安 271018)
禽白血病(Avian leukosis,AL)是由禽白血病病毒(Avian leukosis virus,ALV)感染引起的一种家禽肿瘤性疾病。根据病毒的宿主范围、病毒间的干扰作用和病毒囊膜蛋白抗原特性,ALV可被分为A~K不同亚群(ALV-A~ALV-K)[1-3],其中ALV-E属于内源性ALV,没有致病性或致病性很弱,但可以干扰外源性ALV的检测。大量流行病学报道均显示,ALV-A、ALV-B、ALV-J和ALV-K是我国广泛流行或曾报道过相关病例的主要代表亚群[4-7],感染不同品种的鸡都可以引发不同程度的临床症状[8-10],其中ALV-K是首先从我国特有的地方品系鸡中分离得到的新亚群[4]。AL给我国家禽养殖业造成了较大的经济损失,所以被列为我国种禽场必须要实现净化的主要禽病之一。
垂直传播是ALV主要传播途径,多数ALV病例是经垂直传播或早期水平传播感染引起的,经垂直传播感染ALV的雏鸡出壳后免疫系统通常发育不完全[11]。在实施AL净化过程中,对出壳雏鸡的检测和淘汰对于最大程度降低垂直传播及其带来的早期水平传播危害极为重要,目前ALV净化检测方法中最简单快速的就是采集出壳雏鸡胎粪进行ALV群特异性衣壳蛋白27(Protein 27,p27)抗原检测,在尽可能短的时间内检出阳性鸡进而淘汰。p27抗原ELISA检测是目前实施AL净化用途最广泛的检测试剂盒,目前市场上多种商品化ALV-p27抗原ELISA试剂盒的特异性和灵敏度不尽相同[12]。如果养殖场使用了特异性和灵敏度存在问题的试剂盒,造成检测过程中的假阳性或假阴性,无疑会影响AL净化进程。本试验通过鸡胚卵黄囊分别接种ALV-A、ALV-B、ALV-K和ALV-J四个亚群的ALV毒株,构建鸡胚垂直感染携带ALV模型,以尽可能模拟生产中的垂直传播过程,胎粪样品直接应用4家公司的ALV-p27抗原ELISA检测试剂盒进行检测,将血浆和肝脏样品病毒分离作为确定感染阳性的参考标准,同时并以实时荧光定量PCR(Real-time quantitative PCR,RT-qPCR)进行平行检测,通过上述不同ELISA试剂盒与不同检测方法的对比评价试剂盒的灵敏度,以期为评价不同ELISA试剂盒和不同检测方法在净化AL中的价值提供参考评估模型。
1 材料与方法
1.1 毒株和细胞 ALV-A野毒株SDAU14A1(GenBank 登录号:KU375453.1)于2014年由本实验室从我国特有地方品系龙胜凤鸡某保种鸡群种蛋中分离鉴定和保存;ALV-B野毒株SDAU09C2(GenBank 登录号:HM446005.1)于2009年由本实验室从山东省某芦花鸡场中分离鉴定和保存;ALV-J野毒株NX0101(GenBank 登录号:DQ115805.1)于2001年由本实验室从宁夏回族自治区某父母代种鸡场中分离鉴定和保存;ALV-K野毒株JS11C1(GenBank 登录号:KF746200.1)于2012年由本实验室从江苏省某地方品系保种鸡群中分离鉴定和保存。用于病毒增殖的鸡胚成纤维细胞系(Douglas foster-1,DF-1),购自美国生物资源中心(American Type Culture Collection,ATCC),由山东农业大学家禽肿瘤病实验室保存。无特定病原(Specific pathogen free,SPF)鸡胚,购自济南赛斯家禽有限公司。4种亚群ALV毒株在DF-1细胞上增殖后,按照Reed-Muench法测定其组织半数感染量(50% Tissue culture infective dose,TCID50)。
1.2 主要仪器和试剂 Biotek Synergy H1 酶标仪,购自广州达瑞生物技术股份有限公司;ABI Quant Studio 5实时荧光定量PCR系统,购自美国Thermo Fisher Scientific公司。RNA提取试剂盒,购自美国Omega Bio-Tek公司;ALV-p27抗原ELISA试剂盒均为市场上在售商品化试剂盒,根据企业要求分别编号为 A、B、C和D;
1.3 病毒接种和样本采集 将100枚SPF鸡胚随机分为5个组,ALV-A、ALV-B、ALV-J和ALV-K感染组每组20枚,每组分别在8胚龄时通过卵黄囊以500 TCID50/枚的剂量接种4种亚群ALV毒株,20枚SPF鸡胚经卵黄囊接种等体积无菌生理盐水作为对照组。待鸡出壳后逐一编号,采集各组雏鸡胎粪样品和血浆样品,死亡鸡胚肝脏样品,死亡雏鸡胎粪样品、血浆样品和肝脏样品。胎粪样品与样品稀释液充分混匀后放于-20 ℃冰箱保存。无菌抗凝血样品3 000 r/min离心5 min取上层血浆样品放于-80 ℃冰箱保存。肝脏样品加入无菌PBS研磨,12 000 r/min离心3 min取上清,用0.22 μm无菌滤器过滤后放于-80 ℃冰箱保存。
1.4 胎粪样品直接ELISA检测 所有胎粪样品检测前反复冻融3次,将样品恢复至室温,涡旋振荡后以12 000 r/min离心2 min,取100 μL上清进行ALV-p27抗原检测,分别以4家公司ALV-p27抗原ELISA检测试剂盒对胎粪进行检测,操作方法按各试剂盒说明书进行,读取样品光密度(Optical density,OD)值,按照说明书方法计算得出样品与阳性对照比值(Sample/Positive,S/P),S/P≥0.2,判定样品为阳性;S/P<0.2,则判定样品为阴性。
1.5 血浆和肝脏病毒分离样品ELSA检测 取1.3中处理的无菌血浆样品和肝脏过滤液样品接种于已长成单层的DF-1细胞,37 ℃、5% CO2恒温培养箱孵育2 h后弃上清液,无菌PBS清洗3遍,换为含1% FBS的DMEM培养基,在37 ℃、5% CO2恒温培养箱继续培养7 d;取100 μL细胞培养上清液反复冻融3次,按1.4方法以4家公司ALV-p27抗原ELISA试剂盒对细胞上清液进行检测。
1.6 RT-qPCR扩增 取1.3中处理的胎粪样品、血浆样品和肝脏过滤液样品各150 μL,按照RNA提取试剂盒说明书操作提取RNA。根据GenBank中不同亚群ALV代表株的囊膜糖蛋白(Glycoprotein 85,gp85)基因序列,使用Lasergene 7.0软件比对并寻找亚群特异性的保守区域,应用Primer 5.0软件设计针对ALV-A、ALV-B、ALV-J和ALV-Kgp85基因的引物(表1),引物由上海生工生物工程技术服务有限公司合成。RT-qPCR反应体系:RT-qPCR预混液20 μL,酶混合物1 μL,上、下游引物各1 μL和 RNA样品500 ng;反应程序:42 ℃ 15 min,95 ℃ 3 min,40×(95 ℃ 15 s,53 ℃ 10 s,60 ℃ 30 s)。在每个60 ℃荧光扩增循环反应时进行不同波段荧光信号的收集和检测。

表1 4种亚群ALV的RT-qPCR检测引物
2 结果
2.1 ALV-A感染组不同检测方法结果对比 ALV-A感染组20枚鸡胚共有14只雏鸡孵化出壳,每只雏鸡胎粪和血浆病毒分离样品通过ELISA和RT-qPCR检测,结果如表2所示,大部分样品阴阳性判定结果基本一致,只有部分样品存在不一致的情况。例如:A-04血浆病毒分离样品仅D公司ELISA和RT-qPCR结果均为阳性,其余3家公司ELISA结果接近判定为阳性的临界值,胎粪样品直接ELISA和RT-qPCR结果均判为阴性;A-03、A-12和A-13胎粪样品直接ELISA和RT-qPCR结果为阴性,但血浆病毒分离样品ELISA和血浆样品RT-qPCR结果均呈阳性;A-08胎粪样品直接ELISA结果仅B公司为阳性,血浆病毒分离样品ELISA和RT-qPCR结果均为阳性。结果表明,仅胎粪样品直接ELISA检测并非100%可以将阳性鸡只检出,血浆病毒分离样品ELISA检测具有更高的灵敏度,可以检出更多的感染鸡只。
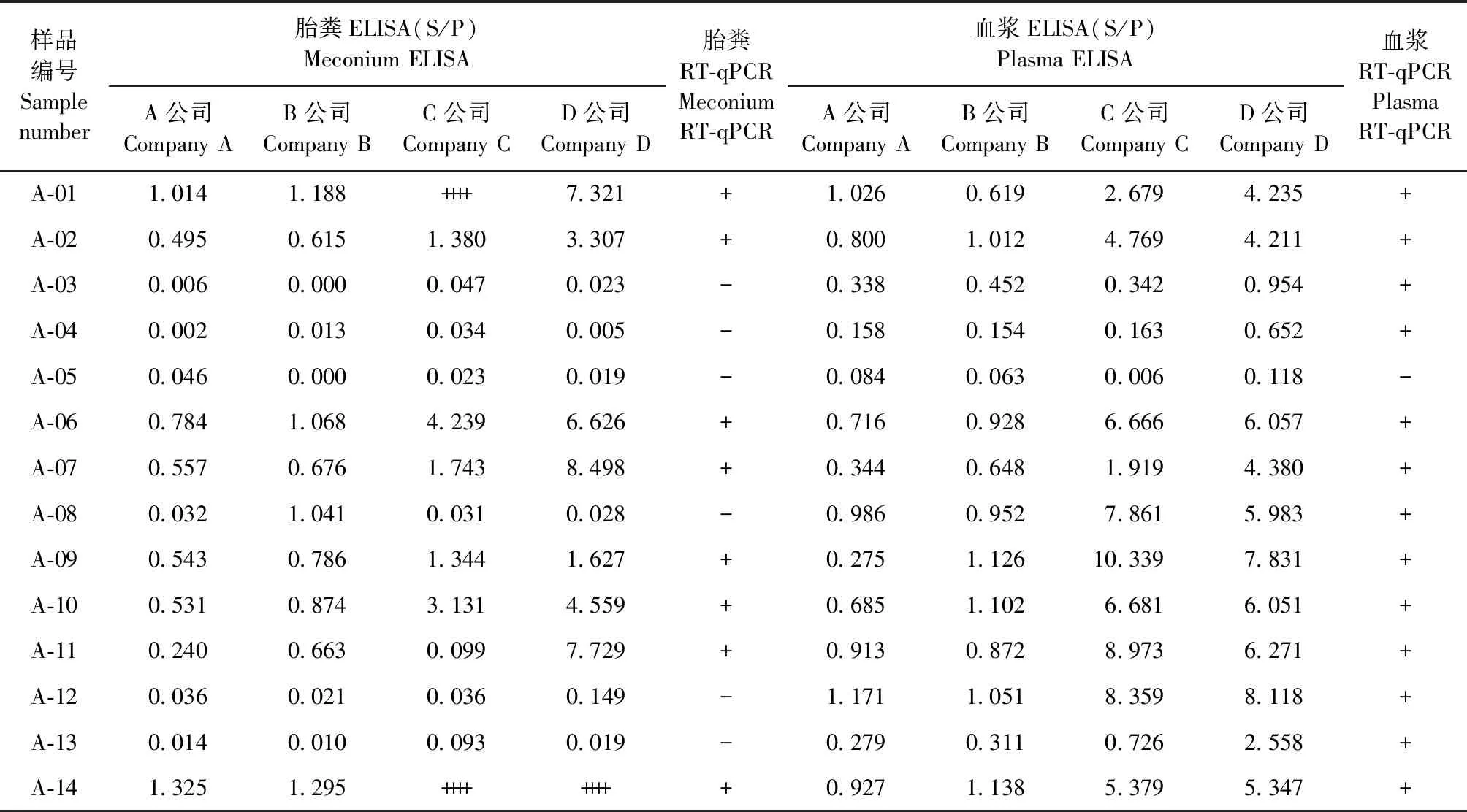
表2 ALV-A感染组不同类型样品利用不同检测方法检测的结果对比
2.2 ALV-B感染组不同检测方法结果对比 ALV-B感染组20枚鸡胚共有16只雏鸡孵化出壳,每只雏鸡胎粪和血浆病毒分离样品通过ELISA和RT-qPCR检测,结果如表3所示,大部分样品阴阳性判定结果基本一致,只有部分样品存在不一致的情况。例如:B-01胎粪样品直接ELISA结果虽判定为阴性,但接近判定为阳性的临界值,RT-qPCR结果为阳性,而血浆病毒分离样品ELISA和血浆样品RT-qPCR结果均为阴性;B-03胎粪样品B公司ELISA结果、血浆病毒分离样品ELISA结果和血浆样品RT-qPCR结果均为阳性,其余3家公司胎粪样品直接ELISA结果为阴性,表明不同试剂盒的灵敏度存在差异;B-08胎粪样品直接ELISA和RT-qPCR结果均为阴性,而血浆病毒分离样品ELISA和RT-qPCR结果均为阳性,表明血浆病毒分离样品ELISA检测灵敏度更高;B-09胎粪样品直接ELISA和RT-qPCR结果均为阴性,血浆病毒分离样品A公司和B公司ELISA结果为阴性,但接近判定为阳性的临界值,C公司和D公司ELISA结果和血浆样品RT-qPCR检测结果为阳性,表明不同ELISA试剂盒对同一样品检测的灵敏度不同。
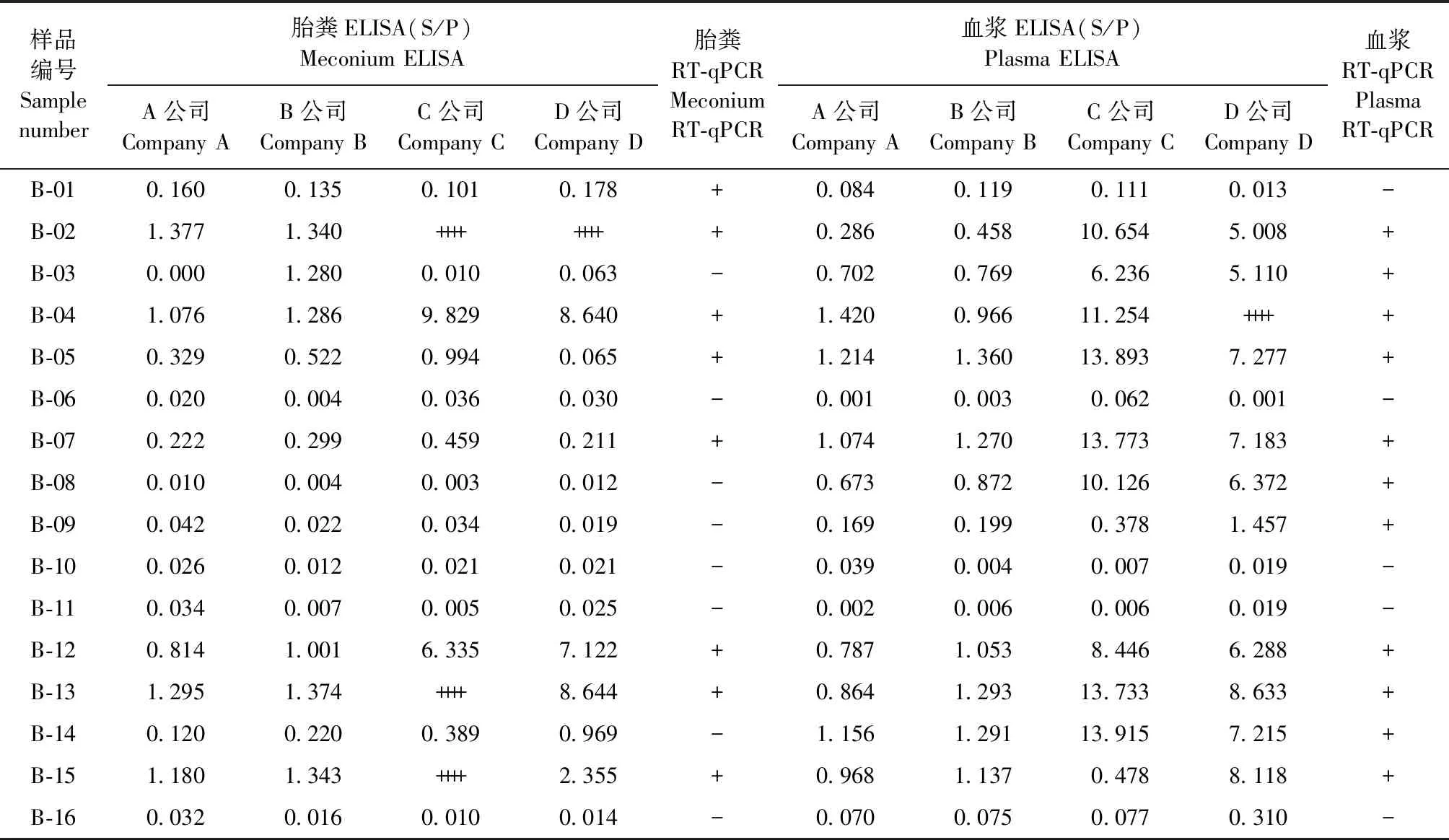
表3 ALV-B感染组不同类型样品利用不同检测方法检测的结果对比
2.3 ALV-J感染组不同检测方法结果对比 ALV-J感染组20枚鸡胚共有14只雏鸡孵化出壳,每只雏鸡胎粪和血浆病毒分离样品通过ELISA和RT-qPCR检测,结果如表4所示,大部分样品阴阳性判定结果基本一致,只有部分样品存在不一致的情况。例如:J-02胎粪样品直接ELISA 检测A公司和C公司判定结果为阴性,B公司和D公司判定结果与血浆病毒分离样品ELISA和RT-qPCR结果一致,均为阳性;J-05和J-06胎粪样品直接ELISA检测分别仅有A公司和D公司判定结果为阳性,与RT-qPCR结果一致,血浆病毒分离样品ELISA和血浆样品RT-qPCR结果均为阳性;J-07胎粪样品直接ELISA检测C公司和D公司判定结果为阴性,其他检测结果均为阳性。
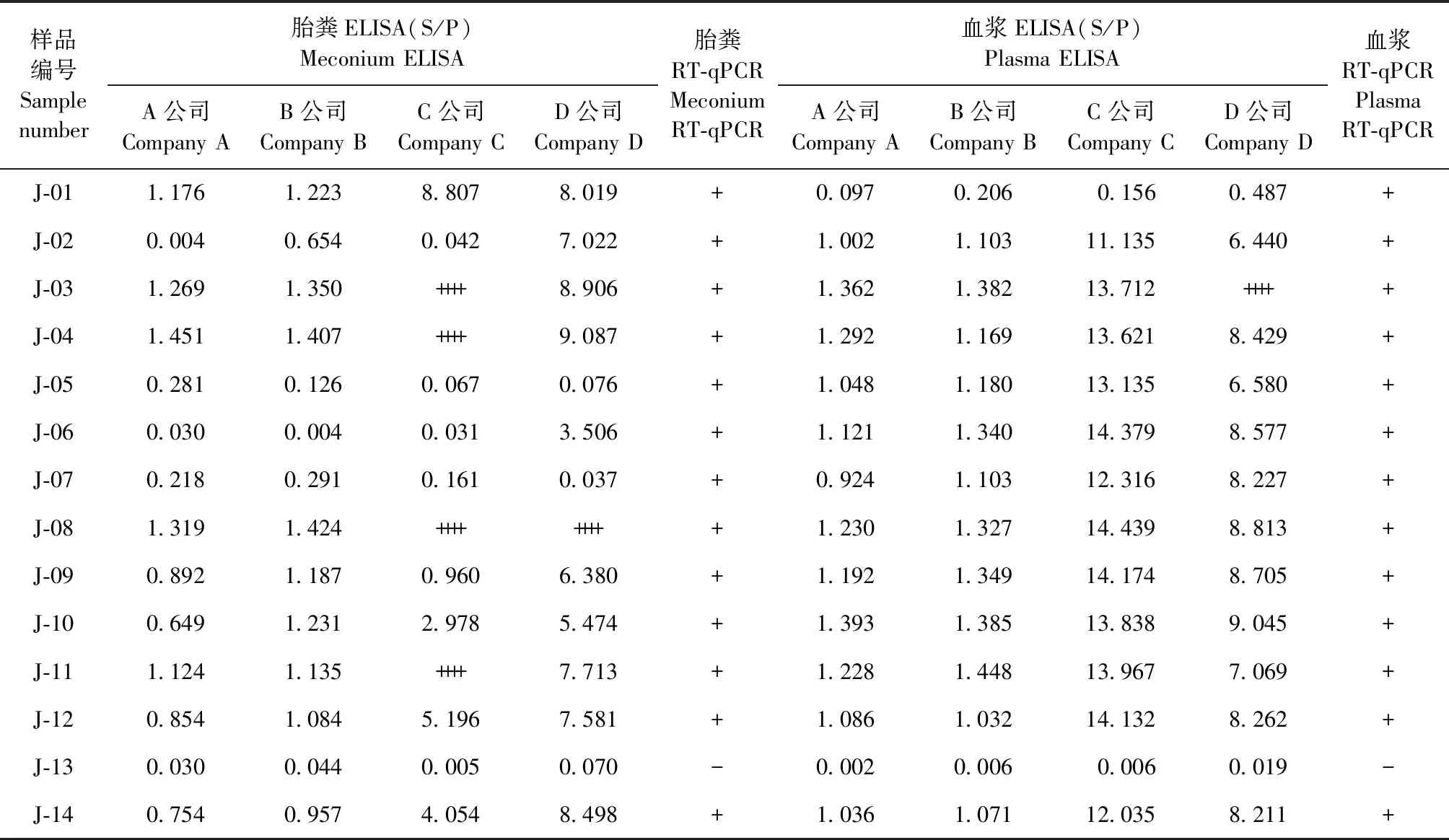
表4 ALV-J感染组不同类型样品利用不同检测方法检测的结果对比
2.4 ALV-K感染组不同检测方法结果对比 ALV-K感染组20枚鸡胚共有11只雏鸡孵化出壳,每只雏鸡胎粪和血浆病毒分离样品通过ELISA和RT-qPCR检测,结果如表5所示,大部分样品阴阳性判定结果基本一致,只有部分样品存在不一致的情况。例如:K-03胎粪样品直接ELISA和RT-qPCR结果均为阴性,而血浆病毒分离样品结果均为阳性;K-09胎粪样品直接ELISA和RT-qPCR结果均为阴性,血浆病毒分离样品ELISA检测仅B公司判定结果为阴性,但接近判定为阳性的临界值。

表5 ALV-K感染组不同类型样品利用不同检测方法检测的结果对比
2.5 死亡鸡胚肝脏样品不同检测方法结果对比 肝脏过滤液样品进行RT-qPCR检测,肝脏病毒分离样品进行ELISA检测,结果如表6所示,ALV-A和ALV-J感染组各有1份肝脏过滤液样品,ELISA和RT-qPCR结果均为阳性,即鸡胚肝脏中检出相应病毒;而ALV-K感染组4份肝脏过滤液样品中,ALV-K1和ALV-K2的ELISA和RT-qPCR结果均为阴性;ALV-K3经C公司ELISA试剂盒检测结果为阳性,其余3家公司ELISA和RT-qPCR结果均为阴性;ALV-K4的RT-qPCR结果为阳性,而ELISA结果为阴性。

表6 死亡鸡胚肝脏病毒分离样品ELISA与RT-qPCR检测的结果对比
2.6 死亡雏鸡不同样品的不同检测方法结果对比 部分死亡雏鸡的胎粪、血浆和肝脏样品分别进行RT-qPCR检测,血浆和肝脏病毒分离样品进行ELISA检测。结果如表7~9所示,ALV-A3胎粪样品直接ELISA检测结果为阴性,RT-qPCR检测结果为阳性,血浆和肝脏病毒分离样品ELISA和RT-qPCR结果也均为阳性;ALV-B3胎粪样品仅B公司直接ELISA结果和RT-qPCR结果为阳性;ALV-A4胎粪样品直接ELISA和RT-qPCR结果均为阴性,血浆和肝脏病毒分离样品ELISA结果仅有D公司结果为阳性,其余3家公司ELISA结果接近判定为阳性的临界值,RT-qPCR检测结果为阳性;ALV-A5和ALV-B1肝脏病毒分离样品仅有1家公司ELISA结果为阳性,而胎粪样品、血浆样品和肝脏样品的RT-qPCR结果均为阳性,表明不同试剂盒的灵敏度差异较大。
表7 死亡雏鸡胎粪样品ELISA与RT-qPCR检测的结果对比
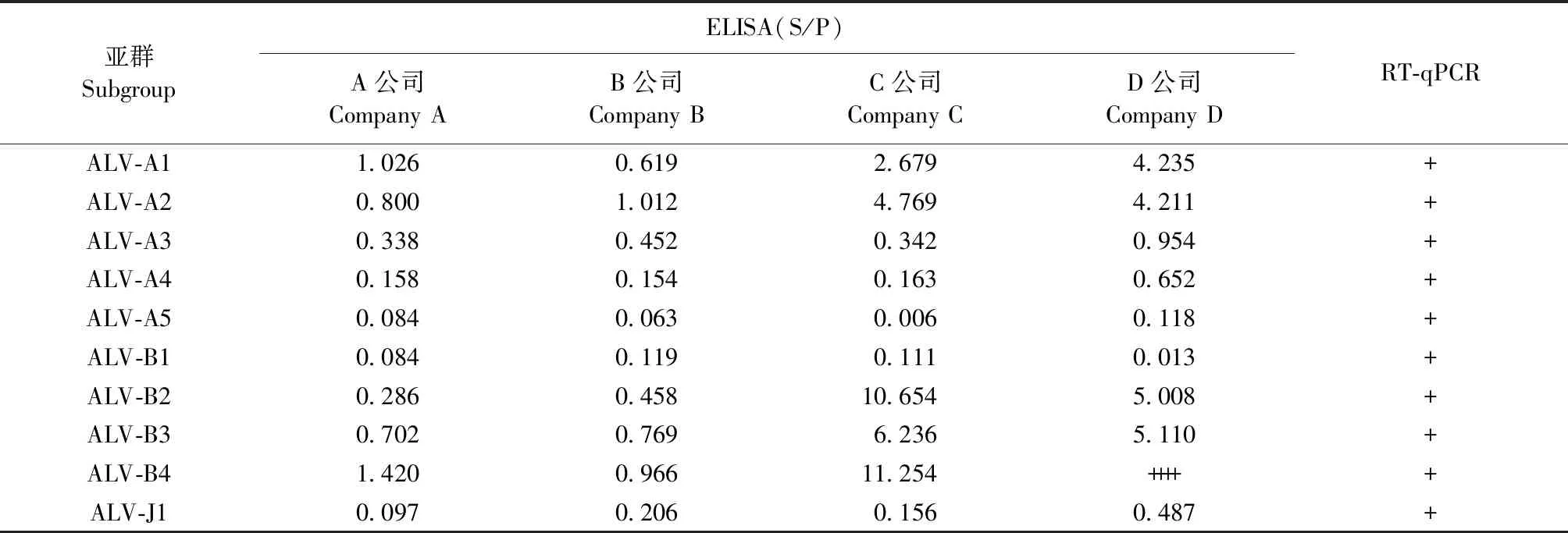
表8 死亡雏鸡血浆样品ELISA与RT-qPCR检测的结果对比
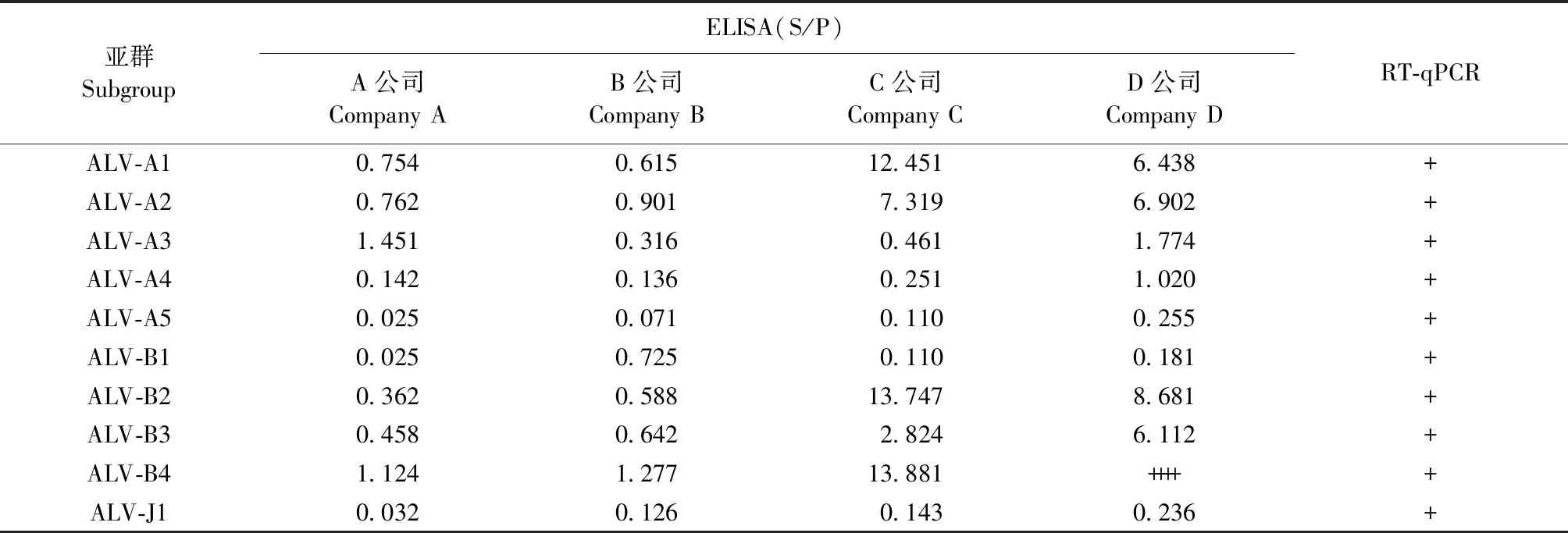
表9 死亡雏鸡肝脏样品ELISA与RT-qPCR检测的结果对比
3 讨论
ALV通过种源垂直传播的放大效应给养禽业造成了巨大经济损失,会导致鸡产生肿瘤、免疫抑制、生产性能下降甚至死亡等[13-15],还可能造成感染鸡产生免疫耐受。因此,疫苗对AL防治的意义不大,目前尚无针对AL的有效疫苗和药物,种源净化是控制AL最有效的手段。现有的AL净化程序主要采用胎粪p27抗原检测、蛋清p27抗原检测和病毒分离等不同检测方法,其中针对ALV-p27的ELISA试剂盒检测一直是针对批量样品检测的首选,特别是在数量庞大的出壳雏鸡胎粪检测方面发挥了关键作用[16-18]。样品直接进行p27抗原ELISA检测无法区分内源性ALV和外源性ALV,需要通过接种DF-1细胞进行病毒分离的方式确诊。病毒分离被认为是检测ALV感染的金标准,除了对细胞操作水平有较高的要求外,也要确保所使用的禽白血病抗原检测试剂盒既要有较好的特异性,更要有极高的灵敏度。
本试验通过SPF鸡胚卵黄囊分别感染ALV-A、ALV-B、ALV-J和ALV-K毒株,人工获取了鸡胚垂直感染不同亚群ALV的样品,包括出壳雏鸡胎粪和血浆、死亡鸡胚肝脏以及死亡雏鸡胎粪、血浆和肝脏样品。通过胎粪样品直接ELISA和血浆病毒分离样品ELISA检测,证实多数接种鸡均成功感染ALV,表明通过卵黄囊接种可使较高比例的雏鸡感染ALV。4个ALV感染组的胎粪样品直接ELISA检测与雏鸡血浆病毒分离后进行ELISA检测的结果总体上具有较好的吻合性,且4家公司ELISA试剂盒判定结果高度一致,这表明胎粪直接ELISA检测能及时检出大部分阳性样品,在水平传播比较严重的出壳初期及时将感染ALV的鸡检出并淘汰,有助于降低ALV的水平传播效率。
胎粪样品直接ELISA检测与血浆病毒分离样品ELISA检测的阳性检出率均存在差异,血浆病毒分离样品ELISA检测与RT-qPCR检测结果差异较小,表明血浆病毒分离样品ELISA检测结果准确性要高于胎粪直接ELISA检测。例如:A-03、A-12、A-13、B-08和K-03的胎粪样品直接ELISA检测结果均判定为阴性,血浆病毒分离样品ELISA检测结果均判定为阳性。相对而言,ALV-J感染组出壳雏鸡的胎粪样品直接ELISA检测结果和雏鸡血浆病毒分离样品ELISA检测结果基本一致,大部分判定结果为阳性,这很可能与鸡胚感染不同亚群ALV后出壳雏鸡的胎粪排毒能力有关,也切合临床上ALV-J水平传播能力较强的真实状态。
本试验还随机选取了部分死亡鸡胚和雏鸡的肝脏样品进行病毒分离,ALV-A和ALV-B感染组肝脏病毒分离和血浆病毒分离样品ELISA检测结果具有较高的吻合性。ALV-K感染组死亡鸡胚肝脏中病毒检出率较低,推测可能是在操作过程中对鸡胚造成了损伤,或者是ALV-K毒株在鸡胚内复制能力较弱,故未能形成高效感染。
本试验通过RT-qPCR对所有样品进行平行检测,RT-qPCR检出阳性率要高于ALV-p27抗原ELISA试剂盒,显示了分子生物学检测的灵敏度优势。需要强调的是,虽然本试验以期尽可能降低内源性ALV核酸对检测的干扰,但不能完全避免内源性ALV核酸的检出,如所有对照组SPF鸡胚肝脏样品的RT-qPCR检测结果平均CT值为24.98,1日龄SPF雏鸡肝脏样品和胎粪样品的RT-qPCR检测结果平均CT值分别为24.62和25.60,与各感染组的平均CT值差异较小。因本试验是对确定感染样品进行检测,其目的是通过RT-qPCR对ELISA结果进行复核和比较,但在对临床样品进行检测时,为避免内源性ALV核酸干扰引起假阳性,仍应以病毒分离样品ALV-p27抗原ELISA检测结果为标准。
此前,将不同滴度ALV感染细胞维持7 d后取上清进行ELISA检测,是对比不同ALV-p27抗原ELISA试剂盒的主要方法[19-21],其优点是样品阴阳性明确,容易判定和比较试剂盒的灵敏度,缺点是样品过于完美化,难于反映出胎粪和蛋清等不同样品对于检测过程的干扰。本试验以鸡胚感染ALV-A、ALV-B、ALV-J和ALV-K模拟生产中的ALV垂直传播,以确定的ALV毒株感染样品构建了样品盘,能够相对较好的弥补单纯细胞样品评估方式的缺点。需要强调的是,我国品质繁多的鸡品系中,内源性ALV的p27蛋白表达规律是非常复杂的,比SPF鸡中p27蛋白的表达规律要复杂得多,因此本次对比试验也仅能作为对特定批次试剂盒的一次单品系对比。建议对不同检测试剂盒和不同检测方法在我国更多品系的临床鸡品种中开展更多的对比检测,为不断优化试剂盒和净化检测方法提供参考依据。
